家蚕IAP互作蛋白的筛选、鉴定及其对BmNPV增殖的影响
2019-02-20陈鹏包希艳康涛涛董战旗朱艳潘敏慧鲁成
陈鹏,包希艳,康涛涛,董战旗,朱艳,潘敏慧,鲁成
家蚕IAP互作蛋白的筛选、鉴定及其对BmNPV增殖的影响
陈鹏1,2,包希艳1,康涛涛1,董战旗1,朱艳1,潘敏慧1,2,鲁成1,2
(1西南大学家蚕基因组生物学国家重点实验室,重庆 400715;2西南大学农业部蚕桑生物学与遗传育种重点实验室,重庆 400715)
【目的】细胞凋亡作为昆虫免疫应答的重要组成部分,在病毒与宿主相互作用的过程中扮演着重要角色,以细胞凋亡相关基因为研究对象对阐明其在病毒感染过程中的作用具有重要的参考价值。本研究旨在筛选家蚕凋亡抑制蛋白(inhibitor of apoptosis protein,BmIAP)的相互作用蛋白,并验证其在家蚕核型多角体病毒(nucleopolyhedrovirus, BmNPV)侵染过程中与的相互调控关系及在BmNPV增殖过程中的作用,为探明宿主与BmNPV相互作用的分子机制提供理论依据。【方法】利用免疫共沉淀技术筛选在BmNPV侵染家蚕细胞过程中与BmIAP相互作用的蛋白,对获得的特异性差异条带进行LC-MS/MS蛋白质谱分析,根据蛋白分子量大小并利用生物信息学方法对获得的蛋白进行鉴定,确定候选基因;通过分子克隆技术对候选基因进行克隆,利用SMART在线工具及BioEdit分别对候选基因的结构域进行预测及多序列比对分析;通过免疫荧光试验验证BmIAP和候选蛋白的细胞共定位情况,并进一步利用免疫共沉淀验证它们的相互作用;分别通过真核表达和基于CRISPR/Cas9的基因编辑系统对候选基因进行过表达和敲除,利用qRT-PCR技术检测相应基因的表达情况,以确定和在BmNPV侵染过程中的调控关系;同样,在过表达和敲除后检测杆状病毒的表达量,以确定对BmNPV增殖的影响。【结果】通过免疫共沉淀获得7个可能与BmIAP相互作用的宿主蛋白和1个BmNPV蛋白,进一步分析确定1个与凋亡相关的候选基因;的开放阅读框为1 473 bp,编码490个氨基酸,预测的蛋白分子量约为56 kD,含3个TRP结构域和1个PP2Ac结构域,在昆虫间具有较高的保守性;免疫荧光检测证明BmIAP和BmPP5共定位于细胞质中,免疫共沉淀结果表明两者可以相互作用;在BmNPV侵染过程中,过表达后,的表达量显著上调,而敲除后,的表达量显著下调,表明能够促进的表达;同时,过表达后,显著上调表达,而敲除后,显著下调表达,表明同样能够促进的表达;过表达能够促进BmNPV的增殖,敲除能够抑制BmNPV的增殖,表明的表达利于BmNPV的增殖。【结论】鉴定了1个能够与BmIAP相互作用的蛋白BmPP5,且该蛋白在昆虫中高度保守;在BmNPV侵染过程中,和能够相互促进,且能够促进BmNPV的复制增殖。
家蚕;凋亡抑制蛋白;互作蛋白;家蚕核型多角体病毒;BmPP5
0 引言
【研究意义】杆状病毒是一类专门寄生于无脊椎动物的病毒,尤其是鳞翅目、双翅目和膜翅目昆虫。作为一种细胞内寄生物,杆状病毒与宿主细胞以及机体的相互作用关系决定了病毒感染、复制和致病的分子机制。细胞凋亡作为机体细胞内的免疫直接参与病毒感染的应答,启动宿主细胞的凋亡机制。家蚕核型多角体病毒(nucleopolyhedrovirus,BmNPV)作为家蚕血液型脓病的病原,属于杆状病毒的一种,也是蚕业生产上危害最严重的病原微生物之一。对BmNPV致病机制的研究可为家蚕抗BmNPV病毒新品种的培育提供新的思路和重要理论支撑,同时,以细胞凋亡相关基因为研究对象对阐明其在杆状病毒感染过程中的作用具有重要的参考价值。【前人研究进展】杆状病毒是一类具有环状、超螺旋、双链DNA(80—180 kb)的病毒,其与宿主的相互作用机制一直是研究的热点[1]。当杆状病毒侵染宿主时,宿主细胞会通过调控自身的相关基因通路来应对病毒的入侵和增殖,如细胞凋亡[2-3]、DNA损伤应答[4]、热休克应答[5-6]和miRNA通路[7-8]等。研究表明,家蚕感染BmNPV后,在不同的时间点会引起一系列信号通路的变化,如能量代谢、细胞骨架、铁离子代谢和泛素蛋白酶体途径等[9]。同时,病毒在进化过程中,除了自身蛋白可以相互作用以促进其增殖复制[10],也获得了多种逃逸机体免疫反应的机制,如抑制宿主细胞凋亡[11-13]、挟持宿主细胞DNA损伤应答[14-15]、关闭宿主蛋白合成[16]、阻断宿主细胞周期[17-18]等。其中,细胞凋亡作为昆虫免疫应答的重要组成部分,在病毒与宿主的“斗争”过程中起着重要作用[19]。病毒的复制严格依赖于宿主细胞,过早的细胞凋亡会影响病毒的增殖和持续感染,因此,细胞凋亡被宿主作为为一种重要防御策略,可以有效抑制病毒复制增殖,降低病毒的扩散速度[20-21]。然而,在病毒与宿主相互作用的过程中,细胞凋亡相关基因的具体功能及作用机制仍需要深入的研究。笔者实验室前期研究表明,在家蚕中存在4个凋亡抑制基因(inhibitor of apoptosis,IAP)家族成员(、和)[22],其中有研究表明具有明确的抑制细胞凋亡功能[23-24]。然而,在BmNPV侵染过程中的作用尚需进一步研究。【本研究切入点】以昆虫重要的先天免疫应答反应——细胞凋亡作为切入点,家蚕凋亡抑制基因作为研究对象,鉴定在BmNPV侵染家蚕细胞过程中与其相互作用的蛋白,并对获得的蛋白功能进行验证。【拟解决的关键问题】鉴定在BmNPV侵染过程中与BmIAP相互作用的蛋白,并验证相应蛋白与BmIAP的调控关系及其对BmNPV增殖的影响,为抗BmNPV家蚕品种培育提供分子靶标,并为深入阐明杆状病毒和宿主相互作用机制提供理论依据。
1 材料与方法
试验于2016—2018年在家蚕基因组生物学国家重点实验室(西南大学)完成。
1.1 试验材料
家蚕卵巢细胞系BmN-SWU1[25]由家蚕基因组生物学国家重点实验室保存,用含10%胎牛血清的TC-100昆虫培养基在27℃条件下恒温培养。重组BmNPV病毒(v39Kprm-EGFP)[26]由家蚕基因组生物学国家重点实验室保存。
1.2 质粒构建和转染
根据目的基因序列设计相应引物,并在上下游引物分别添加相应的酶切位点、保护碱基和标签序列(表1),在GenBank中的序列号为NM_001043559.1,基因克隆步骤参考张倩等[27]的方法。用于构建过表达和敲除质粒的载体分别为pIZ/V5-His载体和本研究小组构建的基于Cas9的转基因敲除载体[28]。家蚕BmN-SWU1细胞均匀铺到12孔板中,每孔按单转1 μg,共转各0.8 μg质粒计算;质粒和X-tremeGENE HP DNA Transfection Reagent(Roche)转染试剂按1﹕3,加入100 μl无抗培养基,轻轻呈滴状混匀,室温孵育30 min;将上述转染混合物逐滴加入细胞中,轻轻晃动混匀,置于27℃恒温箱培养,培养6—8 h换液,按试验需要进行后续处理。

表1 引物信息
1.3 总RNA提取和cDNA合成
家蚕BmN-SWU1细胞总RNA使用TRIzol Reagent(Invitrogen)提取,使用反转录试剂盒(Promega)合成cDNA,操作按说明书进行,保存于-20℃备用。按照1.2方法转染48 h,感染BmNPV 12、24、48、72 h后收集细胞。使用总RNA提取试剂盒(OMEGA),加入500 μl的TRK Lysis Buffer充分裂解细胞,后收集到1.5 mL无RNA酶的EP管中;加入75%乙醇250 μl轻轻摇匀,将上述样品移至RNA吸附柱,室温静置5 min后,4℃,10 000×离心1 min;用RNA Wash Buffer I、II,各清洗两次;用 60℃的35 μL DEPC水溶解RNA;采用紫外分光光度计检测洗脱下来RNA,合格后-80℃保存。
按上述方法提取总RNA,使用逆转录试剂盒(Takara)反转录cDNA。在4℃配制去除基因组DNA的混合液,将上述混合液加入总RNA中,42℃,2 min;4℃配制反转录混合液,将上述混合液加入已去除基因组的RNA中,37℃,1.5 min;85℃,5 s;12℃保存。将反转合成的cDNA稀释后用的引物做PCR扩增,合格cDNA贮存于-20℃备用。
1.4 免疫荧光检测
取待检测的细胞在室温用PBS洗2次;4%多聚甲醛室温固定15 min;用PBST在室温漂洗5次,每次6 min;0.1% Triton 100室温孵育10 min;用PBST在室温漂洗5次,每次6 min;封闭液(10%羊血清加3% BSA,用PBS配制)封闭1 h,37℃;37℃一抗(HA抗体或Flag抗体,1﹕500,sigma)孵育1 h;用PBST在室温漂洗5次,每次6 min;在37℃用不同荧光标记的二抗(1﹕1 000,碧云天)孵育1 h;室温DAPI(碧云天)染细胞核10 min;用PBST在室温漂洗5次,每次6 min;将铺满细胞的爬片封到载玻片上,使用激光共聚焦显微镜进行观察拍照。
1.5 免疫共沉淀与质谱鉴定
取转染目的质粒48 h后的细胞并倒掉培养基,PBS洗两遍;加入1 mL IP裂解液(IP裂解液﹕PMSF=100﹕1)冰浴轻摇30 min;将裂解下的细胞转移至1.5 mL离心管中,液氮反复冻融2—3次;10 000 ×,4℃,离心30 min,取上清50 µL转移至1.5 mL离心管中,加入5×SDS-PAGE 蛋白上样缓冲液,煮10 min,作为总蛋白;重悬磁珠,取60 µL磁珠放到磁力架上吸去废液,以400 µL IP裂解液洗一遍;加400 µL IP裂解液和3 µL抗体,翻转摇床上常温孵育40—50 min;将上步中孵育了抗体的磁珠放至磁力架上,弃液;将剩余裂解液与上步中的磁珠混匀,翻转摇床上室温孵育2 h;将1.5 mL的离心管放至磁力架上,吸掉孵育液;用PBS洗3遍,每遍500 µL;加入60 µL的IP裂解液和15 µL的5×SDS-PAGE蛋白上样缓冲液,煮10 min;将离心管放到磁力架上,将样品吸出,进行SDS-PAGE分析;电泳结束后用硝酸银进行凝胶染色,对银染后呈现的差异条带进行切胶回收,通过LC-MS/MS分析,得到相应蛋白质信息,通过检索家蚕蛋白数据库(http://www.silkdb.org/ silkdb/doc/download.html)和NCBI中的BmNPV蛋白数据库(http://www.ncbi.nlm.nih.gov/taxonomy/?term= BmNPV)对蛋白进行鉴定(此部分委托深圳华大完成)。
1.6 Western blot和银染分析
制备12%的SDS-PAGE凝胶,上样并进行电泳;200 mA转膜50 min;把PVDF膜放入封闭液中,室温摇床孵育3 h;将PVDF膜从封闭液中取出放入一抗稀释液中,4℃孵育过夜;在1×TBST缓冲液中清洗5次(室温),每次10 min;将PVDF膜放入二抗稀释液中,室温孵育2 h;将配好的ECL显色液均匀的滴在PVDF膜上,避光显色约5 min;在化学发光成像仪上曝光成像。
1.7 荧光定量PCR(qRT-PCR)检测
qRT-PCR反应条件:95℃,4 min;95℃,15 s,60℃,31 s,40个循环;95℃,15 s;60℃,20 s;95℃,15 s。所用引物见表1,试剂为iTaqTMUniversal SYBR®Green Supermix(Bio-Rad),以家蚕真核翻译起始因子4A(探针号:sw22934)为内参,相对定量PCR的数据处理用2-ΔCT法。
2 结果
2.1 BmNPV侵染过程中BmIAP相互作用蛋白筛查
为检测在BmNPV侵染家蚕细胞过程中与BmIAP相互作用的蛋白,通过免疫共沉淀技术获得了BmN- SWU1细胞中与BmIAP的免疫共沉淀复合物。将收集的免疫共沉淀蛋白复合物进行SDS-PAGE电泳,经硝酸银染色后分析发现,与对照组相比,BmIAP-Flag融合蛋白的免疫共沉淀结果中有1条明显的特异性条带,大小在40—50 kD(图1)。特异性差异条带经LC-MS/MS蛋白质谱分析,将多肽序列与SilkDB和BmNPV蛋白数据库比对,共鉴定到45个蛋白。根据蛋白分子量大小对鉴定到的蛋白进行筛选,获得7个可能与BmIAP相互作用的宿主蛋白,同时有1个BmNPV蛋白ORF76(表2)。进一步对获得的蛋白功能进行分析,发现(编码丝氨酸/苏氨酸蛋白磷酸酶,Ser/thr protein phosphatase 5,PP5)的同源基因具有凋亡相关的功能[29-30],因此在本研究中将其作为主要研究对象,并命名为BmPP5(ser/thr protein phosphatase 5)。
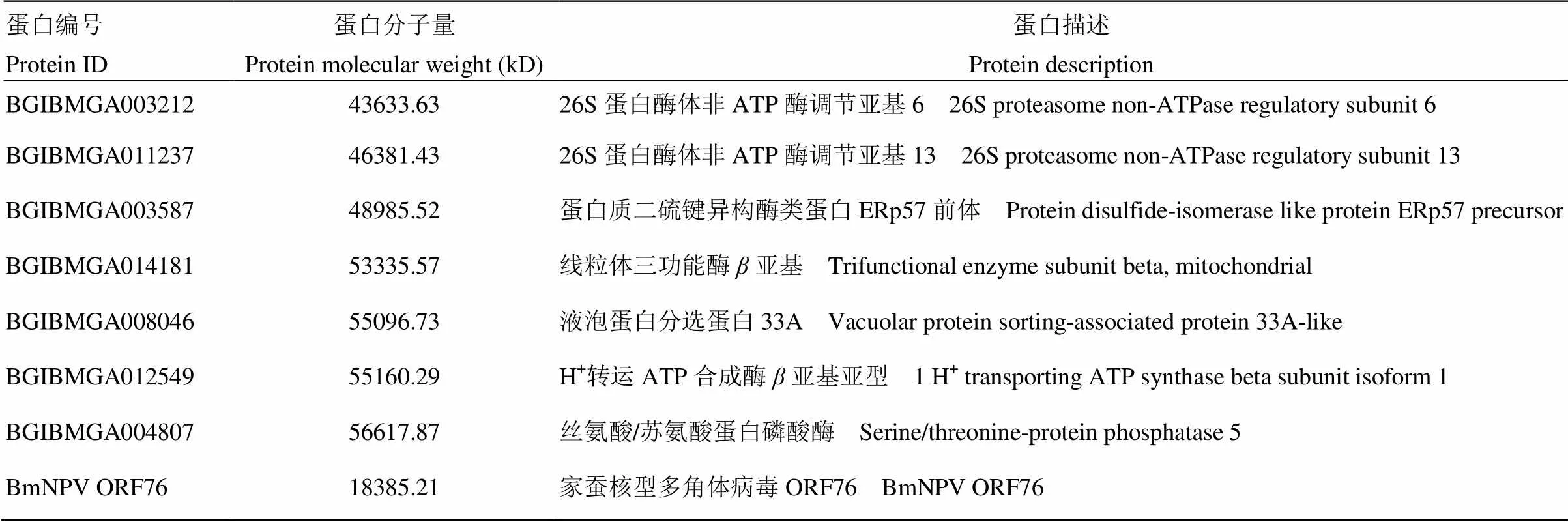
表2 LC-MS/MS鉴定与BmIAP相互作用的蛋白

Marker:蛋白分子量预染Marker Protein molecular weight marker;Input:BmNPV感染BmN-SWU1细胞总蛋白input cell lysates;IgG:阴性血清IgG的免疫共沉淀结果IP with control mouse IgG;Flag:Flag抗体的免疫共沉淀结果;黑色箭头指示差异条带IP with Flag antibody; Black arrow indicates the specific band
2.2 Bmpp5克隆及序列特征分析
成功克隆了的CDS序列,其中开放阅读框(open reading frame,ORF)为1 473 bp,编码490个氨基酸,预测的蛋白分子量约为56 kD。利用SMART在线工具(http://smart.embl-heidelberg.de/)对BmPP5的结构域进行预测发现,该基因有3个Tetratricopeptide Repeat(TRP)结构域和1个PP2Ac结构域(图2-A)。分别利用家蚕、斜纹夜蛾()、埃及伊蚊()及果蝇()的PP5同源蛋白进行多序列比对,结果表明该基因在昆虫中高度保守(图2-B)。
2.3 BmIAP和BmPP5的相互作用鉴定
利用免疫荧光和免疫共沉淀进一步验证BmIAP蛋白与其钓取到的候选互作蛋白BmPP5是否存在相互作用。构建了(融合Flag标签)和(融合HA标签)的真核过表达载体,转染家蚕BmN- SWU1细胞,48 h后通过免疫荧光观察其定位,结果发现带有Flag标签的BmIAP蛋白能够与带有HA标签的BmPP5蛋白共定位于细胞质中(图3-A),暗示它们之间可能存在相互作用。为进一步确定BmIAP和BmPP5之间的关系,将以上两个过表达载体共转家蚕BmN-SWU1细胞48 h后,收集细胞,用Flag标签抗体为诱饵,小鼠IgG抗体为对照,通过免疫共沉淀对BmIAP和BmPP5的相互作用进行验证。结果显示,无论是用Flag抗体还是HA抗体进行western blot检测,均能检测到相应目的蛋白的表达(图3-B),表明BmIAP和BmPP5之间存在相互作用。
2.4 Bmiap和Bmpp5在BmNPV侵染过程中的调控分析
为了分析和在BmNPV侵染过程中的调控关系,首先通过在BmN-SWU1细胞中过表达或敲除,然后利用BmNPV侵染细胞,通过qRT-PCR检测的表达水平。结果显示,过表达后,的表达量显著上调(图4-A),其中24 h时上调不显著,推测可能是由于BmNPV不同的复制时期造成的;而敲除后,的表达量显著下调(图4-B),表明对具有一定的促进作用。
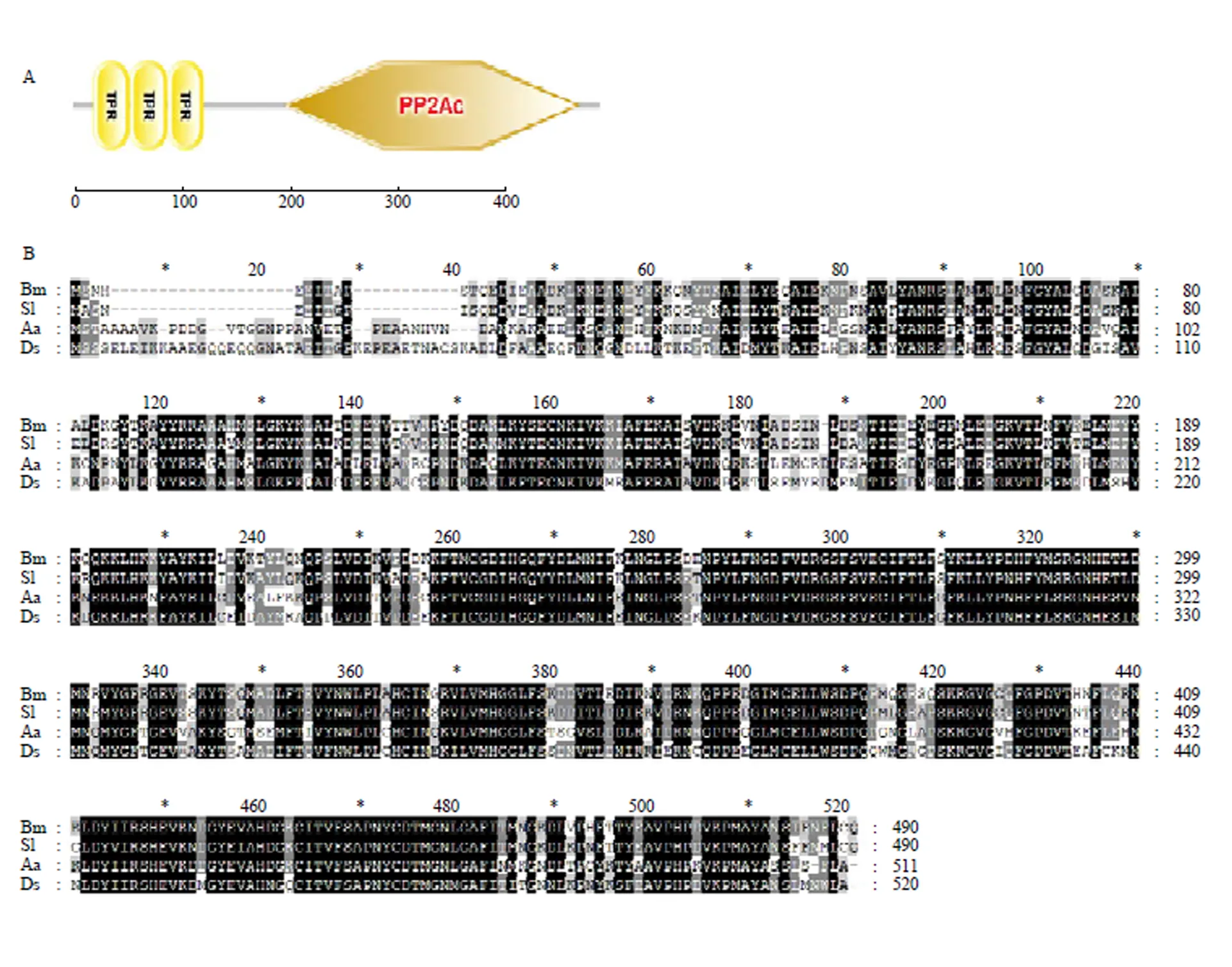
A:SMART预测BmPP5的结构域 Prediction of BmPP5 domains by SMART,TPR:19—52 aa、53—86 aa、87—120 aa;PP2Ac:195—471 aa。B:BmPP5蛋白多序列比对 Multiple sequence alignment of BmPP5 protein。Bm:家蚕Bombyx mori(XP_012553114.1);Sl:斜纹夜蛾Spodoptera litura(XP_022817467.1);Aa:埃及伊蚊Aedes aegypti(XP_001650298.2);Ds:果蝇Drosophila serrata(XP_020818529.1)

图3 免疫荧光和免疫共沉淀分析BmIAP和BmPP5的相互作用
同样,通过分别在BmN-SWU1细胞中过表达或敲除,并检测的表达情况。结果显示,过表达后,显著上调表达(图4-C),而敲除后,的显著下调表达(图4-D),表明同样能够促进的表达。
2.5 Bmpp5对BmNPV增殖的影响
为了进一步验证在BmNPV增殖过程中的作用,分别在BmN-SWU1细胞中过表达或敲除后,利用BmNPV侵染细胞,并检测杆状病毒的表达水平。结果显示,过表达后在感染24 h时能够在一定程度上引起的下调表达,推测在BmNPV感染前期引起的宿主细胞免疫反应可能对BmNPV增殖有一定的抑制作用,而在感染后期能够引起的上调表达;敲除后,的表达下调(图5),表明的表达利于BmNPV的增殖。
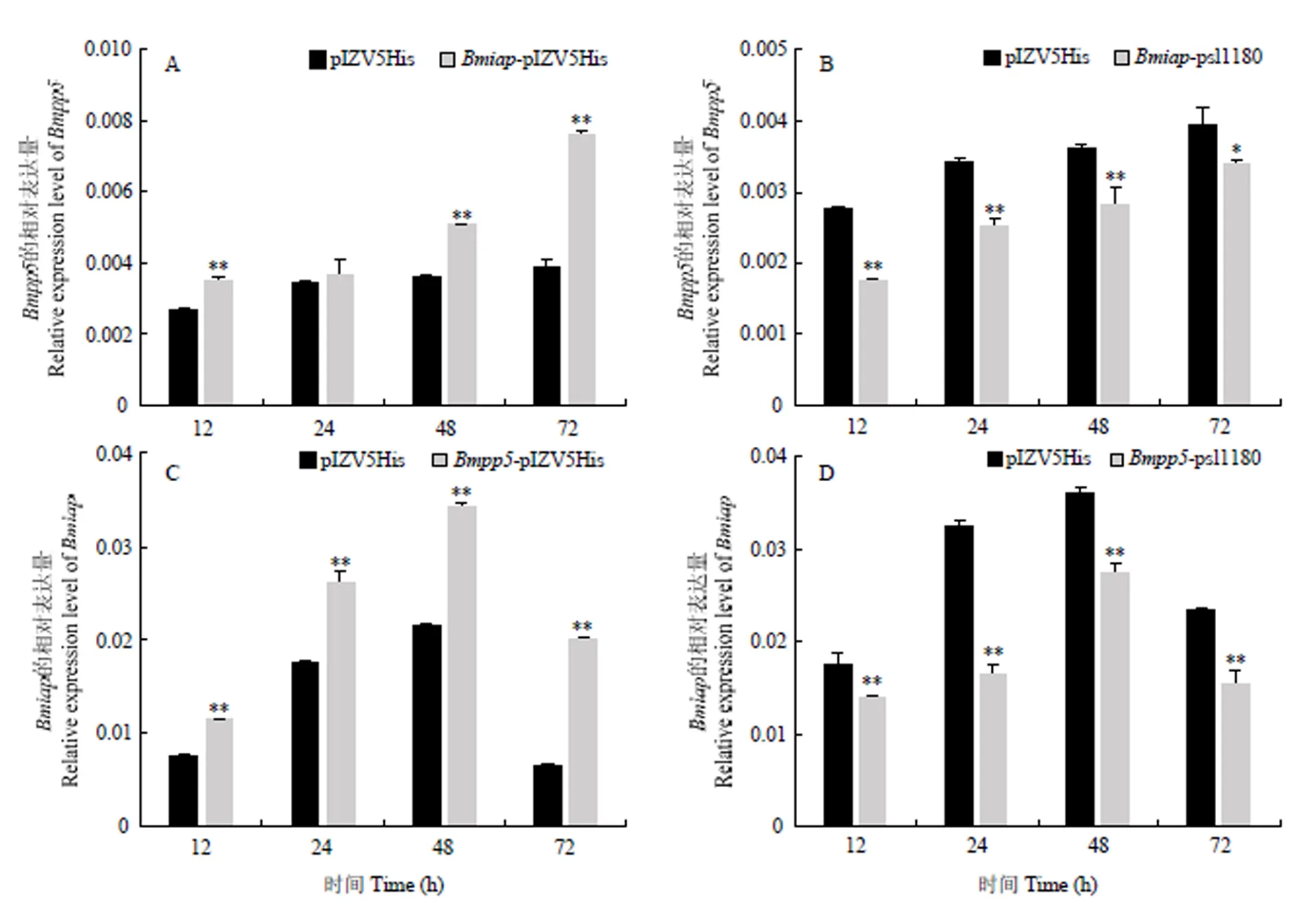
A:过表达Bmiap对Bmpp5的影响Effect of overexpression of Bmiap on Bmpp5;B:敲除Bmiap对Bmpp5的影响Effect of knockout of Bmiap on Bmpp5;C:过表达Bmpp5对Bmiap的影响Effect of overexpression of Bmpp5 on Bmiap;D:敲除Bmpp5对Bmiap的影响Effect of knockout of Bmpp5 on Bmiap。*P<0.05;**P<0.01
3 讨论
细胞凋亡作为昆虫免疫应答的重要组成部分,可以有效抵御病毒的复制增殖,而宿主和病毒中凋亡抑制基因()的同时存在[31-32],暗示其可能在病毒与宿主相互作用过程中起着重要作用,同时也为研究其分子机制提供了极好的切入点。
PP5属于蛋白磷酸酶家族成员,参与多种信号通路,如DNA损伤、细胞生长、细胞凋亡等[29-30,33-34],其能够使许多与细胞应激反应相关的蛋白去磷酸化,如凋亡信号调节激酶(ASK-1)[35]、DNA-PKcs[36]等。本研究证明了BmPP5能够与BmIAP蛋白发生相互作用,并且在BmNPV侵染过程中,促进上调表达的同时,同样能够促进的表达,进而使细胞凋亡受到抑制。由此,笔者推测BmIAP和BmPP5的相互作用能够促进二者的表达,但是如何相互作用并不清楚。PP5在DNA损伤修复以及下游细胞周期阻滞和细胞凋亡过程主要是通过对ATM(ataxia telangiectasia mutated)、53BP1等蛋白磷酸化修饰,参与非同源末端连接和同源重组修复。因此,BmPP5对BmIAP蛋白磷酸化修饰调控细胞凋亡通路的过程是未来研究的重点。此外,还发现能够促进BmNPV的增殖,表明在BmNPV侵染过程中,和间可能存在正反馈调节作用,增强对宿主细胞的凋亡抑制作用,使BmNPV可以充分利用宿主细胞进行自身的复制增殖,这也进一步证明了细胞凋亡途径在杆状病毒与宿主的相互作用过程中起着重要作用。

A:过表达Bmpp5 Overexpression of Bmpp5;B:敲除Bmpp5 Knockout of Bmpp5。**P<0.01
本研究以家蚕为研究对象,通过免疫共沉淀鉴定并筛选与其相互作用的基因,根据分子量大小共筛选得到7个家蚕基因,同时还获得1个BmNPV的基因。BmNPV几乎存在于所有的杆状病毒基因组中,暗示着其功能的重要性。该基因在AcMNPV中的同源基因为,研究表明敲除的突变体将不能产生感染性的BV,并且可能参与了核内微泡的形成[37]。同样,敲除后的BmNPV bacmid也不会产生BV[38],表明该基因的功能具有一定的保守性。BmNPV ORF76与BmIAP的相互作用机制及其功能的解析也将是后续研究的重点内容。
4 结论
鉴定了与BmIAP相互作用的蛋白BmPP5,该蛋白在昆虫中具有较高的保守性。证明了在家蚕核型多角体病毒(BmNPV)侵染过程中和能够相互促进,同时能够促进BmNPV的复制增殖。
[1] van Oers M M, Vlak J M. Baculovirus genomics., 2007, 8(10): 1051-1068.
[2] Nguyen Q, Palfreyman R W, Chan L C, Reid S, Nielsen L K. Transcriptome sequencing and microarray development for acell line to investigateinsect cell-baculovirus interactions., 2012, 7(5): e36324.
[3] Vandergaast R, Schultz K L, Cerio R J, Friesen P D. Active depletion of host cell inhibitor-of-apoptosis proteins triggers apoptosis upon baculovirus DNA replication., 2011, 85(16): 8348-8358.
[4] Mitchell J K, Friesen P D. Baculoviruses modulate a proapoptotic DNA damage response to promote virus multiplication., 2012, 86(24): 13542-13553.
[5] Salem T Z, Zhang F, Xie Y, Thiem S M. Comprehensive analysis of host gene expression innucleopolyhedrovirus-infectedcells., 2011, 412(1): 167-178.
[6] Bao Y Y, Lv Z Y, Liu Z B, Xue J, Xu Y P, Zhang C X. Comparative analysis ofnucleopolyhedrovirus responsive genes in fat body and haemocyte ofresistant and susceptible strains., 2010, 19(3): 347-358.
[7] Mehrabadi M, Hussain M, Asgari S. MicroRNAome ofcells (Sf9) and its alteration following baculovirus infection., 2013, 94(6): 1385-1397.
[8] Yu X, Zhou Q, Li S C, Luo Q, Cai Y, Lin W C, Chen H, Yang Y, Hu S, Yu J. The silkworm () microRNAs and their expressions in multiple developmental stages., 2008, 3(8): e2997.
[9] Xue J, Qiao N, Zhang W, Cheng R L, Zhang X Q, Bao Y Y, Xu Y P, Gu L Z, Han J D, Zhang C X. Dynamic interactions betweennucleopolyhedrovirus and its host cells revealed by transcriptome analysis., 2012, 86(13): 7345-7359.
[10] 蒋亚明, 董战旗, 陈婷婷, 胡楠, 董非凡, 黄亮, 唐良彤, 潘敏慧. 杆状病毒LEF-11蛋白自身相互作用关键区域的鉴定. 中国农业科学, 2017, 50(20): 4028-4035.
JIANG Y M, DONG Z Q, CHEN T T, HU N, DONG F F, HUANG L, TANG L T, PAN M H. Identification the key areas ofnucleopolyhedrovirus LEF-11 self-interaction., 2017, 50(20): 4028-4035. (in Chinese)
[11] CLEM R J. Baculoviruses and apoptosis: a diversity of genes and responses., 2007, 8(10): 1069-1074.
[12] Monteiro F, Carinhas N, Carrondo M J, Bernal V, Alves P M. Toward system-level understanding of baculovirus-host cell interactions: from molecular fundamental studies to large-scale proteomics approaches., 2012, 3: Article 391.
[13] Guy M P, Friesen P D. Reactive-site cleavage residues confer target specificity to baculovirus P49, a dimeric member of the P35 family of caspase inhibitors., 2008, 82(15): 7504-7514.
[14] Huang N, Wu W, Yang K, Passarelli A L, Rohrmann G F, Clem R J. Baculovirus infection induces a DNA damage response that is required for efficient viral replication., 2011, 85(23): 12547-12556.
[15] Mitchell J K, Byers N M, Friesen P D. Baculovirus F-box protein LEF-7 modifies the host DNA damage response to enhance virus multiplication., 2013, 87(23): 12592-12599.
[16] Shirata N, Ikeda M, Kobayashi M. Identification of anucleopolyhedrovirus (NPV) gene that is involved in global protein synthesis shutdown and restrictedNPV multiplication in acell line., 2010, 398(2): 149-157.
[17] Kannan R P, Hensley L L, Evers L E, Lemon S M, McGivern D R. Hepatitis C virus infection causes cell cycle arrest at the level of initiation of mitosis., 2011, 85(16): 7989-8001.
[18] Ding L, Huang Y, Dai M, Zhao X, Du Q, Dong F, Wang L, Huo R, Zhang W, Xu X, Tong D. Transmissible gastroenteritis virus infection induces cell cycle arrest at S and G2/M phases via p53-dependent pathway., 2013, 178(2): 241-251.
[19] Everett H, McFadden G. Apoptosis: an innate immune response to virus infection., 1999, 7(4): 160-165.
[20] Huang Y, Liu H, Li S, Tang Y, Wei B, Yu H, Wang C. MAVS-MKK7-JNK2 defines a novel apoptotic signaling pathway during viral infection., 2014, 10(3): e1004020.
[21] Zmasek C M, Godzik A. Evolution of the animal apoptosis network//Baehrecke E H, Green D R, Kornbluth S, Salvesen G S., 2013, 5: a008649.
[22] Zhang J Y, Pan M H, Sun Z Y, Huang S J, Yu Z S, Liu D, Zhao D H, Lu C. The genomic underpinnings of apoptosis in the silkworm,., 2010, 11: 611.
[23] Huang Q, Deveraux Q L, Maeda S, Stennicke H R, Hammock B D, Reed J C. Cloning and characterization of an inhibitor of apoptosis protein (IAP) from., 2001, 1499(3): 191-198.
[24] Hamajima R, Iwamoto A, Tomizaki M, Suganuma I, Kitaguchi K, Kobayashi M, Yamada H, Ikeda M. Functional analysis of inhibitor of apoptosis 1 of the silkworm., 2016, 79: 97-107.
[25] Pan M H, Cai X J, Liu M, Lv J, Tang H, Tan J, LU C. Establishment and characterization of an ovarian cell line of the silkworm,., 2010, 42(1): 42-46.
[26] Zhang J, He Q, Zhang C D, Chen X Y, Chen X M, Dong Z Q, Li N, Kuang X X, Cao M Y, Lu C, Pan M H. Inhibition of BmNPV replication in silkworm cells using inducible and regulated artificial microRNA precursors targeting the essential viral gene., 2014, 104: 143-152.
[27] 张倩, 刘太行, 董小龙, 吴云飞, 杨基贵, 周亮, 潘彩霞, 潘敏慧. 家蚕CDK11与RNPS1和9G8相互作用的鉴定. 中国农业科学, 2017, 50(22): 4398-4407.
ZHANG Q, LIU T H, DONG X L, WU Y F, YANG J G, ZHOU L, PAN C X, PAN M H. Identification of the interactions of CDK11 with RNPS1 and 9G8 in the silkworm ()., 2017, 50(22): 4398-4407. (in Chinese)
[28] Dong Z Q, Chen T T, Zhang J, Hu N, Cao M Y, Dong F F, JIANG Y M, CHEN P, LU C, PAN M H. Establishment of a highly efficient virus-inducible CRISPR/Cas9 system in insect cells., 2016, 130: 50-57.
[29] Zhou B H, Wang H W, Zhao Z S, Liu M, Yan W C, Zhao J, Zhang Z, Xue F Q. A novel serine/threonine protein phosphatase type 5 from second-generation merozoite ofis associated with diclazuril-induced apoptosis., 2013, 112(4): 1771-1780.
[30] Wang J, Zhu J, Dong M, Yu H, Dai X, Li K. Inhibition of protein phosphatase 5 (PP5) suppresses survival and growth of colorectal cancer cells., 2015, 62(5): 621-627.
[31] Berthelet J, Dubrez L. Regulation of apoptosis by inhibitors of apoptosis (IAPs)., 2013, 2(1): 163-187.
[32] Uren A G, Coulson E J, Vaux D L. Conservation of baculovirus inhibitor of apoptosis repeat proteins (BIRPs) in viruses, nematodes, vertebrates and yeasts., 1998, 23(5): 159-162.
[33] Swingle M R, Honkanen R E, Ciszak E M. Structural basis for the catalytic activity of human serine/threonine protein phosphatase-5., 2004, 279(32): 33992-33999.
[34] Yang J, Roe S M, Cliff M J, Williams M A, Ladbury J E, Cohen P T, Barford D. Molecular basis for TPR domain- mediated regulation of protein phosphatase 5., 2005, 24(1): 1-10.
[35] Morita K, Saitoh M, Tobiume K, Matsuura H, Enomoto S, Nishitoh H, Ichijo H. Negative feedback regulation of ASK1 by protein phosphatase 5 (PP5) in response to oxidative stress., 2001, 20(21): 6028-6036.
[36] Wechsler T, Chen B P, Harper R, Morotomi-Yano K, Huang B C, Meek K, Cleaver J E, Chen D J, Wabl M. DNA-PKcs function regulated specifically by protein phosphatase 5., 2004, 101(5): 1247-1252.
[37] Yuan M, Huang Z, Wei D, Hu Z, Yang K, Pang Y. Identification ofnucleopolyhedrovirusas a core gene and its requirement for intranuclear microvesicle formation and nuclear egress of nucleocapsids., 2011, 85(22): 11664-11674.
[38] Ono C, Kamagata T, Taka H, Sahara K, Asano S, Bando H. Phenotypic grouping of 141 BmNPVs lacking viral gene sequences., 2012, 165(2): 197-206.
Screening and identification of proteins interacting withIAP and their effects on BmNPV proliferation
CHEN Peng1,2, BAO XiYan1, Kang TaoTao1, DONG ZhanQi1, ZHU Yan1, PAN MinHui1,2, LU Cheng1,2
(1State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400715;2Key Laboratory of Sericultural Biology and Genetic Breeding, Ministry of Agriculture, Southwest University, Chongqing 400715)
【Objective】As an important part of insect immune response, apoptosis plays an important role in the interaction between virus and host. The study of apoptosis-related genes is of great value in elucidating their roles in the process of virus infection. The objective of this study is to screen the interaction proteins ofinhibitor of apoptosis proteins (BmIAP), verify the regulatory relationships between them andin the process ofnucleopolyhedrovirus (BmNPV) infection and their roles in the proliferation of BmNPV, and to provide a theoretical basis for exploring the molecular mechanismof the interaction between host and BmNPV.【Method】The proteins interacting with BmIAP in the process ofBmNPV infection incells were screened by immunoprecipitation, and the specific differential bands were analyzed by LC-MS/MS. The obtained proteins were identified according to the molecular weight of the protein and bioinformatics method. The candidate gene was obtained by molecular cloning technique, and the domain of the candidate gene was predicted by SMART online tools and the multiple sequence alignment analysis was performed with BioEdit. Co-localization of BmIAP and candidate protein was verified by immunofluorescence assay, and their interaction was further verified by immunoprecipitation. The candidate gene was overexpressed and knocked out by eukaryotic expression and CRISPR/Cas9 gene editing system, respectively. The expression of corresponding genes was detected by qRT-PCR to determine the regulatory relationship betweenandwas detected after overexpression and knockout ofto determine the effect ofon the proliferation of BmNPV.【Result】Seven host proteins and one BmNPV protein which may interact with BmIAP were obtained by immunoprecipitation and further analysis identified a candidate geneassociated with apoptosis. The open reading frame (ORD) ofis 1 473 bp, encoding 490 amino acids. The predicted molecular weight of Bmpp5 is about 56 kD. It contains three TRP domains and one PP2Ac domain. It is highly conserved among insects. Immunofluorescence assay showed that BmIAP and BmPP5 were co-localized in cytoplasm, and the results of immunoprecipitation showed that they could interact with each other. In the process of BmNPV infection, after overexpression of, the expression ofwas significantly up-regulated, while after knockout of, the expression ofwas significantly down-regulated, suggesting thatcould promote the expression of.was significantly up-regulated after overexpression of, whilewas significantly down-regulated after knockout of, suggesting thatcould also promote the expression of. Overexpression ofcould promote the proliferation of BmNPV, and knockdown ofcould inhibit the proliferation of BmNPV, indicating that the expression ofwas conducive to the proliferation of BmNPV. 【Conclusion】a protein BmPP5, which interacts with BmIAP was identified and highly conserved in insects. In the process of BmNPV infection,andcan promote each other. It is also proved thatcan promote the replication and proliferation of BmNPV.
; inhibitor of apoptosis protein (IAP); interaction protein; BmNPV; BmPP5
10.3864/j.issn.0578-1752.2019.03.016
2018-08-31;
2018-09-17
国家自然科学基金(31602009,31572466)、西南大学博士基金(SWU116066)、国家蚕桑产业技术体系(CARS-18)
陈鹏,E-mail:pjchen@swu.edu.cn。通信作者鲁成,E-mail:lucheng@swu.edu.cn
(责任编辑 岳梅)
