苯磺隆胁迫下油菜萌发期相关性状的全基因组关联分析
2019-02-20周清元王倩叶桑崔明圣雷维郜欢欢赵愉风徐新福唐章林李加纳崔翠
周清元,王倩,叶桑,崔明圣,雷维,郜欢欢,赵愉风,徐新福,唐章林,李加纳,崔翠
苯磺隆胁迫下油菜萌发期相关性状的全基因组关联分析
周清元,王倩,叶桑,崔明圣,雷维,郜欢欢,赵愉风,徐新福,唐章林,李加纳,崔翠
(西南大学农学与生物科技学院,重庆 400716)
【目的】研究苯磺隆残留对油菜种子萌发的影响,运用全基因组关联分析(genome-wide association analysis,GWAS)揭示苯磺隆胁迫下油菜萌发期相关性状的遗传因子和候选基因,探究油菜在苯磺隆逆境胁迫下的生理形态所反映的基因调控机制,为耐苯磺隆油菜品种的研究提供参考。【方法】以241份甘蓝型油菜品种(系)为材料、25 mg·L-1苯磺隆溶液为处理液、蒸馏水为对照进行发芽试验。发芽7 d测定并计算相对发芽率、相对根长和相对鲜重。结合芸薹属60K SNP芯片分析群体基因型,通过STRUCTURE软件和TASSEL软件分别对该群体进行群体结构分析以及亲缘关系和LD衰减分析。为有效排除假关联的影响,采用一般线性模型(GLM)和混合线性模型(MLM)中的6种模型进行比较,确定每个性状GWAS分析的最优模型。同时,利用TASSEL软件在最优模型下对241份材料的3个性状分别进行全基因组关联分析,根据关联SNP位点的LD区间序列预测候选基因。【结果】241份品种(系)群体可分为P1(94份材料)和P2(147份材料)2个亚群,其中约56.28%的材料之间的亲缘关系值为0。全基因组关联分析(K+PCA模型)共检测到16个与性状显著关联的SNP位点,这些位点可解释9.42%—13.14%的表型变异率。通过分析显著SNP位点的LD区间与甘蓝型油菜对应的区间序列,筛选出25个候选基因可能与油菜耐苯磺隆有关,其中9个为细胞色素P450家族基因,5个参与谷胱甘肽合成或代谢过程,2个为多药耐药相关蛋白基因。同时发现与相对发芽率显著相关的基因编码谷胱甘肽转移酶,参与毒素分解过程,在各种胁迫反应中起重要作用。在相对根长和相对鲜重共同鉴定到的候选基因功能未知。【结论】共检测到16个SNP位点与耐苯磺隆性状显著关联,筛选出25个候选基因可能与油菜耐苯磺隆有关。
油菜;萌发期;苯磺隆;全基因组关联分析
0 引言
【研究意义】苯磺隆作为一种磺酰脲类除草剂,可用于防除禾谷类和其他油料作物田中多种阔叶杂草[1-2]。虽然在推荐剂量下的使用较为安全[3],但仍存在短期土壤残留现象[4-5],容易导致对除草剂敏感的作物死亡[6]。近年来,随着油菜田阔叶杂草防除问题逐渐突出[7],采用阔叶除草剂和抗耐性油菜品种相配合是解决杂草问题最为经济有效的方式[8]。种子萌发期是作物生长的关键阶段,其发芽质量的好坏直接影响作物的出苗率、作物的生长发育以及经济效益[9]。研究表明,不同品种(系)油菜萌发期对苯磺隆的耐性具有显著性差异,利用苯磺隆对油菜种子的发芽性状进行分析,筛选出萌发期对苯磺隆耐性极强的品种(系)是可行的[10]。因此,针对油菜萌发期耐苯磺隆进行相关遗传因子研究和筛选耐性基因,对了解油菜苯磺隆响应的分子机理、培育耐苯磺隆油菜品种具有重要意义。【前人研究进展】全基因组关联分析(genome-wide association analysis,GWAS)是研究数量性状的重要方法之一,在多种作物逆境胁迫下相关性状遗传机制的研究中有广泛应用[11-12]。随着甘蓝型油菜全基因组序列的公布及芸薹属60K SNP芯片的开发[13],GWAS已成功地应用于油菜复杂性状的QTL检测[14-19]。Chen等[14]对419个甘蓝型油菜品种幼苗期进行GWAS分析,鉴定出32个与镉积累性状有关的候选基因。Wan等[15]在油菜种子苗期利用GWAS检测到与4个耐盐性状相关的75个显著SNP位点。Wei等[16]通过SNP性状关联和转录组测序分析,在347个油菜自交系的菌核病抗性中鉴定出24个基因。此外,研究者利用GWAS发现与油菜萌发活力[17]、含油量[18]、开花时间[19]等有关的显著位点并预测候选基因。陈东亮等[20]从基因组水平分析油菜的草铵膦抗性,发现18个与草铵膦的灭生机制相关的候选基因。Zhang等[21]为研究苯达松和磺酰脲敏感性突变体BEL的遗传性质,使用生物学技术构建了水稻BEL位点的精细图,并在限制区间内发现5个基因。针对苯磺隆,近年来也相继有报道。杨倩等[22]以对苯磺隆敏感和抗性的播娘蒿为试材,利用RNA-seq分析得到了35个与苯磺隆代谢相关的功能基因。同样以播娘蒿为材料,Yang等[23]利用全局差异基因表达谱技术共鉴定出26个苯磺隆耐性差异表达的基因,并通过qRT-PCR验证了其中8个基因。Gaines等[24]使用Illumina HiSeq进行RNA-seq发现4种基因(P450s、硝酸盐单加氧酶、GST和GT)在黑燕麦代谢除草剂抗性方面发挥关键作用。【本研究切入点】磺酰脲类除草剂苯磺隆一般用作苗床和芽后除草[25],在油菜播前或移栽前使用将在土壤中造成残留,这对油菜种子萌发存在着较大影响[10],尽管前人通过资源筛选[26]、人工诱变[27]、转基因育种[28]等方法筛选出耐苯磺隆油菜植株,但是关于油菜各生育时期,尤其是萌发期对苯磺隆耐性的遗传机制和分子机理的研究较少。【拟解决的关键问题】本研究在前期筛选的适宜浓度的苯磺隆处理下,对遗传来源不同的241份甘蓝型油菜种质进行发芽期耐苯磺隆特性鉴定,并借助覆盖油菜全基因组的5.2万个SNP标记分别对相对根长、相对鲜重、相对发芽率进行全基因组关联分析,以探究油菜在苯磺隆逆境胁迫下的生理形态所反应的基因调控机制,为耐苯磺隆油菜品种的研究提供参考。
1 材料与方法
1.1 试验处理与性状调查
241份甘蓝型油菜品种由西南大学油菜中心收集并提供[10],于室内进行培养皿纸上发芽试验。根据前期筛选的浓度,在铺有2层滤纸的培养皿中加入3 mL浓度为25 mg·kg-1的苯磺隆溶液,蒸馏水作为对照,每皿均匀放置20粒已清洗的饱满种子,3次重复。将培养皿置于温度25℃、相对湿度为85%的人工培养箱中培养,光照和黑暗时间为16 h/8 h。第7天统计种子发芽率,每皿随机选取生长一致的10株幼苗分别测定根长和鲜重。参考王倩等[10]方法,分别计算每个品系的相对鲜重、相对根长和相对发芽率,并进行GWAS分析。采用Excel 2016软件对表型数据进行初步整理,计算其平均数、标准差和变异系数。
1.2 全基因组关联分析
利用油菜基因组60 K Illumina Infinium SNP芯片对241份种质基因型进行分析[14],参照Xu等[19]方法筛选用于LD分析和关联分析的SNP标记。群体结构由Structure 2.3.4软件基于贝叶斯数学模型进行分析,并参照Wan等[15]确定最终亚群数目。亲缘关系(relative kinship)K矩阵由Tassel 5.0软件分析,其值为负时设为0[29]。利用软件Tassel5.0估算群体内连锁不平衡(linkage disequilibrium,LD)的衰减[18]。使用一般线性模型(general linear model,GLM)和混合线性模型(mixed linear model,MLM)中6种模型进行关联分析[19,30]。3个性状的最优模型根据Quantile- Quantile散点图(QQ plot)在6种模型下的结果进行分析比较获得,并在此基础上绘制曼哈顿图,显示关联分析检测到的与目标性状显著相关的标记位点[31]。同时,负对数(1/N)作为显著关联SNP阈值,其中N是关联分析中SNP的总数,本研究的阈值为4.5(-log10(1/32493))。
1.3 候选基因的预测
根据与性状显著关联的SNP的位置左右延伸其所在染色体上2=0.2时的衰减距离,为候选基因的LD区间。利用法国公布的甘蓝型油菜“Darmor-Bzh”的基因组注释信息及TAIR网站对LD区间内的候选基因进行功能注释和分析[30]。
2 结果
2.1 表型统计分析
3个相对性状均表现出广泛的表型变异,其中(表1)相对根长变异幅度为0.050—0.588,平均值为0.136,变异系数为48.95%;相对鲜重变异幅度为0.411—2.357,平均值为0.980,变异系数为20.60%;相对发芽率变异幅度为0.333—1.000,平均值为0.942,变异系数为10.28%。结果(图1)表明,3个性状均呈连续性分布,符合数量性状的特点,适合进行GWAS分析。
2.2 SNP标记分析
将挑选出多态性和质量较高的32 493个SNP标记均匀分配到19条染色体,其中C04染色体上SNP标记数目最多,为3 005个;而C09染色体上SNP标记数目最少,为1 006个(表2)。这些SNP标记涉及的碱基变化为A/T、T/C、A/G、A/C、T/G、T/A、C/G和G/C 8种类型,其中A/G和T/C类型最多,分别为11 691和10 864;而C/G和G/C类型最少,分别为109和114(图2)。

表1 苯磺隆胁迫下相关性状的表型统计
**表示在0.01水平差异显著 **stand for significant at the 0.01 probability levels

图1 3个相对性状频数分布图
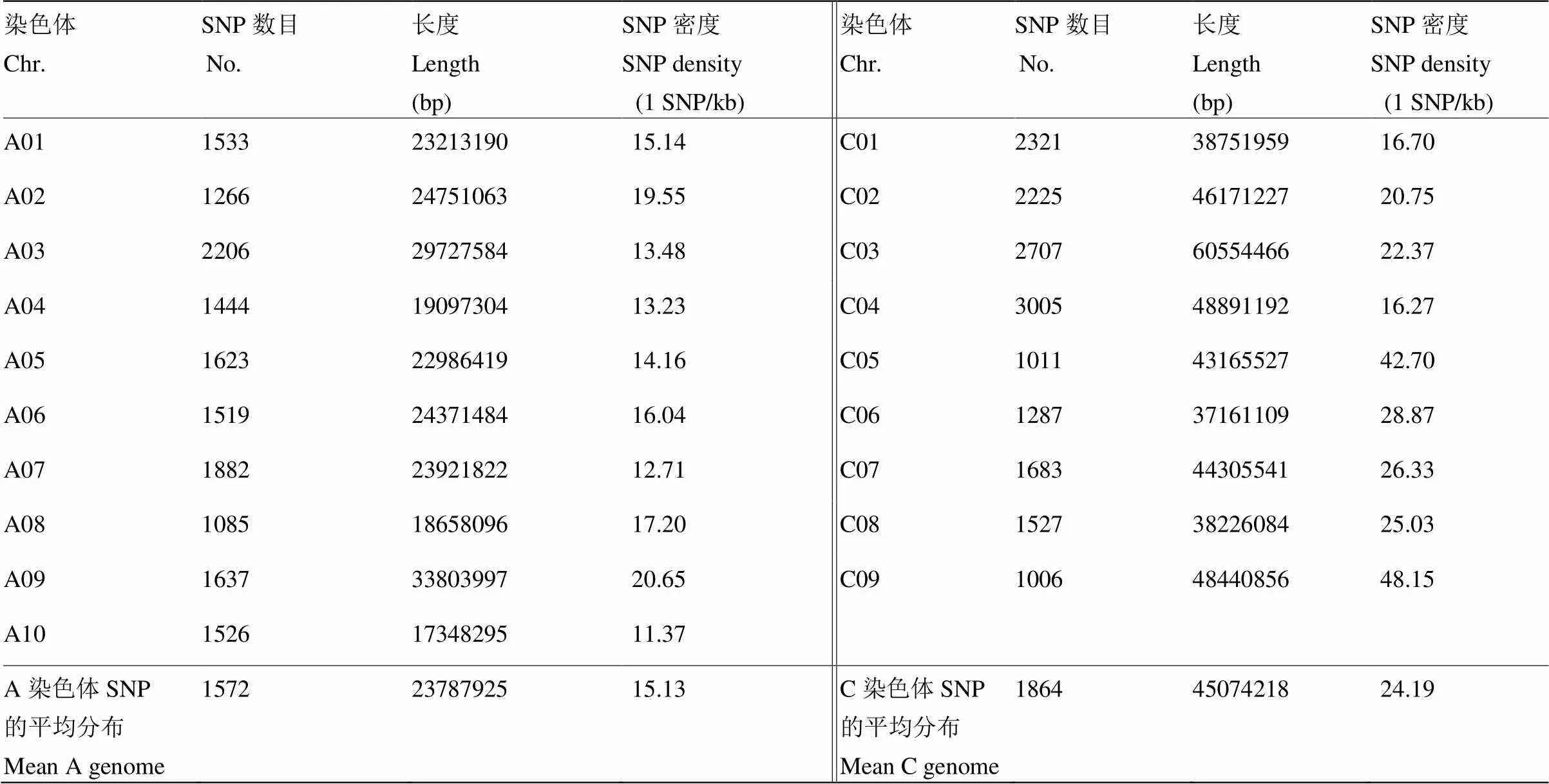
表2 SNP在染色体上的分布
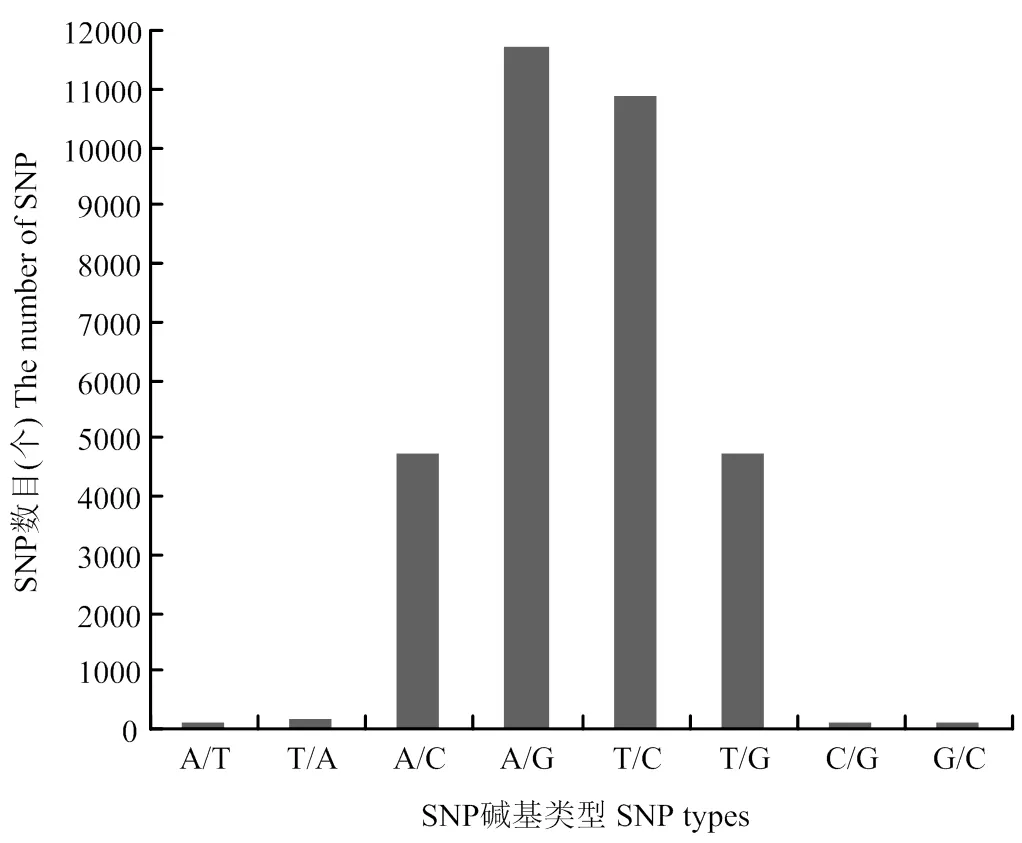
图2 32493个SNP碱基类型分布图
2.3 群体结构与亲缘关系分析
选择在染色体上均匀分布,且MAF大于0.3的10 655个SNP标记分析群体材料间亲缘关系和群体结构。利用软件Structure2.3.4对每个可能的K值模拟运算,当K=2时,显示△K有最大变化(图3-A),这241份甘蓝型油菜分为P1(94份材料)和P2(147份材料)2个亚群(图3-B)。利用Tassel5.1.0软件的Kinship模块分析任意2个材料之间的亲缘关系值(图3-C),显示约56.28%材料间的亲缘关系值为0,约12.77%材料的亲缘关系值在0—0.05,表明试验群体材料间的亲缘关系较远,符合进行GWAS分析的要求。
2.4 连锁不平衡在A、C基因组中的衰减
利用Tassel 5.1.0软件分析已筛选的32 493个高密度SNP标记来估算LD在甘蓝型油菜A、C基因组中的衰减。从LD衰减散点图(图4)中可以看出A、C基因组的衰减距离各有不同,但2均随着遗传距离的增加而衰减。以决定系数(coefficient of determination)2=0.2作为阈值(表3),A基因组的平均衰减距离为170 kb,其中A08染色体的衰减速度最慢,衰减距离也是最大,约为550 kb;A02和A03衰减速度最快,衰减距离约为130 kb。C基因组的平均衰减距离为650 kb,其中C02的衰减距离约1 150 kb,明显高于其他LD值,说明C02可能包含较多受人工进化选择影响性状的基因[32];染色体C05的衰减距离最小约为270 kb。从中可看出甘蓝型油菜A基因组衰退距离小于C基因组,说明A基因组可能发生了更多的重组,其遗传变异更加丰富。

A:群体的∆k值;B:群体结构示意图;C:亲缘关系分布

表3 连锁不平衡在A、C基因组中的衰减距离

A:A基因组的LD衰减距离;B:C基因组的LD衰减距离 A: LD decline A genome; B: LD decline C genome
2.5 苯磺隆胁迫下油菜萌发期相关性状的6种模型比较
采用基于一般线性模块的GLM、Q和PCA模型和混合线性模块的K、Q+K和PCA+K共6种模型来进行关联分析[19]。通过比较6种模型下Q-Q图的分布发现(图5),在3个性状中,与GLM模型相比,MLM模型下的K、K+Q和K+PCA模型均能较好地控制假阳性,但K+PCA模型检测到值更接近期望值,因此选用K+PCA作为3个相对性状的最优模型来寻找关联位点。
2.6 全基因组关联分析
全基因组关联分析表明(表4),与相对根长显著关联的SNP标记共检测到6个,分布于染色体A03、A05、C02、C03和C06上,可解释10.35%—12.22%的表型变异(图6-A)。与相对鲜重显著关联的SNP标记共检测到6个,分别位于A01、C02、C03和C04染色体上,这些位点可解释9.42%—11.66%的表型变异率(图6-B)。与相对发芽率显著关联的SNP标记共检测到4个,分别位于A04、A07、C02和C09染色体上,这些位点可解释10.95%—13.14%的表型变异率(图6-C)。
2.7 候选基因预测
通过对甘蓝型油菜3个相对性状的全基因组关联分析,利用已公布的甘蓝型油菜基因组测序结果,将与各性状显著关联的SNP标记定位到油菜的基因组上,基于甘蓝型油菜参考基因组序列,对LD区间的候选基因进行分析,筛选出了25个与苯磺隆耐性相关性状有关的候选基因(表5)。

A:相对根长;B:相对鲜重;C:相对发芽率

A:相对根长;B:相对鲜重;C:相对发芽率
对相对根长的全基因组关联分析,找到了8个与耐性机制有关的候选基因。在C02染色体上的基因、和分别与拟南芥基因、和同源,均为细胞色素P450基因家族成员。A03染色体上的基因和C06染色体上的基因分别与拟南芥基因和同源,前者是松柏醇葡糖基转移酶,后者是谷胱甘肽S-转移酶家族蛋白成员,均参与对有毒物质的反应。A05染色体上的基因与拟南芥基因同源,是一种bHLH转录因子。位于C02染色体上的基因的拟南芥同源基因,是糖基转移酶家族蛋白成员。在C02染色体上的基因和分别与拟南芥基因和同源,均参与植物生长发育中非生物胁迫的调控。
扫描与相对鲜重显著关联SNP标记的LD区域,找到了9个与抗性机制有关的候选基因。在A01染色体上的基因与拟南芥基因同源,为木瓜蛋白酶家族半胱氨酸蛋白酶。C02染色体上的基因和拟南芥基因同源,的拟南芥同源基因响应于毒性物质。位于C03染色体上的基因和拟南芥基因同源,参与防御反应的负调控。C04染色体上的基因、和C03染色体上的基因分别与拟南芥基因、和同源,均为细胞色素P450家族成员。C03染色体上的基因和的拟南芥同源基因和分别参与编码谷胱甘肽转移酶和谷胱甘肽生物合成。

表4 苯磺隆胁迫下相关性状的显著关联标记
在与相对发芽率关联的SNP位点的LD区域找到了8个与苯磺隆耐性机制有关的候选基因。在A07染色体上找到的基因和分别与拟南芥中的基因和同源,属于ABC转运蛋白的多药抗性相关蛋白(MRP和ABCC)亚家族的基因。C09染色体上的基因、和C02染色体上的基因分别与拟南芥基因、和同源,均为细胞色素P450基因家族。C02染色体上的基因在拟南芥中的同源基因与UDP-葡糖基转移酶有关。C02染色体上的基因和C09染色体上的基因分别与拟南芥基因和同源,参与谷胱甘肽代谢过程。
3 讨论
3.1 苯磺隆胁迫下的萌发期鉴定
苯磺隆是中国麦田广泛使用的阔叶除草剂之一,属乙酰乳酸合成酶(acetolactate synthase,ALS)抑制剂类除草剂家族,具有杀草谱广、活性高、选择性强,对哺乳动物毒性低等优点[1],是世界上使用最多的一类除草剂[2]。油菜对苯磺隆较敏感,生产上油菜田直接利用苯磺隆化学除草较少,但是在耐广谱除草剂草甘膦杂草日益增多[51]且胺苯磺隆等使用残留药害重的情况下[7],苯磺隆与单子叶除草剂混合使用可以用于油菜播前苗床地或者大田移栽前除草[8]。因苯磺隆主要作用在杂草的茎叶,对未萌发的杂草影响较小,因此多数研究集中在作物苗期或者成株期[25,51],很少关注苯磺隆残留对后茬作物种子萌发的影响,尤其是对其敏感的阔叶型作物种子萌发的影响。王正贵[4]和杜慧平等[5]研究表明,苯磺隆在麦田土壤中的降解半衰期为10 d左右。Dowsett等[52]研究表明在低pH土壤中喷施苯磺隆28 d后种植饲料甜菜生长活力最好,在高pH土壤中即使试验期长达56 d甜菜生长也较差。苯磺隆一方面可以作为油菜田潜在的阔叶型除草剂[8,26]并在播种或者移栽前进行除草[28],另一方面也是油菜化学杀雄剂主要的组成成分[53],筛选对苯磺隆耐性极好的种质在生产和杂种配制等方面具有非常重要的意义。针对这种情况,根据苯磺隆田间用量及其在土壤中的衰减,设计浓度梯度进行胁迫浓度筛选,最后筛选了25 mg·kg-1(相当于田间除草剂使用浓度的1/10)作为种子萌发期的胁迫浓度,并以该浓度处理241份油菜种子,筛选出3个苯磺隆耐性较强种质,并认为综合分析相对根长、相对鲜重、相对发芽率可评价油菜种质资源萌发期耐性[10]。因此本文根据这三个指标性状进行苯磺隆残留胁迫下油菜萌发期GWAS候选基因挖掘。虽然有研究[54-55]表明植物在非生物胁迫下幼苗期耐受性优于萌发期,但是由于基因表达的时空特点,这些萌发期苯磺隆耐性较好的种质是否在苗期或者成株期具有相同的表现,还有待于验证。

表5 苯磺隆耐性相关性状的候选基因
3.2 关联分析与候选基因
不同的分析模型影响关联分析的结果[11-14,30]。为确保关联结果的准确性,最大程度降低假阳性结果,GWAS前要对每个性状进行最优模型的选择。Xu等[19]在油菜开花的全基因组关联分析中发现,K+PCA模型能更好地降低假阳性的发生。本研究对每个性状进行了6种模型的分析,发现包括K模型,PCA+K模型和Q+K模型在内的MLM模型可显著降低值,而K+PCA模型能更好地控制3个性状的假阳性。
植物耐受苯磺隆除草剂主要与ALS基因突变和非靶标酶代谢解毒能力有关,其中最常见的酶分别是谷胱甘肽转移酶GSTs和UDP依赖性糖基转移酶(UGTs);最常见的代谢反应包括P450s的氧化和羧化酯酶的水解,以及通过多药耐药相关蛋白(MRP)家族的载体的代谢反应[51,56]。本研究所筛选到的25个候选基因大多与细胞色素P450酶系及谷胱甘肽转移酶活性有关。虽然本研究没有定位到ALS突变位点,但是不能简单地认为241份材料没有ALS突变基因,由于GWAS分析结果与基因表达引起的性状效应值大小有关,ALS基因如果在萌发期的相对鲜重、相对根长、相对发芽率3个指标性状中表达引起的表型值较小,那么在GWAS分析中就无法检测。有研究表明播娘蒿抗性水平大小与ALS基因表达量多少无关[51]。Délye等[57]通过比较除草剂敏感性生物测定与基因分型,其结果显示具有抗性的植物中约75%的植物是通过增加除草剂代谢而具有抗耐性,揭示了非靶位点抗性的重要性。本研究发现在A07染色体上2个标记相距很近的和为多药耐药相关蛋白(MRP)家族,其作为ATP依赖的输出泵可对谷胱甘肽结合物和葡萄糖醛酸化起作用[58]。前人研究表明大豆的[59]、菊芋的[60]、小麦的[61]以及烟草的和[62]均为可降解除草剂的植物P450酶系,证明了植物细胞色素P450酶系参与了对许多除草剂的代谢和解毒作用。本研究在C02、C03、C04、C09染色体上筛选的9个基因均为细胞色素P450基因家族成员,其中的拟南芥同源基因仅在根组织中显著表达。Cummins等[63]研究发现使用除草剂安全剂处理可增强小麦中涉及农药解毒的葡糖基转移酶和O-甲基转移酶的表达活性,降低了作物对除草剂的敏感性。Riechers等[64]通过提高GST酶的活性来刺激除草剂在植物中的代谢反应,表明GST蛋白在各种解毒过程中有重要作用。Cummins等[65]研究发现通过转基因表达的拟南芥对一些除草剂具有一定的耐受性,其抗耐性的产生是由于谷胱甘肽、花青素和类黄酮的积累增加而产生。研究证明P450s和GSTs可由多种非生物刺激诱导,对于保护植物免受氧化损伤很重要[41,66]。本文筛选到C02染色体上的基因、C03染色体上的基因和C09染色体上的基因为谷胱甘肽S-转移酶家族蛋白,编码谷氨酸半胱氨酸连接酶,均参与谷胱甘肽的生物合成代谢过程并响应多种逆境胁迫。有研究表明的拟南芥同源基因在拟南芥的耐盐耐旱等胁迫中起着重要作用[47],同时也有研究[67]表明该同源基因的表达被除草剂安全剂上调。此外,本研究在与3个性状相关联的SNP的LD区域找到5个拟南芥功能未知的的基因,其中在相对根长和相对鲜重中定位到C02染色体上相同基因位点,这些基因具有重要的挖掘价值,将成为下一步研究的重要内容。
4 结论
扫描得到与相对根长显著相关的SNP位点共6个,与相对鲜重相关的SNP位点共6个,与相对发芽率相关的SNP位点共监测到4个,覆盖了A、C基因组。共找到25个与苯磺隆耐性相关的候选基因,这些候选基因可能通过P450酶或者谷胱甘肽转移酶活性的调控导致油菜对苯磺隆耐药性的差异。
[1] And B J M, Falco S C. The development of herbicide resistant crops., 2003, 40(1): 441-470.
[2] Tranel P J, Wright T R. Resistance of weeds to ALS-inhibiting herbicides: what have we learned?, 2002, 50(6): 700-712.
[3] Dixon F L, Clay D V. Effect of herbicides applied pre- and post-emergence on forestry weeds grown from seed., 2004, 23(8): 713-721.
[4] 王正贵. 除草剂对小麦产量和品质的影响及其残留特性[D]. 扬州: 扬州大学, 2011.
WANG Z G. Effects of herbicides on grain yield and quality in wheat and relevant residual behavior[D]. Yangzhou: Yangzhou University, 2011. (in Chinese)
[5] 杜慧平, 杜慧玲. 苯磺隆在土壤中的消解动态和残留测定. 山西农业科学, 2015(1): 50-53.
DU H P, DU H L. Tribenuron-methly degradation dynamics and residual in soil., 2015(1): 50-53. (in Chinese)
[6] 单正军, 陈祖义. 除草剂对非靶植物(农作物)的危害影响及控制技术. 农药科学与管理, 2007(9): 50-54.
SHAN Z J, CHEN Z Y. Harm and control technology of herbicides to non target plants (crops)., 2007(9): 50-54. (in Chinese)
[7] 唐建明, 王勇, 方雅琴. 油菜田常用除草剂药害及规避措施. 杂草学报, 2010(1): 64-66.
TANG J M, WANG Y, FANG Y Q. Herbicide phytotoxicity and evasion measures in rape fields., 2010(1): 64-66. (in Chinese)
[8] 孙妍妍, 曲高平, 黄谦心, 吕金洋, 郭媛, 胡胜武. 甘蓝型油菜抗苯磺隆突变体ALS基因分析与SNP标记. 中国油料作物学报, 2015, 37(5): 589-595.
SUN Y Y, QU G P, HUANG Q X, LV J Y, GUO Y, HU S W. SNP markers for acetolactate synthase genes from tribenuron -methyl resistant mutants inL.., 2015, 37(5): 589-595. (in Chinese)
[9] 李忠爱, 陈欣, 王子成. 氯化镍对拟南芥生长发育和生理生化指标的影响. 农业科技与信息, 2014(24): 44-48.
LI Z A, CHEN X, WANG Z C. The effects of nickel chloride (NiCl2) on growth, development and physiology in., 2014(24):44-48. (in Chinese)
[10] 王倩, 崔翠, 叶桑, 崔明圣, 赵愉风, 林呐, 唐章林, 李加纳, 周清元. 甘蓝型油菜种子萌发期耐苯磺隆种质筛选与综合评价. 作物学报, 2018, 44(8): 1169-1184.
WANG Q, CUI C, YE S, CUI M S, ZHAO Y F, LIN N, TANG Z L, LI J N, ZHOU Q Y. Screening and comprehensive evaluation of germplasm resources with tribenuron-methyl tolerance at germination stage in rapeseed (L.)., 2018, 44(8): 1169-1184. (in Chinese)
[11] Hu G H, Li Z, Lu Y C, Li C X, Gong S C, Yan S Q, Li G L, Wang M Q, Ren H L, Guan H T, Zhang Z W, Qin D L, Chai M Z, Yu J P, Li Y, Yang D G, Wang T Y, Zhang Z W. Genome-wide association study identified multiple genetic loci on chilling resistance during germination in maize., 2017, 7(1): 10840.
[12] Li D H, Dossa Komivi, Zhang Y X, Wei X, Wang L X, Zhang Y J, Liu A L, Zhou R, Zhang X R. GWAS uncovers differential genetic bases for drought and salt tolerances in sesame at the germination stage., 2018, 9(2): 87.
[13] Snowdon R J, Iniguez Luy F L. Potential to improve oilseed rape and canola breeding in the genomics era., 2012, 131(3): 351-360.
[14] Chen L L, Wan H P, Qian J L, Guo J B, Sun C M, Wen J, Yi B, Ma C Z, Tu J X, Song L Q, Fu T D, Shen J X. Genome-wide association study of cadmium accumulation at the seedling stage in rapeseed (L.)., 2018, 9: 375-390.
[15] Wan H P, Chen L L, Guo J B, Li Q, Wen J, Yi B, Ma C z, Tu J X, Fu T D, Shen J X. Genome-wide association study reveals the genetic architecture underlying salt tolerance- related traits in rapeseed (L.)., 2017, 8: 593-608.
[16] Wei L J, Jian H J, Lu K, Filardo F, Yin N W, Liu L Z, Qu C M, Li W, Du H, Li J N. Genome-wide association analysis and differential expression analysis of resistance to Sclerotinia stem rot in., 2016, 14(6): 1368.
[17] Hatzig S V, Frisch M, Breuer F, Nesi N, Ducournau S, Wagner M H, Leckband G, Abbadi A, Snowdon R J. Genome-wide association mapping unravels the genetic control of seed germination and vigor in., 2015, 6(221): 221.
[18] Liu S, Fan C, Li J, CAI G, YANG Q, WU J, YI X, ZHANG C, ZHOU Y. A genome-wide association study reveals novel elite allelic variations in seed oil content of., 2016, 129(6): 1203-1215.
[19] Xu L, Hu K, Zhang Z, GUAN C, CHEN S, HUA W, LI J, WEN J, YI B, SHEN J, MA C, TU J, FU T. Genome-wide association study reveals the genetic architecture of flowering time in rapeseedL.)., 2016, 23(1): 43.
[20] 陈东亮, 崔翠, 任义英, 王倩, 李加纳, 唐章林, 周清元. 草铵膦胁迫下油菜苗期叶片药害相关性状的全基因组关联分析. 作物学报,2018, 44(4): 542-553.
CHEN D L, CUI C, REN Y Y, WANG Q, LI J N, TANG Z L, ZHOU Q Y. Genome-wide association analysis of some phytotoxicity related traits at seedling stage in rapeseed., 2018, 44(4): 542-553. (in Chinese)
[21] Zhang L, Lu Q, Chen H G, PAN G, XIAO S S, DAI Y T, LI Q, ZHANG J W, WU X Z, WU J S, TU H M, LIU K D. Identification of a cytochrome P450 hydroxylase, CYP81A6, as the candidate for the bentazon and sulfonylurea herbicide resistance gene, Bel, in rice., 2007, 19(1): 59-68.
[22] 杨倩, 邓维, 梅宇, 司冲, 焦洪涛, 郑明奇. RNA-seq分析抗苯磺隆播娘蒿代谢相关基因//第十二届全国杂草科学大会论文摘要集. 太原: 中囯植物保护学会杂草学分会, 2015.
YANG Q, DENG W, MEI Y, SI C, JIAO H T, ZHENG M Q. RNA-seq analysis of genes related to metabolism of tribenuron-methyl inWilld//. Taiyuan: Weed Science Society of China CSPP, 2015. (in Chinese)
[23] Yang Q, Deng W, Li X, YU Q, BAI L, ZHENG M. Target-site and non-target-site based resistance to the herbicide tribenuron-methyl in flixweed (L.)., 2016, 17(1): 551.
[24] Gaines T A, Figge A, Herrmann J, MAIWALD F, OTT M C, HAN H, BUSI R, YU Q, POWLES S B, BEFFA R. RNA-Seq transcriptome analysis to identify genes involved in metabolism-based diclofop resistance in., 2014, 78(5): 865-876.
[25] Dong B, Qian W, Hu J. Dissipation kinetics and residues of florasulam and tribenuron-methyl in wheat ecosystem., 2015, 120: 486-491.
[26] 信晓阳, 曲高平, 张荣, 庞红喜, 吴强, 王发禄, 胡胜武. 不同品种油菜对苯磺隆耐药性差异的鉴定. 西北农业学报, 2014, 23(7): 68-74.
XIN X Y, QU G P, ZHANG R, PANG H X, WU Q, WANG F L, HU S W. Identification of the tribenuron-methyl tolerance in different rapeseed genotypes., 2014, 23(7): 68-74. (in Chinese)
[27] 曲高平, 孙妍妍, 庞红喜, 吴强, 王发禄, 胡胜武. 甘蓝型油菜EMS突变体库构建及抗除草剂突变体筛选. 中国油料作物学报, 2014, 36(1): 25-31.
QU G P, SUN Y Y, PANG H X, WU Q, WANG F L, HU S W. Ems mutagenesis and als-inhibitor herbicide-resistant mutants ofL.., 2014, 36(1): 25-31. (in Chinese)
[28] 汪亚琴. 水稻抗除草剂基因转化油菜的研究[D]. 武汉: 华中农业大学, 2013.
WANG Y Q. The expression of rice herbicide resistance gene[D]. Wuhan: Huazhong Agricultural University, 2013.(in Chinese)
[29] Yu J, Pressoir G, Briggs W H, VROH B I, YAMASAKI M, DOEVLEY J F, MCMULLEN M D, GAUT B S, NIELSEN D M, HOLLAND J B, KRESOVICH S, BUCKLER E S. A unified mixed-model method for association mapping that accounts for multiple levels of relatedness., 2006, 38(2): 203-208.
[30] 任义英, 崔翠, 王倩, 唐章林, 徐新福, 林呐, 殷家明, 李加纳, 周清元. 油菜主花序角果密度及其相关性状的全基因组关联分析. 中国农业科学, 2018, 51(6): 1020-1033.
REN Y Y, CUI C, WANG Q, TANG Z L, XU X F, LIN N, YIN J M, LI J N, ZHOU Q Y.Genome-wide association analysis of silique density on Racemes and its component traits inL., 2018, 51(6): 1020-1033. (in Chinese)
[31] 贺亚军, 吴道明, 游婧璨, 钱伟. 油菜耐盐相关性状的全基因组关联分析及其候选基因预测. 中国农业科学,2017, 50(7): 1189-1201.
HE Y J, WU D M, YOU J C, QIAN W. Genome-wide association analysis of salt tolerance related traits inand candidate gene prediction., 2017, 50(7): 1189-1201. (in Chinese)
[32] 王荣焕, 王天宇, 黎裕. 植物基因组中的连锁不平衡. 遗传, 2007, 29(11): 1317-1323.
WANG R H, WANG T Y, LI Y. Linkage disequilibrium in plant genomes., 2007, 29(11): 1317-1323. (in Chinese)
[33] HOU B, LIM E K, HIGGINS G S, BOWLES D J. N-glucosylation of cytokinins by glycosyltransferases of., 2004, 279(46): 47822-47832.
[34] SUKWEENADHI J, KIM Y J, CHOI E S, KOH S C, LEE S W, KIM Y J, YANG D C.DCY84(T) induces changes ingene expression against aluminum drought and Tribenuron stress., 2015, 172: 7-15.
[35] SHIKHA M, MALLANA G M, ATMAKURI R R, PRASHANT A J, PRASANTA K D, NEPOLEAN T. Comparative analysis offamily in maize,, rice, and sorghum revealed potential targets for drought tolerance improvement., 2017, 5: 115-132.
[36] TAKEI K, YAMAYA T, SAKAKIBARA H.andencode cytokinin hydroxylases that catalyze the biosynthesis of trans-Zeatin.2004, 279(40): 41866-41872.
[37] KOSALA R, LUKAS S. Water and solute permeabilities ofroots in relation to the amount and composition of aliphatic suberin., 2011, 62(6): 1961-1974.
[38] BRAZIER-HICKS M, GERSHATER M, DIXON D, EDWARDS R. Substrate specificity and safener inducibility of the plant UDP- glucose-dependent family 1 glycosyltransferase super-family., 2017, 16(1): 337-348.
[39] GOU M Y, SU N, ZHENG J, HUAI J L, WU G H, ZHAO J F, HE J G, TANG D Z, YANG S H, WANG G Y. An F-box gene,, functions as a negative regulator of the defense response in., 2009, 60(5): 757-770.
[40] EKMAN D R, WOLFE N L, DEAN J F. Gene expression changes inseedling roots exposed to the munition hexahydro-1,3,5-trinitro-1,3,5-triazine., 2005, 39(16): 6313-6320.
[41] PLANER-FRIEDRICH B, KÜHNLENZ T, HALDER D, LOHMAYER R, WILSON N, RAFFERTY C, CLEMENS S. Thioarsenate toxicity and tolerance in the model system., 2017, 51(12): 7187-7196.
[42] RENAULT H, AMRANI A E, BERGER A, MOUILLE G, SOUBIGOU- TACONNAT L, BOUCHEREAU A, DELEU C. γ-Aminobutyric acid transaminase deficiency impairs central carbon metabolism and leads to cell wall defects during Tribenuron stress in, roots., 2013, 36(5): 1009-1018.
[43] MUELLER S, HILBERT B, DUECKERSHOFF K, ROITSCH T, KRISCHKE M, MUELLER M J, BERGER S. General detoxification and stress responses are mediated by oxidized lipids through TGA transcription factors in., 2008, 20(3): 768-785.
[44] KOLUKISAOGLU Ü, BOVET L, KLEIN M, EGGMANN T, GEISLER M, WANKE D, MARTINOIA E, SCHULZ B. Family business: the multidrug-resistance related protein (MRP) ABC transporter genes in., 2002, 216(1): 107-119.
[45] WUEST S E, VIJVERBERG K, SCHMIDT A, WEISS M, GHEYSELINCK J, LOHR M, WELLMER F, RAHNENFÜHRER J, VON MERING C, GROSSNIKLAUS U.female gametophyte gene expression map reveals similarities between plant and animal gametes., 2010, 20(6): 506-512.
[46] LOEFFLER C, BERGER S, GUY A, DURAND T, BRINGMANN G, DREYER M, VON RAD U, DURNER J, MUELLER M J. B1-phytoprostanes trigger plant defense and detoxification responses., 2005, 137(1): 328-340.
[47] Xu J, Tian Y S, Xing X J, Peng R H, Zhu B, Gao J J, Yao Q H. Over-expression ofprovides tolerance to Tribenuron, drought and methyl viologen stresses in., 2015, 156(2): 164-175.
[48] RYBEL B D, ADIBI M, BREDA A S, WENDRICH J R, SMIT M E, NOVÁK O, YAMAGUCHI N, YOSHIDA S, VAN ISTERDAEL G, PALOVAARA J, NIJSSE B, BOEKSCHOTEN M V, HOOIVELD G, BEECKMAN T, WAGNER D, LJUNG K, FLECK C, WEIJERS D. Integration of growth and patterning during vascular tissue formation in., 2014, 345(6197): 1255215.
[49] CHRIST B, SÜSSENBACHER I, MOSER S, BICHSEL N, EGERT A, MÜLLER T, KRÄUTLER B, HÖRTENSTEINER S. Cytochrome P450is involved in the formation of major chlorophyll catabolites during leaf senescence in., 2013, 25(5): 1868-1880.
[50] FUJITA M, FUJITA Y, MARUYAMA K, SEKI M, HIRATSU K, OHME-TAKAGI M, TRAN L S, YAMAGUCHI-SHINOZAKI K, SHINOZAKI K. A dehydration-induced NAC protein, RD26, is involved in a novel ABA-dependent stress-signaling pathway., 2004, 39(6): 863-876.
[51] 许贤. 播娘蒿对苯磺隆抗性水平差异机理研究[D]. 北京: 中国农业大学, 2015.
XU X. The mechanism of tribenuron-resistant level difference of flixweeds[D]. Beijing: China Agricultural University, 2015. (in Chinese)
[52] Dowsett C, James T K, Rahman A. Plant-back safety of fodder beet () following the application of tribenuron- methyl. 2011, 64: 288.
[53] 张宝娟, 赵惠贤, 胡胜武. 苯磺隆对甘蓝型油菜中双9号的杀雄效果. 中国油料作物学报, 2010, 32(4): 467-471.
ZHANG B J, ZHAO H X, HU S W. Male sterile-inducing ability of tribenuron-methyl to rapeseed cultivar Zhongshuang 9., 2010, 32(4): 467-471. (in Chinese)
[54] 侯倩. 重铬酸盐对两种作物的毒性效应研究[D]. 太原: 山西大学, 2012.
HOU Q. Study on toxic effects of dichromate on two crop species[D]. Taiyuan: Shanxi University, 2012. (in Chinese)
[55] 胡华冉, 刘浩, 邓纲, 杜光辉, 徐云, 刘飞虎. 不同盐碱胁迫对大麻种子萌发和幼苗生长的影响. 植物资源与环境学报, 2015, 24(4): 61-68.
HU H R, LIU H, DENG G, DU G H, XU Y, LIU F H. Effects of different salt-alkaline stresses on seed germination and seedling growth of Cannabis., 2015, 24(4): 61-68. (in Chinese)
[56] Yu Q, Powles S. Metabolism-based herbicide resistance and cross-resistance in crop weeds: a threat to herbicide sustainability and global crop production., 2014, 166(3): 1106.
[57] Délye C, Menchari Y, Guillemin J P, MATÉJICEK A, MICHEL S, CAMILLERI C, CHAUVEL B. Status of black grass () resistance to acetyl-coenzyme A carboxylase inhibitors in France., 2010, 47(2): 95-105.
[58] PLANER-FRIEDRICH B, KÜ T H, HALDER D, LOHMAYER R, WILSON N, RAFFERTY C, CLEMENS S. Thioarsenate toxicity and tolerance in the model system., 2017, 51(12): 7187-7196.
[59] Siminszky B, Corbin F T, Ward E R, FLEISCHMANN T J, DEWEY R E. Expression of a soybean cytochrome P450 monooxygenase cDNA in Yeast and tobacco enhances the metabolism of phenylurea herbicides., 1999, 96(4): 1750.
[60] DIDIERJEAN L, GONDET L, PERKINS R, LAU S M, SCHALLER H, O'Keefe D P, Werck-Reichhart D. Engineering herbicide metabolism in tobacco andwith CYP76B1, a cytochrome P450 enzyme from jerusalem artichoke., 2002, 130(1): 179-189.
[61] Xiang W S, Wang X J, Ren T R, JU X L. Expression of a wheat cytochrome P450 monooxygenase in yeast and its inhibition by glyphosate., 2005, 4(61): 402-406.
[62] Yamada T, Kambara Y, Imaishi H, OHKAWA H. Molecular cloning of novel cytochrome P450 species induced by chemical treatments in cultured tobacco cells., 2000, 68(1): 11-25.
[63] Cummins I, Brazierhicks M, Stobiecki M, Franski R, Edwards R. Selective disruption of wheat secondary metabolism by herbicide safeners., 2006, 67(16): 1722-1730.
[64] Riechers D E, Vaughn K C, Molin W T. The role of plant glutathione s-transferases in herbicide metabolism//, 2005, 216-232.
[65] Cummins I, Wortley D J, Sabbadin F, HE Z, Coxon C R, Straker H E, Sellars J D, Knight K, Edwards L, Hughes D, Kaundun S S, Hutchings S J, Steel P G, Edwards R. Key role for a glutathione transferase in multiple- herbicide resistance in grass weeds., 2013, 110(15): 5812-5817.
[66] Sappl P G, Carroll A J, Clifton R, Lister R, Whelan J, Harvey Millar A, Singh K B. Theglutathione transferase gene family displays complex stress regulation and co-silencing multiple genes results in altered metabolic sensitivity to oxidative stress., 2009, 58(1): 53-68.
[67] Wagner U, Edwards R, Dixon D P, MAUCH F. Probing the diversity of theglutathione S-transferase gene family., 2002, 49(5): 515-532.
Genome-Wide Association Analysis of Tribenuron-methyl Tolerance Related Traits inL. under Germination
ZHOU QingYuan, WANG Qian, YE Sang, CUI MinSheng, LEI Wei, GAO HuanHuan, ZHAO YuFeng, XU XinFu, TANG ZhangLin, LI JiaNa, CUI Cui
(College of Agronomy and Biotechnology, Southwest University, Chongqing 400716)
【Objective】To investigate the effect of residual tribenuron-methyl in soil on seed germination, genome-wide association analysis (GWAS) of 52157 SNPs with genome-wide coverage was used to identify the candidate genes for the germinating traits of rapeseed under tribenuron-methyl stress. The results of this study may provide a theoretical basis for tribenuron-methyl tolerance in oilseed rape.【Method】In the germination experiment, 241 rape varieties (lines) were treated with tribenuron-methyl solution of 25 mg·L-1, and distilled waterwas added to the control. At the 7th day of germination, the phenotypic data including relative germination rate, relative root length and relative fresh weight were measured and calculated. Using the TASSEL software, tribenuron-methyl tolerance related traits were explored inunder germination with a 60K Brassica Illumina®Infinium SNP array. Then, the structure of the population was analyzed by the software STRUCTURE, and the genetic relationship and LD attenuation were analyzed by the software TASSEL, respectively. In order to determine the optimal model for GWAS analysis of each trait, 6 models involved the general linear model and mixed linear model were used to analyze and compare the effects of group structure and relationship. The software TASSEL was employed to analyze the relative values of the 3 traits under the optimal model. Meanwhile, the candidate genes were predicted based on the LD interval sequence of the associated SNP locus. 【Result】The population structure analysis showed the population could be divided into two subgroups, P1 with 94 materials and P2 with 147 materials. Meanwhile, the result of genetic relationship analysis showed that about 56.28% of the materials had no kinship relationship. In the optimal GWAS model (K+PCA), we found that 16 SNP loci significantly associated with 3 traits including relative root length, relative fresh weight and relative germination rate, and each locus explained phenotypic variations ranging from 9.42% to 13.14%. By analyzing the LD interval of the significant SNP locus and the corresponding interval sequence of, twenty-five candidate genes related to tribenuron-methyl tolerance were screened out in the LD interval of these significant SNP loci, in which nine of them belonged to cytochrome P450 gene families, five were involved in glutathione synthesis or metabolic processes, and two were multidrug-tolerance associated protein. At the same time, it was revealed that the genesignificantly related to germination rate encodes glutathione transferase, which participates in the process of toxin decomposition and plays an important role in various stress responses. In addition,was identified at relative root length and relative fresh weight. However, its function was not clear. 【Conclusion】In this study, 16 SNP loci were detected to be significantly associated with tribenuron-methyl tolerance, and 25 candidate genes were screened out.
L.; germination; tribenuron-methyl tolerance; GWAS
10.3864/j.issn.0578-1752.2019.03.002
2018-09-17;
2018-11-17
国家重点研发计划(2018YFD0100505)、现代农业产业技术体系(CARS-12)、重庆市社会事业与民生保障科技创新(cstc2015shmszx80026)
周清元,Tel:13883388890;E-mail:zhouqy2005@163.com。王倩,Tel:13251395292;E-mail:734747691@qq.com。周清元和王倩为同等贡献作者。通信作者崔翠,Tel:13883787860;E-mail:cuigreeny@163.com
(责任编辑 李莉)
