褐飞虱一个新的海藻糖合成酶基因的特性、发育表达及RNAi效果分析
2019-02-20唐斌沈祺达曾伯平肖仲久邱玲玉潘碧莹李昆张道伟
唐斌,沈祺达,曾伯平,肖仲久,邱玲玉,潘碧莹,李昆,张道伟
褐飞虱一个新的海藻糖合成酶基因的特性、发育表达及RNAi效果分析
唐斌1,2,沈祺达2,曾伯平1,肖仲久1,邱玲玉2,潘碧莹2,李昆1,张道伟1
(1遵义师范学院生物与农业科技学院,贵州遵义 563006;2杭州师范大学生命与环境科学学院,杭州 310036)
【背景】昆虫海藻糖合成酶基因是昆虫海藻糖合成的主要基因,大多数昆虫中只拥有一个海藻糖-6-磷酸合成酶(trehalose-6-phosphate synthase,TPS)基因,部分昆虫存在一个海藻糖-6-磷酸酯酶(trehalose-6-phosphate phosphatase,TPP)基因。前期研究发现褐飞虱()中拥有两个,对其功能研究发现不仅能够调控海藻糖代谢,还可介导海藻糖酶调控几丁质合成与降解途径,控制昆虫的蜕皮过程。【目的】通过对褐飞虱转录组测序分析获得了一个新的,检测该基因在褐飞虱不同发育阶段的表达情况,探究该基因的功能与前期发现的两个的区别。【方法】对获得的新基因序列采用克隆技术获得全长cDNA序列,经验证正确后,对其蛋白的一级、二级、三级结构及与其他昆虫的TPS进行比对分析,最后采用实时荧光定量PCR(qRT-PCR)技术测定3个不同在褐飞虱不同发育阶段的表达,并采用RNA干扰(RNAi)技术抑制的表达。【结果】在前期研究的基础上,克隆出一个新的,并命名为。开放阅读框长度为2 352 bp,编码783个氨基酸,预测蛋白分子量为88.9 kD,等电点为5.47,具有亲水性结构。生物信息学分析表明,褐飞虱3个TPS蛋白具有较高的同源性,都具有TPS和TPP两个保守结构域及其他特征序列,并且-螺旋、-折叠和无规则卷曲所占的比例较为接近。褐飞虱不同发育阶段3条的相对表达量不同,的相对表达量从4龄0 h开始逐渐上升,至成虫阶段达到最高,的相对表达量从4龄末期开始明显上升且在整个5龄阶段都有较高的表达,的相对表达量在5龄末期和成虫初期较高。单独干扰褐飞虱48 h后被干扰基因的相对表达量下降,ds能有效抑制的表达。【结论】在褐飞虱中发现一个新的(),其与褐飞虱中已经报道的TPS1和TPS2具有较高的同源性。不同发育阶段表达结果表明,3个在发育过程中行使的功能不同。RNAi能够有效抑制的表达并导致褐飞虱蜕皮障碍和翅发育畸形。
褐飞虱;海藻糖-6-磷酸合成酶;序列分析;蛋白结构;实时荧光定量PCR
0 引言
【研究意义】海藻糖是昆虫体内的血糖,其含量高达体内糖类物质的80%以上,在昆虫的发育及生理活动中起着非常重要的作用[1-4]。研究褐飞虱()不同海藻糖合成酶基因的具体功能和功能差异,可促进昆虫海藻糖合成途径进化及多样性研究的发展。明确新的海藻糖合成酶基因的特性和功能,可为褐飞虱防治提供新思路、新方向。【前人研究进展】昆虫中能够合成海藻糖最早在1961年时被发现,当时Steele将心侧体的组织液提取物注射到美洲大蠊()体内,结果直接导致了血淋巴中的海藻糖含量上升[5]。1963年,Bowers等在对另一种蟑螂()的研究中也发现上述现象[6]。此后的一系列研究表明,主要由于昆虫心侧体释放出神经肽(Hypertre- halosaemic)到血淋巴中,对脂肪体产生刺激,使其开始合成海藻糖,并且将合成的海藻糖输送到昆虫血淋巴中[7-9]。昆虫中的TPS和TPP,其蛋白序列都具有较高的保守性,与酿酒酵母()和大肠杆菌()海藻糖合成酶途径中的OtsA和OtsB相对应[8,10-11]。目前,已在多种昆虫体内发现并克隆出海藻糖合成酶基因,如甜菜夜蛾()、埃及伊蚊()、家蚕()、黑腹果蝇()、马铃薯甲虫()、东亚飞蝗()、白背飞虱()、柑橘大实蝇()、赤拟谷盗()等,其中德国小蠊()、金小蜂()和褐飞虱中均发现和报道了两个不同的[3,12-18]。【本研究切入点】褐飞虱为水稻最具破坏力的害虫之一[19],在20世纪中叶,亚洲褐飞虱仅在部分国家暴发,但自70年代至今,褐飞虱持续危害我国长江流域大面积的水稻,西南地区以及华南地区也多次暴发,并且有越来越严重的趋势;2012年在浙江金华、2014年在四川南充和浙江台州、2015年在云南多地均发生了大规模的褐飞虱危害[7,20-24]。褐飞虱为单食性害虫,只以水稻()或普通野生稻()为食,且具有繁殖速度快、生命周期短以及环境适应性强的特点[25]。褐飞虱通过其口器穿刺直接吸食水稻下部茎秆的汁液,攫取水稻养分,其取食及产卵行为会在水稻茎秆表皮上产生大量伤口,破坏输导组织,导致水稻茎秆内的养分和水分输送受阻。受创的水稻极易受到水稻纹枯病以及小球菌核病等水稻疾病的感染,对水稻的生长造成极大的危害,造成减产乃至绝收[7,26-27]。近年来,随着褐飞虱基因组测序的完成[28],褐飞虱迁飞相关的长翅型和短翅型调控机理等越来越受到关注[29-30]。但是,由于褐飞虱具有迁飞性,长期有效防治褐飞虱的方法仍然匮乏。【拟解决的关键问题】通常昆虫中仅有一个单独的,及的功能研究却少有报道[17,31],本研究从褐飞虱新发现的第3个入手,分析的序列结构特征,并研究褐飞虱不同在各发育阶段的表达特征及在褐飞虱蜕皮和翅形成中潜在功能,为褐飞虱防治提供理论依据。
1 材料与方法
试验于2016年9月至2017年7月在杭州师范大学完成。
1.1 供试材料
供试褐飞虱采集自浙江省农业科学院,在笔者实验室饲养。供试褐飞虱和水稻均置于人工气候箱或人工气候室中饲养和培育。褐飞虱饲养条件:温度(26±1)℃,光周期16 h/8 h,相对湿度为70%。用于饲养褐飞虱的水稻品种为TN1(Taichung Native 1)。水稻种植步骤:首先浸种,将水稻种子浸入约70℃的温水中浸泡10 min左右,再将种子浸泡到自来水中放至30℃人工气候培养箱浸种24 h;随后倒去浸种用水,用自来水冲洗数次后用湿纱布包裹种子,置于30℃人工气候培养箱催芽24—48 h,种子发芽后播种于塑料盆;适当施肥促进小苗生长,待长至三叶一心,转移至大田插秧;待水稻生长至分蘖中期后将其移至养虫笼,每隔2—3 d更换一次水稻。
大肠杆菌为笔者实验室保存,基因型为DH5,质粒pMD18-T载体购自Takara公司。
1.2 试验方法
1.2.1 褐飞虱总RNA的抽提及反转录成cDNA 取新鲜或存于-80℃冰箱的褐飞虱7头放入1.5 mL塑料离心管中,加Trizol 200 μL,用电动组织研磨器充分研磨,再加Trizol 800 μl补足至1 mL,用力振荡3 min,室温静置8 min;吸取200 μL氯仿加入塑料离心管中,上下颠倒直至混匀呈现均匀的乳粉色,室温静置10 min;4℃,12 000 r/min离心15 min;将上清液转移至1.5 mL塑料离心管,加入异丙醇500 μL,上下颠倒直至混匀,室温静置20 min;4℃,12 000 r/min离心10 min;轻轻倒去上清,加入1 mL的75%乙醇,并吹打洗涤沉淀;4℃,7 500 r/min离心5 min;轻轻倒去上清,用移液器吸出多余液体后将离心 管倒置于超净台中3—5 min,根据沉淀量加入20—50 μL DEPC水,轻轻吹打至沉淀溶解;利用电泳及分光光度计评价总RNA的完整性,剩余总RNA存放于-80℃冰箱。
使用TaKaRa PrimeScriptTMRT reagent Kit With gDNA Eraser试剂盒。先去除基因组DNA,方法为将RNase-free的500 μL塑料离心管置于冰上,加入5×gDNA Eraser Buffer 2 μL、gDNA Eraser 1 μL及Total RNA 1 μg,并用RNase Free dH2O补足至10 μL,水浴42℃反应2 min。随后在冰上向前述塑料离心管中加入5×PrimeScript Buffer 4 μL,PrimeScript RT Enzyme Mix I 1 μL及RT Primer Mix 1 μL,并用RNase Free dH2O补足至20 μL,水浴37℃反应15 min,水浴85℃反应5 s,cDNA保存于-20℃冰箱。
1.2.2 全长的PCR扩增及目的片段回收 使用TaKaRa Ex TaqTM试剂盒。向200 μL PCR管中加入褐飞虱cDNA 1 μL、Ex Taq 0.2 μL、10×Ex Taq Buffer(20 mmol·L-1Mg2+plus)2.5 μL、正向引物1 μL、反向引物1 μL、dNTP Mixture(2.5 mmol·L-1)2 μL,加无菌水补足至25 μL。将PCR产物扩增产物中取5 μL样品进行浓度为1%的琼脂糖凝胶电泳分析,采用Andy SafeTM核酸染料作为指示剂,检测到目的条带后将剩余PCR产物进行电泳,在紫外凝胶成像系统下用手术刀切割目的条带并放入1.5 mL塑料离心管。使用生工生物工程(上海)股份有限公司EZ Spin Column DNA Gel Extraction Kit纯化DNA。回收DNA,保存于-20℃冰箱。
1.2.3 回收产物的连接、转化、鉴定及测序 在冰上向200 μL PCR管中加入pMD 18-T Vector 0.5 μL、Solution I 3.5 μL及回收DNA片段3 μL,吹打混匀,水浴16℃反应30 min,若片段较长则延长反应时间。连接反应结束后,将连接片段转化到DH5感受细胞中。等到平板长出菌落后,挑取生长均匀,菌落边缘光滑且颜色透明的菌落至20 μL无菌水,混匀,用作菌落PCR模板,用于验证连接转化是否成功,片段长度验证为正确的菌液制备成甘油菌送往上海Invitrogen公司测序。
1.2.4 TPS3蛋白序列及二级、三级结构分析 在获得cDNA序列后,将其ORF翻译成蛋白质,使用BLAST序列比对软件(https://blast.ncbi.nlm.nih.gov/ Blast.cgi?PROGRAM=blastp&BLAST_PROGRAMS=blastp&PAGE_TYPE=BlastSearch&SHOW_DEFAULTS=on&LINK_LOC=blasthome)在GenBank数据库进行在线同源性比对,分析克隆得到的基因序列是否为新的。同时采用ExPASy ProtParam在线分析软件(http://web.expasy.org/protparam/)分析预测TPS3的理化性质,并与已知的TPS1和TPS2蛋白的理化性质比较。
利用SOPMA 在线分析软件(http://npsa-pbil.ibcp. fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_seccons.html),选择“MLRC on GOR4, SIMPA96 and SOPMA”、“DSC”及“PHD”模块,进行TPS3的二级结构预测。使用Biozentrum SWISS-MODEL在线分析软件(https://www.swissmodel. expasy.org/)对3条TPS进行蛋白质三维结构的预测[32-35]。
1.2.5 不同发育阶段褐飞虱的表达 从4龄褐飞虱开始,每12 h取材一次,每次随机取3组,每组7头,抽提总RNA,反转录成cDNA,用于通过实时荧光定量PCR(qRT-PCR)检测褐飞虱、及在不同发育时期的相对表达量。选用褐飞虱作为内参基因[36],使用Primer Premier 5.0软件设计褐飞虱、及的qRT-PCR引物(表1)。对引物进行梯度PCR验证,根据Tm值选择最适退火温度,并分析熔解曲线,进行琼脂糖凝胶电泳,确保PCR产物的特异性。

表1 荧光实时定量PCR引物和TPS3及GFP的dsRNA引物序列
qRT-PCR体系:SYBR Premix Ex Taq 10 μL、模板cDNA 1 μL(80 ng·μL-1)、PCR Forward primer(10 pmol)1 μL、PCR Reverse primer(10 pmol)1 μL,并用无菌水补足至20 μL。PCR扩增程序:95℃预变性3 min;95℃变性5 s,55—60℃退火延伸30 s,39个循环;65℃5 s,95℃绘制熔解曲线。
1.2.6 褐飞虱dsRNA注射及基因表达量的测定 dsRNA的合成:设计合成和褐飞虱的dsRNA引物(具体引物序列见表1)进行PCR扩增,扩增产物进行T克隆,然后用带T7启动子的引物进行交叉PCR反应,使用T7 RiboMAXTMExpress RNAi System试剂盒合成dsRNA,最后通过NanoDropTM2000型微量测定分光光度计检测合成的dsRNA的浓度。
dsRNA注射褐飞虱:选取5龄第1天褐飞虱若虫为试验对象,进行ds注射,同时注射ds作为对照组。将dsRNA从褐飞虱胸部两对后足中间注入体腔,注射量为200 ng/头,设置3个生物学重复。将注射好的褐飞虱转移至装有新鲜水稻的玻璃管中饲养,在注射后48 h收取褐飞虱活体,用液氮速冻后存于-80℃备用。
表达情况的测定:取注射后48 h收取的褐飞虱活体样本抽提总RNA,然后反转录得到3管平行cDNA,参照SYBR®Premix Ex TaqTM试剂盒的方法进行qRT-PCR检测。
1.2.7 数据统计与分析 通过定量PCR测定出4个基因的CT值,每管样品的3个重复孔取平均值用于计算(数值间变异系数应<5%,标准差应<0.5,3个数值中有2个或3个符合,数值可用,否者重做)。每次样品有3组数值,即最后得到的数据为平均值±9个重复。再通过2-ΔΔCT法进行计算,对照组为褐飞虱ds注射组的CT值。最后将换算出的值再进行具体分析。2-ΔΔCT计算公式[18]:2-ΔΔCT= 2-[(CT对照组-CT对照18s)- (CT待测组-CT待测组18s)]。
采用SPSS数据分析软件One-Way ANOVA进行差异性分析,再使用SigmaPlot 10.0软件的Vertical Bar Chart类型中的Grouped Error Bars图表选项绘制柱状图。
2 结果
2.1 褐飞虱TPS3序列全长及蛋白特性分析
褐飞虱的开放阅读框长度为2 352 bp,翻译成蛋白质的氨基酸数目为783个,预测的蛋白分子量为88.9 kD(C3978H6237N1063O1163S42),等电点为5.47,具有亲水性(表2、图1)。TPS3蛋白分析发现,含有20种氨基酸,其中亮氨酸(Leu)、异亮氨酸(Ile)、丝氨酸(Ser)和缬氨酸(Val)等含量较丰富,所占比例分别为10.0%、7.5%、7.4%和7.4%。酸性氨基酸(带负电荷)为101个,碱性氨基酸(带正电荷)为83个。与之前克隆的两个相比,本文克隆的第3个与前两个具有相似的氨基酸数量,等电点都偏酸性。

图1 褐飞虱TPS3的核苷酸和翻译的氨基酸序列
2.2 昆虫TPS氨基酸序列同源分析
选择德国小蠊的TPS1和TPS2、黑腹果蝇的TPS1、埃及伊蚊的TPS、赤拟谷盗的TPS以及家蚕的TPS与褐飞虱的TPS1、TPS2、TPS3蛋白进行同源比对,发现与其他昆虫的TPS蛋白相比,褐飞虱的3条TPS蛋白具有较高的氨基酸序列相似性。同时,包括褐飞虱在内的昆虫TPS蛋白都具有TPS和TPP这两个保守结构域,分别对应着酵母的OtsA和OtsB基因。此外,昆虫TPS还包含着一些非常保守的特征序列,如“WPLFHSMP”、“CRVDR”、“VDRLD”、“GRING”、“TPLRDGMN”和“YDGTL”(图2)。依据褐飞虱已经发表的基因组序列[28],分析发现TPS1(GQ397450)、TPS2(KU556826)和TPS3(KU556827)分别定位在scaffolds3259、scaffolds2574及scaffolds80上。上述结果表明,新发现的TPS3确实为一种新的TPS蛋白。

图2 褐飞虱的3条TPS与其他昆虫同源蛋白的氨基酸序列比对

表2 褐飞虱3个TPS蛋白的部分基本理化性质
2.3 褐飞虱3个TPS二级结构预测及分析
TPS比较保守,在二级结构上TPS1、TPS2和TPS3有明显的相似性(图3),特别是TPS1和TPS2,它们在相似的位点具有-螺旋或-折叠结构。具体表现在TPS1、TPS2和TPS3的-螺旋所占比例分别为40.27%、36.59%和35.50%;-折叠所占比例分别为12.76%、13.29%和18.01%;而无规则卷曲所占的比例分别为45.35%、49.39%和46.49%(表3)[13]。
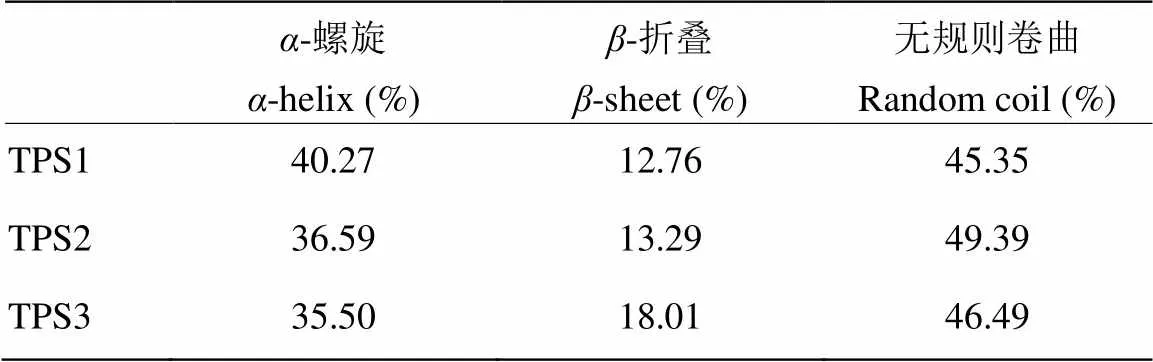
表3 褐飞虱TPS二级结构预测
2.4 蛋白质三维结构预测
由图4可以看出,TPS1的3D结构的寡聚物(oligostate)类型为同型二聚体(homodimer),含有较多的-螺旋结构,建模残基范围(modelled residue range)为6—416,基于模型5hxa.1.A建立,序列同源性(sequence identity)为37.91%。TPS2的3D结构的寡聚物类型为同型四聚体(homotetramer),由-螺旋及-折叠盘绕形成,并通过无规则卷曲相连,建模残基范围为8—492,基于模型5tvg.1.A建立,序列同源性为36.75%。TPS3的3D结构的寡聚物类型为单体(monomer),含有大量-螺旋及-折叠,建模残基范围为13—494。
2.5 褐飞虱TPS1、TPS2及TPS3不同发育阶段表达
由图5可以看出,和在褐飞虱4龄阶段表达量相对比较低,并且从4龄及5龄若虫阶段相对表达量呈现逐步上升到趋于平缓,在成虫阶段相对表达量明显上升,在成虫48 h开始相对表达量呈现极大的上升,在成虫60 h达到最大(图5-A)。在褐飞虱4龄36 h表达量明显上升,整个5龄若虫阶段都有相对较高的表达,在5龄96 h开始逐渐降低,在成虫36 h后开始回升(图5-B)。在褐飞虱4龄、5龄若虫乃至成虫阶段都有较高的相对表达量,其中5龄72 h开始较此之前的相对表达量有所提高(图5-C)。

A: TPS1; B: TPS2; C: TPS3

羽化后72 h的表达量设为1 The expression level at 72 h after emergence is set to 1
2.6 褐飞虱TPS3 dsRNA注射沉默效果
单独干扰褐飞虱48 h时,的表达显著下降(<0.01),说明单独注射可以有效抑制本基因的表达(图6-A)。同时,与ds组相比较,ds注射后,部分褐飞虱的蜕皮过程出现障碍,表现为蜕皮不能顺利完成及翅发育出现畸形(图6-B)。
3 讨论
昆虫TPS具有很强的保守性,一般包含约800个氨基酸,相对分子量在90 kD左右,等电点在5—8[3,37]。褐飞虱的、以及本研究新发现的分别包含807、820及783个氨基酸,预测出的相对分子量相似,且均为偏酸性等电点。尽管先前的研究表明昆虫海藻糖合成酶应该包含和两个合成酶基因。然而,均有发现和报道,如东亚飞蝗、白背飞虱、猫栉首蚤()、黑腹果蝇等[12,38-39];而仅在葱蝇()等个别物种中报道含有和[40-41];单独的基因序列自2011年后在NCBI中有登录,如黑腹果蝇(NM_135269)、台湾乳白蚁(,JN565075)和小菜蛾(,XM_011559193),但的功能研究少有报道[17,31]。同样,过去通常认为昆虫体内只有1个,但在2014年赵丽娜[13]在褐飞虱中发现和克隆到了第2个,随后在德国小蠊中也发现2个[14]。在一些无脊椎动物中,多个早有发现,如同属节肢动物门的蓝蟹()体内具有5个,并且长度各不相同,但有部分序列重叠[42];一种蛔虫()中同样发现和报道了3个[31,43]。本研究在褐飞虱中发现并获得了第3个,通过比较发现TPS1、TPS2、TPS3的基本理化性质和二级结构比较相似,但TPS3的三级结构与TPS1、TPS2相比差异较大,这可能与其具体的功能有关。

**:差异极显著(P<0.01)Extremely significant difference
目前比较认可的海藻糖合成途径为海藻糖在昆虫体内首先由UDP-葡萄糖和葡萄糖-6-磷酸通过海藻糖-6-磷酸合成酶(TPS)合成为海藻糖-6-磷酸,随后海藻糖-6-磷酸酯酶(TPP)将其转变为海藻糖[10-11]。唐斌等于2018年提出一种潜在的可能途径,即某些昆虫或无脊椎物种中,海藻糖合成酶可以单独将UDP-葡萄糖和葡萄糖-6-磷酸转化为海藻糖[10,31]。支持这种途径的依据有两个:一是昆虫所有发现的TPS蛋白都包含了TPS和TPP保守结构域,与酵母中OtsA和OtsB相对应,而OtsA和OtsB在酵母中分别为合成海藻糖的两个关键基因;其二,将棉铃虫的体外表达,发现其具有单独合成海藻糖的能力[44],同样在果蝇中也有类似的研究结果[45]。当然,这种潜在海藻糖合成途径还需要更多的科学研究进行验证,而包括褐飞虱在内的多个的具体功能及功能差异性研究将有助于推动昆虫海藻糖合成途径进化及多样性研究的发展。
基因的表达与其功能行使有着非常密切的关系。前期研究发现蓝蟹血淋巴中的在预蜕皮期及蜕皮前期有较高的相对表达量,并且在蜕皮后1—7 d也有一定的表达[46]。在葱蝇中发现在预蛹期也有较高的相对表达量[41]。褐飞虱为一种不完全变态昆虫,不同阶段发育表达研究表明在5龄若虫蜕皮为成虫后表达量上升,在4龄和5龄末的蜕皮前表达量较高,则在整个4龄若虫到成虫阶段表达量都较高,这些结果表明褐飞虱在蜕皮阶段和成虫期需要大量的海藻糖,而且可能不同的潜在功能有所不同。相似的研究发现果蝇幼虫阶段体内海藻糖含量较高,预蛹阶段的海藻糖含量达到最高,但在蛹期迅速回落[47]。同样的在4龄若虫和5龄若虫蜕皮前褐飞虱体内的海藻糖含量均较高[48],不同发育阶段的糖原含量变化也出现了这种情况,说明褐飞虱蜕皮生长时需要大量消耗储存的海藻糖和糖原。图5的结果表明褐飞虱3个在不同发育阶段相对表达量的变化趋势不尽相同,这从某种意义上说明3个在褐飞虱生长发育过程中可能具有不同的功能。先前的研究发现和都能通过调控几丁质代谢使得几丁质含量降低,从而控制褐飞虱的蜕皮[13,17],本研究同样发现表达被抑制后出现蜕皮困难与翅发育畸形现象,这些结果与和的功能类似,但是是否同样具有调控几丁质合成或其他的功能,则需要更加深入的研究。
4 结论
TPS3属于一个新TPS家族基因,其与褐飞虱中已经报道的TPS1和TPS2具有较高的同源性,包含TPS和TPP两个保守结构域,3个TPS具有相似的氨基酸组成。不同发育阶段表达结果表明,3个在发育过程中行使的功能不同,ds注射能够有效抑制的表达,同时导致部分褐飞虱翅畸形和蜕皮出现障碍。
[1] BECKER A, SCHLöDER P, STEELE J E, WEGENER G. The regulation of trehalose metabolism in insects., 1996, 52(5): 433-439.
[2] ELBEIN A D, PAN Y T, PASTUSZAK I, CARROLL D. New insights on trehalose: a multifunctional molecule., 2003, 13(4): 17R-27R.
[3] TANG B, CHEN J, YAO Q, PAN Z Q, XU W H, WANG S G, ZHANG W Q. Characterization of a trehalose-6-phosphate synthase gene fromand its function identification through RNA interference., 2010, 56(7): 813-821.
[4] 张露, 朱世城, 郑好, 沈祺达, 王世贵, 唐斌. 褐飞虱海藻糖酶基因在表皮几丁质代谢中的调控作用. 中国农业科学, 2017, 50(6): 1047-1056.
ZHANG L, ZHU S C, ZHENG H, SHEN Q D, WANG S G, TANG B. Regulatory function of trehalase genes on chitin metabolism in the cuticle of., 2017, 50(6): 1047-1056. (in Chinese)
[5] STEELE J E. Occurrence of a hyperglycemic factor in the corpus cardiacum of an insect., 1961, 192: 680-681.
[6] BOWERS W S, FRIEDMAN S. Mobilization of fat body glycogen by an extract of corpus cardiacum., 1963, 198: 685.
[7] 陈静. 褐飞虱遗传多样性及其海藻糖合成酶基因功能的分析[D]. 广州: 中山大学, 2010.
CHEN J. Genetic diversity and function analysis of agene of[D]. Guangzhou: Sun yat-sen University, 2010. (in Chinese)
[8] 唐斌, 徐青叶, 赵丽娜, 王世贵, 张帆. 昆虫海藻糖及其合成酶基因的特性与功能研究进展. 应用昆虫学报, 2014, 51(6): 1397-1405.
TANG B, XU Q Y, ZHAO L N, WANG S G, ZHANG F. Progress in research on the characteristics and functions of trehalose and thegene in insects., 2014, 51(6): 1397-1405. (in Chinese)
[9] THOMPSON S N. Trehalose - The insect ‘blood’ sugar., 2003, 31: 205-285.
[10] 唐斌, 张露, 熊旭萍, 汪慧娟, 王世贵. 海藻糖代谢及其调控昆虫几丁质合成研究进展. 中国农业科学, 2018, 51(4): 697-707.
TANG B, ZHANG L, XIONG X P, WANG H J, WANG S J. Advances in trehalose metabolism and its regulation of insect chitin synthesis., 2018, 51(4): 697-707. (in Chinese)
[11] 于彩虹, 卢丹, 林荣华, 王晓军, 姜辉, 赵飞. 海藻糖——昆虫的血糖. 昆虫知识, 2008, 45(5): 832-837.
YU C H, LU D, LIN R H, WANG X J, JIANG H, ZHAO F. Trehalose——the blood sugar in insects., 2008, 45(5): 832-837. (in Chinese)
[12] 张道伟, 陈静, 郭玉双. 白背飞虱海藻糖合成酶基因的克隆及序列分析. 黑龙江农业科学, 2012(5): 14-19.
ZHANG D W, CHEN J, GUO Y S. Cloning and sequence analysis ofgene from., 2012(5): 14-19. (in Chinese)
[13] 赵丽娜. 海藻糖酶和海藻糖合成酶基因对褐飞虱海藻糖代谢途径关键基因的调控研究[D].杭州: 杭州师范大学, 2014.
ZHAO L N. Regulating effects of trehalase and TPS on the key genes in the pathway of trehalose metabolic in[D]. Hangzhou: Hangzhou Normal University, 2014. (in Chinese)
[14] 陈静, 张道伟. 德国小蠊两个海藻糖合成酶基因的克隆、组织分布及温度诱导表达分析. 昆虫学报, 2015, 58(10): 1046-1053.
CHEN J, ZHANG D W. Molecular cloning, tissue distribution and temperature-induced expression of two trehalose-6-phosphate synthasegenes in(Blattodea: Blattellidae)., 2015, 58(10): 1046-1053. (in Chinese)
[15] Xiong K C, Wang J, Li J H, Deng Y Q, Pu P, Fan H, LIU Y H. RNA interference of a trehalose-6-phosphate synthase gene reveals its role during larval-pupal metamorphosis in(Diptera: Tephritidae)., 2016, 91/92: 84-92.
[16] Shi J F, Xu Q Y, Sun Q K, Meng Q W, Mu L L, Guo W C, LI G Q. Physiological roles of trehalose inlarvae revealed by RNA interference of trehalose-6-phosphate synthase and trehalase genes., 2016, 77: 52-68.
[17] YANG M M, ZHAO L N, SHEN Q D, XIE G Q, WANG S G, TANG B.Knockdown of two trehalose-6-phosphate synthases severely affects chitin metabolism gene expression in the brown planthopper., 2017, 73(1): 206-216.
[18] Chen Q W, Jin S, Zhang L, Shen Q D, Wei P, Wei C M, Wang S G, Tang B.Regulatory functions of trehalose-6-phosphate synthase in the chitin biosynthesis pathway in(Coleoptera: Tenebrionidae) revealed by RNA interference., 2018, 108(3): 388-399.
[19] 余德涛. 褐飞虱的生物学特征及鉴别. 农技服务, 2007, 24(2): 45-46.
YU D T. Biological characteristics and identification of brown planthopper., 2007, 24(2): 45-46. (in Chinese)
[20] 高希武, 彭丽年, 梁帝允. 对2005年水稻褐飞虱大发生的思考. 植物保护, 2006, 32(2): 23-24.
GAO X W, PENG L N, LIANG D Y. Factors causing the outbreak of brown planthopper (BHP),Stå1 in China in 2005., 2006, 32(2): 23-24. (in Chinese)
[21] Liu Z W, Han Z J. Fitness costs of laboratory-selected imidacloprid resistance in the brown planthopper,Stål., 2006, 62(3): 279-282.
[22] 齐国君. 褐飞虱发生规律的再研究——广西、安徽两省区的个例分析[D]. 南京: 南京农业大学, 2009.
QI G J. New study on population dynamics of brown planthopper-A case study of Guangxi and Anhui[D]. Nanjing: Nanjing Agricultural University, 2009. (in Chinese)
[23] 范峰峰, 邱颖波, 刘行丹, 李绍清, 刘建丰. 水稻抗褐飞虱基因及其育种应用研究进展. 中国农学通报, 2014, 30(6): 13-19.
FAN F F, QIU Y B, LIU X D, LI S Q, LIU J F. Research progress on the research and use of brown planthopper resistance genes in rice., 2014, 30(6): 13-19. (in Chinese)
[24] 俞姗姗, 刘雅, 杨萌萌, 沈祺达, 谢国强, 王世贵, 唐斌. 褐飞虱在不同水稻品系上繁殖能力及相关解毒酶系基因表达变化分析. 杭州师范大学学报(自然科学版), 2016, 15(6): 595-599.
YU S S, LIU Y, YANG M M, SHEN Q D, XIE G Q, WANG S G, TANG B. Fertility and related detoxification enzyme systems gene expression offeeding on different rice varieties., 2016, 15(6): 595-599. (in Chinese)
[25] 程遐年, 吴进才, 马飞. 褐飞虱研究与防治. 北京: 中国农业出版社, 2003.
CHENG X N, WU J C, MA F.:. Beijing: China agriculture press, 2003. (in Chinese)
[26] 李汝铎, 丁锦华, 胡国文, 苏德明. 褐飞虱及其种群管理. 上海: 复旦大学出版社, 1996.
LI R D, DING J H, HU G W, SU D M.. Shanghai: Fudan University press, 1996. (in Chinese)
[27] 杨萌萌. 海藻糖酶及其抑制剂 (Validamycin)对褐飞虱海藻糖和几丁质代谢的调控研究[D]. 杭州: 杭州师范大学, 2016.
YANG M M. Regulating effects of trehalase and its inhibitor (Validamycin) on the trehalose and chitin metabolism in[D]. Hangzhou: Hangzhou Normal University, 2016. (in Chinese)
[28] XUE J, ZHOU X, ZHANG CX, YU L L, FAN H W, WANG Z, XU H J, XI Y, ZHU Z R, ZHOU W W, PAN P L, LI B L, COLBOURNE J K, NODA H, SUETSUGU Y, KOBAYASHI T, ZHENG Y, LIU S, ZHANG R, LIU Y, LUO Y D, FANG D M, CHEN Y, ZHAN D L, LV X D, CAI Y, WANG Z B, HUANG H J, CHENG R L, ZHANG X C, LOU Y H, YU B, ZHOU J C, YE Y X, ZHANG W Q, SHEN Z C, YANG H M, WANG J, WANG J, BAO Y Y, CHENG J A. Genomes of the rice pest brown planthopper and its endosymbionts reveal complex complementary contributions for host adaptation., 2014, 15(12): 521.
[29] XU H J, XUE J, LU B, ZHANG X C, ZHOU J C, HE S F, MA X F, JIANG Y Q, FAN H W, XU J Y, YE Y X, PAN PL, LI Q, BAO Y Y, NIJHOUT H F, ZHANG C X. Two insulin receptors determine alternative wing morphs in planthoppers.,2015, 519(7544): 464-467.
[30] LIN X D, XU Y L, JIANG J R, LAVINE M, LAVINE L C. Host quality induces phenotypic plasticity in a wing polyphonic insect., 2018, 115(29): 7563-7568.
[31] TANG B, WANG S, WANG S G, WANG H J, ZHANG J Y, CUI S Y. Invertebrate trehalose-6-phosphate synthase gene: genetic architecture, biochemistry, physiological function, and potential applications., 2018, 9: 30.
[32] Arnold K, Bordoli L, Kopp J, Schwede T. The SWISS-MODEL workspace: a web-based environment for protein structure homology modelling., 2006, 22(2): 195-201.
[33] RAO K N, KUMARAN D, Seetharaman J, Bonanno J B, BURLEY S K, Swaminathan S. Crystal structure of trehalose-6- phosphate phosphatase-related protein: Biochemical and biological implications., 2006, 15(7): 1735-1744.
[34] Benkert P, Biasini M, Schwede T. Toward the estimation of the absolute quality of individual protein structure models., 2011, 27(3): 343-350.
[35] Biasini M, Bienert S, Waterhouse A, Arnold K, Studer G, Schmidt T, Kiefer F, Cassarino T G, Bertoni M, Bordoli L, Schwede T. SWISS-MODEL: modelling protein tertiary and quaternary structure using evolutionary information., 2014, 42(w1): 252-258.
[36] Zhao L N, Yang M M, Shen Q D, LIU X, Shi Z K, Wang S G, Tang B.Functional characterization of three trehalase genes regulating the chitin metabolism pathway in rice brown planthopper using RNA interference., 2016, 6: 27841.
[37] Tang B, Zheng H Z, Xu Q, Zou Q, Wang G J, Zhang F, Wang S G, Zhang Z H. Cloning and pattern of expression of trehalose-6-phosphate synthase cDNA from(Orthoptera: Catantopidae)., 2011, 108(3): 355-363.
[38] 崔淑燕. 东亚飞蝗海藻糖合成酶基因的克隆与功能研究[D]. 重庆: 重庆大学, 2008.
CUI S Y. Isolation, cloning and function analysis of trehalose-6- phosphate synthase from[D]. Chongqing: Chongqing University, 2008. (in Chinese)
[39] Kern C, Wolf C, Bender F, Berger M, Noack S, Schmalz S, Ilg T. Trehalose-6-phosphate synthase from the cat fleaand: gene identification, cloning, heterologous functional expression and identification of inhibitors by high throughput screening., 2012, 21(4): 456-471.
[40] 李源, 郝友进, 张玉娟, 司风玲, 陈斌. 葱蝇海藻糖-6-磷酸合成酶基因的克隆、序列分析及滞育相关表达. 昆虫学报, 2013, 56(4): 329-338.
LI Y, HAO Y J, ZHANG Y J, SI F L, CHEN B. Cloning, bioinformatics analysis and diapause-related expression of trehalose- 6-phosphate synthase gene from the onion maggot,(Diptera: Anthomyiidae)., 2013, 56(4): 329-338. (in Chinese)
[41] Guo Q, Hao Y J, Li Y, Zhang Y J, Ren S, Si F L, Chen B. Gene cloning, characterization and expression and enzymatic activities related to trehalose metabolism during diapause of the onion maggot(Diptera: Anthomyiidae)., 2015, 565(1): 106-115.
[42] Shi Q, Chung J S. Trehalose metabolism in the blue crab: isolation of multiple structural cDNA isoforms of trehalose-6-phosphate synthase and their expression in muscles., 2014, 536(1): 105-113.
[43] Dmitryjuk M, Łopienska-Biernat E, Zaobidna E A. Theeffect of ivermectin on the activity of trehaose synthesis pathway enzymes and their mRNA expression in the muscle of adult female(Nematoda)., 2014, 2014: Article ID 936560.
[44] XU J, BAO B, ZHANG Z F, YI Y Z, XU W H. Identification of a novel gene encoding the trehalose phosphate synthase in the cotton bollworm,., 2009, 19(3): 250-257.
[45] Yoshida M, Matsuda H, Kubo H, Nishimura T. Molecular characterization ofandgenes inand their role in body water homeostasis., 2016, 6: 30582.
[46] Chung J S. A trehalose6-phosphate synthase gene of the hemocytes of the blue crab,: cloning, the expression, its enzyme activity and relationship to hemolymph trehalose levels., 2008, 4: 18.
[47] Matsuda H, Yamada T, Yoshida M, Nishimura T. Flies without trehalose., 2015, 290(2): 1244-1255.
[48] ZHANG L, QIU L Y, YANG H L, WANG H J, ZHOU M, WANG S G, TANG B. Study on the effect of wing bud chitin metabolism and its developmental network genes in the brown planthopper,by knockdown TRE gene., 2017, 8: 750.
characteristics, developmental expression and RNAi effect analysis of a novel trehalose-6-phosphate synthase gene in
TANG Bin1,2, SHEN Qida2, ZENG Boping1, XIAO Zhongjiu1, QIU Lingyu2, PAN Biying2, LI Kun1, ZHANG Daowei1
(1College of Biology and Agriculture, Zunyi Normal University, Zunyi 563006, Guizhou;2College of Life and Environmental Science, Hangzhou Normal University, Hangzhou 310036)
【Background】Insect trehalose-6-phosphate synthase (TPS) is the main gene for insect trehalose synthesis. Most insects possess one trehalose-6-phosphate synthase gene, and some insects have one trehalose-6-phosphate phosphatase (TPP) gene. Previous studies have found that there are twogenes in the brown planthopper () and their functional studies have shown thatcan not only regulate trehalose metabolism, but also mediate trehalase regulation of chitin synthesis and degradation pathways, and control insect molting process.【Objective】a novelwas obtained by the transcriptome sequencing of. The objective of this study is to detect the expression of the gene in different developmental stages of, and to explore the difference between the function of the gene and the two previously discoveredgenes.【Method】The full-length cDNA sequence of the novelwas obtained by cloning technique. After correct verification, the primary, secondary, and tertiary structures of the protein were obtained. The protein structure and alignment of TPS were analyzed with other insects. Finally, qRT-PCR was used to determine the expression of three differentgenes at different development stages of, and RNA interference (RNAi) was used to inhibit the expression of.【Result】Based on the previous study, this novelwas cloned and named as. The open reading frameofis 2 352 bp, encoding 783 amino acids. the predicted molecular weight of the protein is 88.9 kD and the isoelectric point is 5.47, with a hydrophilic structure. Bioinformatics analysis showed that the three TPS proteins ofhad high homology, with two conserved domains of TPS and TPPand other characteristic sequences, and the proportion of-helix,-sheet, and random curl was similar. The relative expression levels of threegenes in different developmental stages ofwere different. The relative expression level ofgradually increased from 0 h of 4th instar to the highest level at the adult stage. The relative expression level ofincreased obviously from the end of 4th instar and was higher in the whole 5th instar. The expression ofwas relatively higher at the end of the 5th instar and the early stage of adult. The relative expression level of the interfered gene significantly decreased after 48 hours of single interference with. The dscould effectively inhibit the expression of.【Conclusion】A novel() was found in, which has high homology with TPS1 and TPS2 reported in. The results of expression at different developmental stages showed that the threegenes performed different functions during development. RNAi could effectively inhibit the expression ofand lead to molting and wing deformity.
; trehalose-6-phosphate synthase (TPS); sequence analysis; protein structure; quantitative real-time PCR (qRT-PCR)
10.3864/j.issn.0578-1752.2019.03.007
2018-09-11;
2018-10-23
国家自然科学基金(31672081)、贵州省科学技术基金(黔科合JZ字[2014]2014号)
唐斌,E-mail:tbzm611@163.com。通信作者张道伟,Tel:0851-28922091;E-mail:zhangdw1000@163.com
(责任编辑 岳梅)
