黄萎病不同发生程度棉田土壤中的真菌群落特征分析
2019-02-20刘海洋王伟张仁福热西达阿不都热合曼姚举
刘海洋,王伟,张仁福,热西达·阿不都热合曼,姚举
黄萎病不同发生程度棉田土壤中的真菌群落特征分析
刘海洋1,王伟1,张仁福1,热西达·阿不都热合曼2,姚举1
(1新疆农业科学院植物保护研究所/农业部西北荒漠绿洲作物有害生物综合治理重点实验室,乌鲁木齐 830091;2新疆伊宁市农业技术推广站,新疆伊宁 835000)
【目的】真菌是土壤微生物系统的重要组成部分,对土壤环境变化有明显的指示作用。本研究对黄萎病不同发生程度棉田土壤中的真菌群落特征进行分析,旨在探明大丽轮枝菌()入侵棉田对土壤中真菌多样性和群落结构的影响,揭示土壤中真菌群落在棉花黄萎病发生过程中的生态作用。【方法】以阿克苏、石河子不同发病程度棉田和库尔勒人工接菌棉田为研究对象,从中采集6个土壤样品:阿克苏重病田土壤(AD)、阿克苏对照田土壤(ACK)、石河子重病田土壤(SD)、石河子对照田土壤(SCK)、库尔勒重病田土壤(KD)、库尔勒对照田土壤(KCK)。采用Illumina Hiseq高通量测序技术,研究土壤中真菌的多样性及群落结构,结合冗余分析(RDA)明确真菌群落结构与土壤养分的相关性。【结果】在97%相似度水平下,AD和SD样品中真菌的OTU数量、Chao1和Ace丰富度指数均分别高于其对照ACK、SCK,而Simpson指数均分别低于其对照;人工接菌的KD与其对照KCK样品之间OTU数量、Chao1和Ace丰富度指数以及Simpson指数均无显著差异。NMDS分析表明,AD、SD土壤样品首先表现为明显的空间趋向性,之后表现为时间趋向性,而库尔勒土壤样品则首先表现为时间趋向性,其次是空间趋向性。群落组成方面,在门水平上,土壤中Ascomycota的丰度占绝对优势,其次为Basidiomycota和Mortierellomycota,3个门在KD与KCK样品之间以及SD与SCK样品之间的丰度差异较小,而在AD和ACK样品之间丰度差异较大;在属水平上,的丰度最高,其与在不同区域重病田土壤中丰度均高于对照,而均低于对照。此外,AD样品中、、的丰度均低于ACK,而此3个属在SD样品中的丰度均高于SCK样品。组间差异显著分析表明,库尔勒、石河子土壤中的显著差异标记均主要富集于重病田中,而阿克苏土壤中显著差异标记主要富集于无病田中。相关性分析表明,土壤中有机质、全氮量与真菌的OTU数量、丰度呈显著正相关,与Simpson指数的相关性低;pH、全磷和全钾与Simpson指数明显正相关,总盐与Simpson指数明显负相关。RDA分析表明,土壤中的真菌群落与有机质、全氮、总盐明显相关。【结论】自然重病棉田土壤中真菌的OTU数量、丰度均高于轻病或无病田,而真菌的多样性低。人工接种大丽轮枝菌短期内未对土壤中真菌的丰度、多样性和群落结构造成明显影响。土壤中真菌的多样性、丰度和组成受有机质、全氮、含盐量等指标影响显著。采样时期对土壤中真菌群落结构同样有明显影响。
大丽轮枝菌;棉花黄萎病;入侵;棉田土壤;真菌群落;高通量测序
0 引言
【研究意义】真菌是土壤微生物系统的重要组成部分,其种群结构的变化能够反映土壤生态的状态及变化趋势[1]。真菌在土壤生态系统中作为分解者[2],其分泌的酶可以降解易分解化合物,有利于植物吸收氮、磷等营养元素[3],在促进土壤生态系统物质循环、形成土壤团聚体和改良土壤结构等方面具有重要作用[4-5]。与细菌相比,真菌能更好地降解复杂化合物[6],对土壤环境的变化更敏感[7],其动态变化可作为土壤生态变化规律的指示因子[8-9]。棉花黄萎病菌(大丽轮枝菌)可在土壤中长期存活,一旦入侵土壤便难以消除。作为土传病害,棉花黄萎病的发生与土壤微生物群落结构、土壤养分指标等因素密切相关。对新疆棉花黄萎病不同发生程度棉田土壤中的真菌群落特征进行分析,研究黄萎病菌入侵对棉田土壤中真菌多样性和群落组成的影响,有助于揭示病菌侵染与土壤中真菌群落的互作关系。【前人研究进展】顾美英等[10]研究表明,发病棉花根际土壤中的微生物总量、真菌数量均大于健康棉株,认为大丽轮枝菌侵染棉花能导致其根际土壤中的真菌数量大幅度增加;Luan等[11]报道发病棉花根际土壤中镰孢菌属()、轮枝菌属()数量较多,而在健康棉花根际土中木霉属()等有益菌的数量显著高于发病棉花。其他植物受病原菌侵染后亦有较为一致的研究结论,邓晓等[12]研究表明香蕉枯萎病危害程度中、重度土壤中真菌种类无明显改变,但是数量较危害程度轻和无危害土壤却明显增加。植物根腐病的发生能够引起土壤中微生物群落结构的明显改变,王玲娜等[13]研究表明,芹菜根腐病发病初期病株根区真菌的数量较健康株有所减少,而在发病中、晚期病株真菌数量均较健康株有所增加;李雪萍等[14]研究发现,青稞根腐病的发生会使根际土壤细菌和放线菌数量减少,真菌数量增多;官会林等[15]研究表明,三七根腐病的发生与土壤中厌氧细菌、真菌及放线菌数量的增加及其种群数量比例变化有密切的关联性。叶部病害的发生同样能够引起土壤中真菌的富集,吴斌等[16]研究发现,作物地上组织发病如小麦黄花叶病毒病发病严重地块的真菌数量和种类显著增加。【本研究切入点】目前,利用平板计数等传统方法分析棉花黄萎病株根际土壤中可培养微生物有少量研究。然而利用Illumina Hiseq高通量测序技术研究棉花黄萎病不同发生程度棉田土壤中真菌多样性的研究鲜见报道。【拟解决的关键问题】对新疆不同区域黄萎病发生程度不同的棉田土壤中真菌群落结构进行深入分析,探明棉田黄萎病发生程度由重至无、由无至重过程中土壤真菌群落的变化特征,以期揭示土壤中的真菌群落在棉花黄萎病发生过程中的生态作用,为利用微生态调控手段防控棉花黄萎病提供理论依据。
1 材料与方法
1.1 材料
2016年在阿克苏市(40°34′ N,81°19′ E)、库尔勒市(41°45′ N,85°48′ E)和石河子市(44°18′ N,85°59′ E)分别选择具有代表性的棉花黄萎病重度发生棉田与无病(轻度)对照棉田各1块,3地共计6块棉田(表1)。重病田采集发病等级3以上棉株根围土,对照田采集健康棉株根围土,于4月与8月份每块棉田3点取样2次,每取样点间隔50 m,每点取0—10 cm土层小样5份,每份200 g,混合为1份样品,每采样时期计18份混合样品,共36份混合样品,经2 mm孔径过样筛处理,保存于-80℃冰箱备用。
1.2 棉田发病程度调查
每块取样棉田调查5点,每点调查100株棉花,按照国内棉花黄萎病统一分级标准进行统计,计算每块取样棉田病情指数。病情指数=[∑(各级病株数×各级代表值)/(调查总株数×4)]×100。
1.3 采样棉田信息
阿克苏棉花黄萎病重病田(Aksu disease,AD)为自然棉田,以相邻的棉花黄萎病重病田经水稻轮作后的无病棉田(Aksu control,ACK)为对照,种植棉花品种均为中棉49号;石河子棉花黄萎病重病田(Shihezi disease,SD)、轻病对照田(Shihezi control,SCK)均为自然棉田,种植棉花品种均为新陆早64号;库尔勒重病田(Korla disease,KD)为连续3年在无病田中人工接种棉花黄萎病菌改造而来,以相邻无病田(Korla control,KCK)为对照,种植品种均为新陆中66号。以上棉田均为覆膜滴灌棉田,每个区域重病田与对照田的管理措施一致。棉田发病程度、土壤中微菌核量、土壤养分指标等数据已另文发表[17]。
1.4 土壤总DNA的提取与文库构建、测序
利用北京百泰克生物技术公司生产的DP4001土壤试剂盒,严格按照操作步骤提取土壤总DNA,利用1%琼脂糖凝胶电泳检测提取的DNA质量,使用Nano Drop 2000 UV-Vis光谱仪测定DNA浓度,总量满足3次及以上建库要求。所用引物为真菌ITS1区域引物:5′-CTTGGTCATTTAGAGGAAGTAA-3′,5′-GCTGCG TTCTTCATCGATGC-3′;内部ITS1F:AACCTGCGG AAGGATCATT,内部ITS1R:GARCCAAGAGATCC RTTG。PCR扩增程序:95℃预变性5 min;95℃变性30 s,50℃退火30 s,72℃延伸40 s,25个循环;72℃延伸7 min。由北京百迈客生物科技有限公司构建DNA文库,采用Illumina Hiseq 2500 PE250模式进行测序。
1.5 数据处理与分析
对测序获得的原始数据使用FLASH V1.2.7软件,按照最小重叠长度10 bp、重叠区最大错配比率0.2对每个样品的序列进行拼接,得到的拼接序列即原始序列。将拼接得到的序列用Trimmomatic软件设置50 bp的窗口,如果窗口内的平均质量值低于20,截去后端碱基,过滤质控后长度小于标签长度75%的标签,使用UCHIME软件并去除嵌合体,得到高质量的序列。
在相似性97%的水平上使用UCLUST软件对序列进行聚类,以所有序列数的0.005%作为阈值过滤OTU。在Unite真菌ITS数据库进行比对。在置信度阈值为0.8利用RDP Classifier软件进行物种注释分类,作图时将丰度低于1%的物种合并为Others在图中显示,Unknown代表未得到分类学注释的OTU。利用ClustalW2软件进行多重比对,邻接法(neighbor- joining,NJ)建树。利用Mothurversion V.1.30软件进行Alpha多样性指数分析,包括Chao1丰富度估计量(Chao1 richness estimator)、Ace丰富度估计量(Ace richness estimator)、香农-威纳多样性指数(Shannon- wiener diversity index)与辛普森多样性指数(Simpson diversity index);基于Binary jaccard、Bray curtis多种算法呈现物种多样性矩阵,进行Beta多样性分析(≥3),基于R语言平台绘制样本非度量多维尺度分析(NMDS)以及环境因子与样本组成相关性分析(RDA)。利用LefSe分析方法设定显著差异的LDA值为4.0,寻找组间丰度差异显著物种,采用线性判别分析(LDA)来估算每个组分(物种)丰度对差异效果的影响。

表1 棉田土壤样品
利用Excel软件对常规数据进行整理、汇总,利用SPSS19.0软件的ANOVA程序中Duncan分析法对数据进行差异显著性分析,<0.05为差异显著。
2 结果
2.1 黄萎病不同发生程度棉田真菌多样性
在97%相似度水平下,AD和SD样品4月和8月份采集的土壤中真菌的OTU数量、Chao1丰富度指数、Ace丰富度指数均分别高于其对照ACK、SCK样品,而辛普森指数均分别低于对照。其中SD与SCK样品的OTU数量存在显著性差异。人工接菌的KD样品与对照在OTU数量、Chao1丰富度指数、Ace丰富度指数、辛普森指数方面均极为接近,两组样品之间无显著差异。分析表明,自然发病的重病田中真菌的丰度相比轻病或无病田有所上升而多样性下降,而人工接入病原菌短期内未对土壤中真菌的丰度和多样性产生较大影响(表2)。
NMDS分析发现,当应力值=0.1396时,阿克苏样品主要分布在第Ⅲ象限,其中AD样品的4月与8月份样品距离较近,表现出较高的相似性;ACK样品的4月与8月份样品同样表现出较高的相似性。石河子样品主要分布在第Ⅱ象限,其中SD样品的4月、8月份样品距离近,相似性较高;而SCK样品的4月与8月份样品距离较远,样品中真菌群落相似差异较大。库尔勒样品主要集中在第Ⅰ、Ⅳ象限,KD与KCK两组样品的4月份样品距离较近,相似性较高,但与8月份样品距离较远,差异较大。不同区域土壤样品之间表现出不同的时空趋向性(图1)。AD、SD中土壤样品首先表现为明显的空间趋向性,之后表现为时间趋向性,而库尔勒土壤样品则受采样时间因素影响较大,其次是空间趋向性。
2.2 黄萎病不同发生程度棉田土壤真菌群落组成
在门水平上,Ascomycota(64.15%—82.10%)的丰度在不同样品中均占绝对优势,在AD、KD、SD样品中丰度均分别低于其对照;而Basidiomycota和Mortierellomycota则在AD、KD、SD样品中丰度均分别高于其对照。Ascomycota、Basidiomycota以及Mortierellomycota在库尔勒KD(74.14%、15.07%、3.87%)与其对照KCK样品(75.07%、14.59%、3.57%)之间以及石河子SD(76.42%、12.96%、3.58%)和其对照SCK样品(82.10%、10.34%、2.78%)之间丰度相差较小,而在阿克苏AD(64.15%、18.84%、5.62%)样品和其对照ACK(80.27%、9.69%、2.67%)样品之间丰度差异较大,表明病原菌的接入对土壤中门水平优势真菌群落的影响较小,而ACK样品取样田前茬种植水稻则明显地影响了土壤中门水平优势真菌的丰度(图2)。
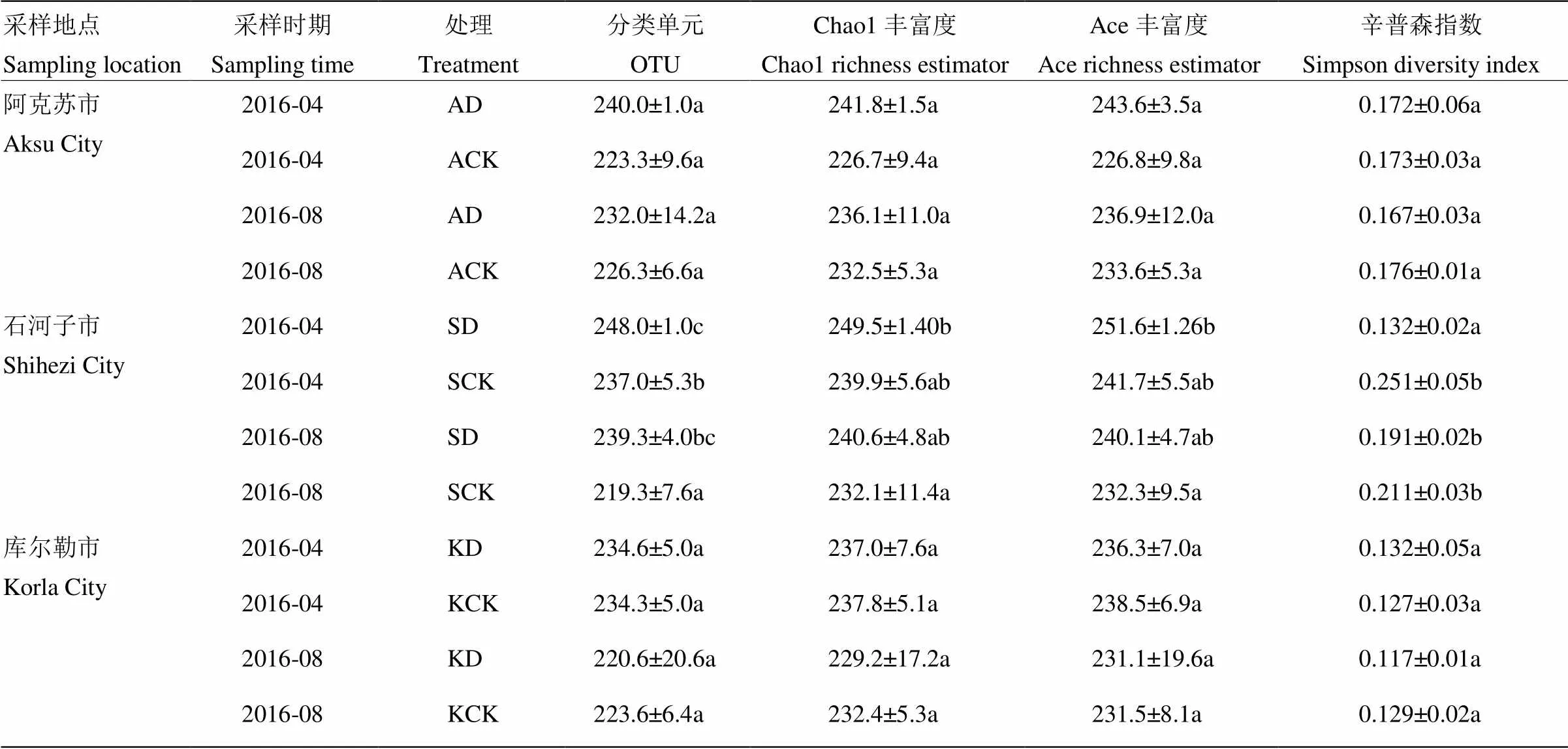
表2 土壤中真菌的Alpha多样性指数
同列数据后不同小写字母表示差异显著(<0.05)
Different lowercases after data in the same column indicate significant difference (<0.05)

A4:石河子重病田(4月) Serious disease fields of Shihezi (April); B4:A4对照The control of A4;A8:石河子重病田(8月)Serious disease fields of Shihezi (August);B8:A8对照The control of A8;C4:库尔勒重病田(4月)Serious disease fields of Korla (April);D4:C4对照The control of C4;C8:库尔勒重病田(8月)Serious disease fields of Korla (August);D8:C8对照The control of C8;E4:阿克苏重病田(4月)Serious disease fields of Aksu (April);F4:E4对照The control of E4;E8:阿克苏重病田(8月)Serious disease fields of Aksu (August);F8:E8对照The control of E8

图2 土壤中门(左图)和属(右图)分类水平的真菌群落结构
在属水平上,土壤中的丰度最高,其与在不同区域重病田土壤中丰度均高于对照,其中在AD样品中的丰度(17.53%)约为ACK样品(8.79%)的2倍;而在不同处理的对照田中均高于重病田。此外,AD样品中、、、、均低于ACK样品,而、、在SD样品中的丰度均高于SCK(图2)。
组间差异显著性分析发现,当设定LDA值>4时,不同组样品之间具有显著性差异的标记极少。当设定LDA值>3时,库尔勒土壤中的显著差异标记均富集于KD样品组中,包括Aphelidiomycota、Aphelidiomycetes、、等。石河子土壤SD样品中富集的显著差异标记为10个,包括Dothideomycetes、、和等,而SCK样品中仅3个,包括Sordariales、Lasiosphaeriaceae和。阿克苏土壤中显著差异标记主要富集于ACK样品中,有别于石河子和库尔勒土壤,ACK组样品中的差异标记包括Hypocreales、Nectriaceae、和等,表明该棉田前茬种植水稻对土壤中真菌的组成产生了较大影响(图3)。
2.3 真菌多样性、群落结构与土壤养分的相关性
相关性分析表明,土壤的pH以及全磷、全钾含量与真菌的辛普森指数的相关系数分别为0.7799、0.6209和0.8848,总盐与辛普森指数显著负相关,相关系数为-0.7604,但以上指标均与OTU数量、Chao1丰富度、Ace丰富度的相关性低。有机质、全氮量与真菌的OTU数量、Chao1丰富度、Ace丰富度呈显著正相关,但与辛普森指数相关性低(表3)。

图3 不同处理组间差异显著性分析

表3 土壤养分、pH及有机质与真菌多样性指数的相关性
冗余分析表明,土壤中的真菌种群主要与土壤养分明显相关,其中、、、、等与全盐量呈正相关,主要集中在第Ⅲ象限,、、、与含盐量成负相关,集中在第Ⅰ象限;而、、、、与土壤中有机质、全氮量呈正相关,集中在第Ⅳ象限,与之呈显著负相关(图4)。
3 讨论
病原菌侵染作物后,能使其根部发生组织结构变化的同时,也可改变其分泌物中某些成分及含量,根系分泌物是植物与土壤进行物质交换的载体,在调节植物与土壤微生物互作方面发挥着重要作用[18],当改变的根系分泌物扩散到土壤后,影响了作物根际的土壤环境,从而致使作物根际微生物数量及种类发生特定变化[19-20]。已有研究表明,棉花黄萎病发生能够引起其根际土壤中真菌的富集,土壤中真菌数量、致病真菌种类均明显增加[10-11],在粮食、蔬菜等作物上亦得出一致的结论[12-16]。本研究发现,阿克苏、石河子重病棉田发病棉花根围土中真菌的OTU数量、丰度在两个采样时期均高于无病田或轻病田中的健康棉株根围土,而真菌的多样性降低,其中阿克苏重病田与种植过水稻的对照棉田之间存在显著差异,该结果与前人研究基本一致。但是,棉田接种病原菌处理(KD)土壤中真菌的OUT数量、丰度与其对照相比虽无显著差异,却略低于对照,且AD、SD样品中真菌群落首先表现为空间趋向性,之后为时间趋向性,而库尔勒土壤样品则受采样时间因素影响更大,其次是空间因素,两方面结果均与阿克苏、石河子自然发病棉田数据不一致,反映了病原菌入侵短期内对土壤中真菌的丰度、多样性和组成影响有限,推测可能与接种年限或植物根际分泌物的影响范围有关,还需进一步验证。

含盐量Total salt content;全氮量 Total nitrogen content;有机质 Organic matter content
前人研究认为,土壤养分、pH、有机质等是影响土壤微生物群落结构的重要因素[21-22],Yu等[23]研究发现有机肥处理后土壤中细菌、放线菌的群落多样性、香农指数升高,氮肥处理后真菌水平升高。本研究发现不同分类水平真菌的组成存在差异,在门分类水平上,土壤中丰度高的真菌子囊菌门、担子菌门与Mortierellomycota在库尔勒人工接菌棉田与其对照之间以及石河子自然发病棉田与其对照之间的丰度差异较小,而在阿克苏重病田与其水稻轮作处理的对照之间丰度差异较大。在属分类水平上,不同区域土壤中除掷孢酵母属、被孢霉属和的丰度在重病田与对照田之间变化一致外,其余菌属在不同处理组内丰度无一致变化规律。作为验证病害发生对土壤中真菌影响程度的人工接菌土壤(KD、KCK),其在土壤真菌的丰度、多样性和组成的变化方面均与自然发病棉田处理组间无明显差异,因此认为发病程度可能对棉花根围土壤微生物群落结构的影响有限,为此,研究了土壤养分等指标与真菌的多样性以及群落结构的相关性。利用相关性和RDA分析表明,全氮、有机质、含盐量、全盐、pH等指标对土壤中真菌多样性、群落组成的影响显著,这与王巍巍等研究结果一致[24-26]。
棉花黄萎病防治困难,明确土壤中大丽轮枝菌的动态以及大丽轮枝菌入侵棉田与土壤中真菌群落的动态关系,对于利用微生态调控措施防控棉花黄萎病具有重要意义。前期研究发现,经水稻轮作棉田(ACK)不仅提高了土壤肥力,还消灭了土壤中的大丽轮枝菌,杜绝了病害发生;而棉田地力水平最高、连作达30年的重病棉田(SD)土壤中,大丽轮枝菌菌源数量却高达193个/g土[17]。本研究表明,在土壤中含有病原菌的前提下,不改变种植作物以及栽培模式,仅改善土壤肥力可能加重病害的发生。而通过不同作物间作、轮作和种植抗病品种等,利用不同作物根系分泌的化感物质持续对土壤中微生物群落结构进行调节,增加土壤中有益菌群数量,降低病原菌数量,在“农药、化肥”双减战略下可能是防控土传病害的有效手段。
4 结论
自然发病重棉田土壤中真菌的OTU数量、丰度均高于轻病或无病田,但多样性降低;而棉田内人工接种大丽轮枝菌短期内并未对土壤中真菌的丰度、多样性和群落结构造成明显影响。相关性分析表明,土壤中真菌的多样性、丰度和组成主要受有机质、全氮、含盐量等指标决定,且采样时期同样对土壤中真菌群落结构有明显影响。
[1] Bragazza L, Bardgett R D, Mitchell E A, Buttler A. Linking soil microbial communities to vascular plant abundance along a climate gradient., 2015, 205(3): 1175-1182.
[2] 李刚, 范宝莉, 文都日乐, 杨殿林. 呼伦贝尔针茅草原土壤真菌群落结构分析. 土壤学报, 2011, 48(5): 1096-1102.
Li G, Fan B L, WenDU R L, Yang D L. Analysis of soil fungal community structure ofsteppes in Hulunbuir, Inner Mongolia., 2011, 48(5): 1096-1102. (in Chinese)
[3] 李艳红. 真菌菌丝对土壤碳、肥力及结构组成影响的初步研究[D]. 哈尔滨: 东北林业大学, 2013.
Li Y H. Preliminary study of fungal hyphae impacts on soil carbon and fertility-related parameters, as well as structure and image of soil colloids[D]. Harbin: Northeast Forestry University, 2013. (in Chinese)
[4] 彭思利, 申鸿, 袁俊吉, 魏朝富, 郭涛. 丛枝菌根真菌对中性紫色土土壤团聚体特征的影响. 生态学报, 2011, 31(2): 498-505.
Peng S L, Shen H, Yuan J J, Wei C F, Guo T. Impacts of arbuscular mycorrhizal fungi on soil aggregation dynamics of neutral purple soil., 2011, 31(2): 498-505. (in Chinese)
[5] 钟思远, 张静, 褚国伟, 夏艳菊, 唐旭利. 沿海侵蚀台地不同恢复阶段土壤团聚体组成及其与丛枝菌根真菌的关系. 生态环境学报, 2017, 26(2): 219-226.
Zhong S Y, Zhang J, Chu G W, Xia Y J, Tang X L. Soil aggregate composition and its relationship with arbuscular mycorrhizal fungi in different restoration stages on severely eroded lands., 2017, 26(2): 219-226. (in Chinese)
[6] Nair A, Ngouajio M.Soil microbial biomass, functional microbial diversity, and nematode community structure as affected by cover crops and compost in an organic vegetable production system., 2012, 58: 45-55.
[7] Sall S N, Masse D, Ndour N Y B, Chotte J L. Does cropping modify the decomposition function and the diversity of the soil microbial community of tropical fallow soil?,2006, 31(3): 211-219.
[8] DUNHAM S M, LARSSON K H, SPATAFORA J W. Species richness and community composition of mat-forming ectomycorrhizal fungi in old- and second-growth Douglas-fir forests of the HJ Andrews Experimental Forest, Oregon, USA., 2007, 17(8): 633-645.
[9] Bai G, Bao Y, Du G, Qi Y. Arbuscular mycorrhizal fungi associated with vegetation and soil parameters under rest grazing management in a desert steppe ecosystem., 2013, 23(4): 289-301.
[10] 顾美英, 徐万里, 茆军, 梁智, 宋素琴, 霍向东. 新疆棉花黄萎病发病株根际土壤微生物生态特征. 西北农业学报, 2009,18(2): 276-279.
Gu M Y, Xu W L, Mao J, Liang Z, Song S Q, Huo X D. Rhizosphere soil microbial ecological characteristics of infected cotton plants bywilt in Xinjiang., 2009, 18(2): 276-279. (in Chinese)
[11] Luan F G, Wang L, Liu Y N, LOU Y Y, ZHANG H Y, Zhang L L. Analysis of culturable fungal diversity in rhizosphere soil of healthy and diseased cotton in Southern Xinjiang., 2012, 6(47): 7357-7364.
[12] 邓晓, 李勤奋, 侯宪文, 洪葵. 香蕉枯萎病区土壤可培养微生物生态特征. 热带作物学报, 2011, 32(2): 283-288.
Deng X, Li Q F, Hou X W, Hong K. The ecological characteristics of culturable microbes isolated from infected soil bywilt of banana., 2011, 32(2): 283-288. (in Chinese)
[13] 王玲娜, 薛泉宏, 唐明, 申光辉, 赵娟, 段春梅, 陈秦, 薛磊, 毛宁. 内蒙古芹菜根腐病病株和健株根域土壤的微生物生态研究. 西北农林科技大学学报(自然科学版), 2010, 38(8): 167-172.
Wang L N, Xue Q H, Tang M, Shen G H, Zhao J, Duan C M, Chen Q, Xue L, Mao N. Microbial ecological study about the root-zone soil of the healthy and diseased celery plant in Inner Mongolia.(), 2010, 38(8): 167-172. (in Chinese)
[14] 李雪萍, 李建宏, 漆永红, 郭炜, 李潇, 李敏权. 青稞根腐病对根际土壤微生物及酶活性的影响. 生态学报, 2017, 37(17): 5640-5649.
Li X P, Li J H, Qi Y H, Guo W, Li X, Li M Q. Effects of naked barley root rot on rhizosphere soil microorganisms and enzyme activity., 2017, 37(17): 5640-5649. (in Chinese)
[15] 官会林, 杨建忠, 陈煜君, 崔秀明, 王勇, 张云峰. 三七设施栽培根际微生物菌群变化及其与三七根腐病的相关性研究. 土壤, 2010, 42(3): 378-384.
GUAN H L, YANG J Z, CHEN Y J, CUI X M, WANG Y, ZHANG Y F. Change of rhizospheric microbe colony in cultivated soil and its correlation to root rot disease in., 2010, 42(3): 378-384. (in Chinese)
[16] 吴斌, 姜珊珊, 张眉, 辛志梅, 徐德坤, 王升吉, 辛相启. 小麦黄花叶病毒病不同发生度土壤的微生物多样性研究. 山东农业科学, 2017, 49(12): 44-49.
WU B, JIANG S S, ZHANG M, XIN Z M, XU D K, WANG S J, XIN X Q. Study on microbial diversity of soil in different disease degree regions with., 2017, 49(12): 44-49. ( in Chinese)
[17] 刘海洋, 姚举, 张仁福, 王伟, 余璇, 王琦. 黄萎病不同发生程度棉田中土壤微生物多样性. 生态学报, 2018, 38(5): 1619-1629.
Liu H Y, Yao J, Zhang R F, Wang W, Yu X, Wang Q. Analysis of soil microbial diversity in cotton fields differing in occurrence of cottonwilt in Xinjiang., 2018, 38(5): 1619-1629. (in Chinese)
[18] 吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望. 植物生态学报, 2014, 38(3): 298-310.
Wu L K, Lin X M, Lin W X. Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates., 2014, 38(3): 298-310. (in Chinese)
[19] 苗则彦, 赵奎华, 刘长远, 梁春浩, 林凤. 健康与罹病黄瓜根际微生物数量及真菌区系研究. 中国生态农业学报, 2004, 12(3): 156-157.
Miao Z Y, Zhao K H, Liu C Y, LianG C H, Lin F. Rhizosphere microorganism quantity and fungal flora of healthy and infected cucumber plants by., 2004, 12(3): 156-157. (in Chinese)
[20] 韩雪, 吴凤芝, 潘凯. 根系分泌物与土传病害关系之研究综述. 中国农学通报, 2006, 22(2): 316-318.
Han X, Wu F Z, Pan K. Review on the relation between the root exudates and soil-spread disease., 2006, 22(2): 316-318. (in Chinese)
[21] 王伟华, 刘毅, 唐海明, 孙志龙, 李宝珍, 葛体达, 吴金水. 长期施肥对稻田土壤微生物量、群落结构和活性的影响. 环境科学, 2018, 39(1): 430-437.
Wang W H, Liu Y, Tang H M, Sun Z L, Li B Z, Ge T D, Wu J S. Effects of long-term fertilization regimes on microbial biomass, community structure and activity in a paddy soil., 2018, 39(1): 430-437. (in Chinese)
[22] 任凤玲, 张旭博, 孙楠, 徐明岗, 柳开楼. 施用有机肥对中国农田土壤微生物量影响的整合分析. 中国农业科学, 2018, 51(1): 119-128.
Ren F L, Zhang X B, Sun N, Xu M G, Liu K L. A meta-analysis of manure application impact on soil microbial biomass across China’s croplands., 2018, 51(1): 119-128. (in Chinese)
[23] Yu C, Hu X M, Deng W, Li Y, Xiong C, Ye C H, Han G M, Li X. Changes in soil microbial community structure and functional diversity in the rhizosphere surrounding mulberry subjected to long-term fertilization., 2015, 86: 30-40.
[24] 王巍巍, 赵琼, 赵欣然, 曾德慧, 艾桂艳. 凋落物管理对樟子松人工林土壤微生物群落结构的影响. 生态学杂志, 2015, 34(9): 2605-2612.
Wang W W, Zhao Q, Zhao X R, Zeng D H, Ai G Y. Effects of litter manipulation on soil microbial community structure in avar.plantation., 2015, 34(9): 2605-2612. (in Chinese)
[25] 郭芸, 孙本华, 王颖, 魏静, 高明霞, 张树兰, 杨学云. 长期施用不同肥料土PLFA指纹特征. 中国农业科学, 2017, 50(1): 94-103.
Guo Y, Sun B H, Wang Y, Wei J, Gao M X, Zhang S L, Yang X Y. PLFA fingerprint characteristics of an anthropogenic loess soil under long-term different fertilizations., 2017, 50(1): 94-103. (in Chinese)
[26] 岳琳艳, 郑俊强, 韩士杰, 杨建华, 耿世聪, 陈志杰, 张雪, 谷越. 长白山温带森林不同演替阶段土壤化学性质及微生物群落结构的变化. 生态学杂志, 2015, 34(9): 2590-2597.
Yue L Y, Zheng J Q, Han S J, Yang J H, Geng S C, Chen Z J, Zhang X, Gu Y. Soil chemical properties and microbial community structure at different succession stages of temperate forest in Changbai Mountains., 2015, 34(9): 2590-2597. (in Chinese)
Fungal Community Structure of Cotton-Field soil under different incidences of CottonWilt
LIU HaiYang1, WANG Wei1, ZHANG RenFu1, Raxida·Abdurahman2, YAO Ju1
(1Institute of Plant Protection, Xinjiang Academy of Agricultural Sciences/Key Laboratory of Integrated Pest Management on Crops in Northwestern Oasis, Ministry of Agriculture,Urumqi 830091;2Agricultural Technology Extension Station of Yining County, Yining 835000, Xinjiang)
【Objective】Fungus is an important part of soil microbial system, which can obviously indicate the change of soil environment. The objective of this study is to analyze the characteristics of fungal communities in cotton-field soil with different incidences ofwilt, determine the effect ofon the diversity and community structures of fungi in cotton fields, and to reveal the ecological function of fungi community in soil during the occurrence ofwilt.【Method】Cotton fields with different incidences ofwilt in Aksu and Shihezi, and artificially inoculated cotton field in Korla were chosen as research objects. Six soil samples collected from serious diseased fields in Aksu (AD), Korla (KD), Shihezi (SD) and their controls were tested, respectively. Illumina Hiseq high-throughput sequencing technique was used to study the diversity and community structure of fungi in soil. The correlation between fungal community structure and soil nutrients was clarified with redundancy analysis (RDA).【Result】At the similarity level of 97%, the OTU number, Chao1 and Ace richness index of fungi in AD and SD samples were higher than those of ACK and SCK samples, while the simpson index was lower than that of control. There was no significant difference in OTU number,Chao1 and Ace richness index and Simpson index between artificially inoculated KD and control KCK samples.NMDS analysis showed that the soil samples of AD and SD had spatial tendency first and then temporal tendency, while the soil samples in Korla had temporal tendency first and then spatial tendency. In terms of community composition, at the phylum level, the abundance of Ascomycota in soil was dominant, followed by Basidiomycota and Mortierellomycota.The abundance differences of the three phylum groups between KD and KCK samples and between SD and SCK samples were relatively small, while those between AD and ACK samples were relatively larger. At the genus level,had the highest abundance, and the abundances of bothandwere higher than those of the control in the soils of seriously diseased field in different regions, butwas lower than that of the control. In addition, the abundance of,andin AD samples was lower than that of ACK samples, while the abundance of these three genera in SD samples was higher than that of SCK samples. The significant difference analysis among groups indicated that the significant difference markers in Korla and Shihezi soils were mainly concentrated in the seriously diseased fields, while in Aksu soils they were mainly concentrated in disease-free fields. Correlation and RDA analysis showed that soil organic matter and total nitrogen content were positively correlated with OTU number and abundance of fungi, but had low correlation with Simpson index. The pH, total phosphorus and total potassium were positively correlated with Simpson index, while total salt was negatively correlated with Simpson index.【Conclusion】The OTU number and abundance of fungi in the soil of natural seriously diseased cotton fields are higher than those in the control, but the diversity of fungi is low. In the short term, artificial inoculation does not have significant effects on the abundance, diversity and community structure of the fungi in the soil. The diversity, abundance and composition of fungi in soil are significantly affected by the indexes of organic matter, total nitrogen and salt content. The sampling period also has significant effects on the community structure of fungi in soil.
; cottonwilt;invasion; cotton-field soil; fungal community; high-throughput sequencing
10.3864/j.issn.0578-1752.2019.03.006
2018-08-07;
2018-11-16
国家重点研发计划(2017YFD0201106)、新疆维吾尔自治区公益性科研院所基本科研业务费(KY201807)
刘海洋,E-mail:xaaslhy@126.com。通信作者姚举,E-mail:yaoju500@sohu.com
(责任编辑 岳梅)
