60Co-γ射线对2种狼尾草属牧草的诱变效应
2019-02-20武炳超童磊杜昭昌胡家菱张欢陈燚刘伟张新全黄琳凯
武炳超,童磊,杜昭昌,胡家菱,张欢,陈燚,刘伟,张新全,黄琳凯
60Co-γ射线对2种狼尾草属牧草的诱变效应
武炳超,童磊,杜昭昌,胡家菱,张欢,陈燚,刘伟,张新全,黄琳凯
(四川农业大学草业科学系,成都 611130)
【目的】探究60Co-γ射线对“热研4号”杂交狼尾草及“华南”象草的诱变效应,创制新种质,以推动狼尾草的育种工作。【方法】在前期剂量筛选基础之上,以2种狼尾草品种(“热研4号”杂交狼尾草和“华南”象草)种茎为材料,利用60Co-γ射线进行辐射,剂量为30 Gy,剂量率为1 Gy·min-1。将辐射后的种茎与未辐射的种茎栽植于大田中,常规田间管理,1个月后统计成活率。待成活的植株生长成熟后,在2个诱变系群体中分别随机挑选30株进行形态指标的测定,共测定7个指标。随后利用分子标记探究辐射对遗传变异的影响。【结果】2个品种的辐射材料,分别随机选取30株进行形态指标测定,与对照相比,发现“热研4号”诱变系中有28株的株高,21株的茎节数及17株的叶宽有显著或极显著差异。“华南”诱变系中有20株的株高有显著或极显著差异,其他形态指标差异不大。2种牧草的突变体大都表现出株高的降低,因此,生物量也随之减少。还发现一个辐射材料RY4-17,由于分蘖数多于对照导致生物量增加。SSR分子标记研究结果表明,在“热研4号”诱变系中,20对引物的平均多态信息含量为0.245,共扩增出83条带,其中多态性条带52条,诱变系与对照之间的遗传相似系数为0.67—0.89,平均值为0.81,差异位点数为9—27,平均为15.9个,UPGMA聚类结果显示突变体RY4-9和RY4-23与对照遗传距离最远,变异程度最大。在“华南”诱变系中,20对引物的平均多态信息含量为0.394,共扩增出81条带,其中多态性条带65条,诱变系与对照之间的遗传相似系数为0.54—0.86,平均值为0.77,差异位点数为10—38,平均为18.8个,UPGMA聚类结果显示突变体HN-24与对照遗传距离最远,变异程度最大。【结论】适宜剂量的60Go-γ射线辐射可以使2种牧草种茎成活率显著降低,同时可以有效诱导2种牧草在形态学和遗传学水平上发生变异。60Go-γ射线辐射诱变是解决狼尾草因无性繁殖为主而导致遗传资源多样性匮乏的有效途径。
狼尾草;60Co-γ射线;表型变异;遗传变异;SSR分子标记
0 引言
【研究意义】狼尾草属(Rich)属于禾本科(Poaceae)黍亚科(Panicoideae A. Br.)的一年生或多年生草本植物,全球约140种,多数原产于非洲[1]。其中杂交狼尾草(×)是以二倍体美洲狼尾草()和四倍体象草()杂交产生的三倍体杂交种,生产上多采用无性繁殖或者杂交一代的种子繁殖[2-3]。杂交狼尾草生产速度快,产量高,氨基酸含量比较平衡,并且耐旱,抗倒伏,极少有病虫害发生,是一种喂养畜禽的优质饲料[4]。象草是一种茎秆粗高、含糖量大、粗蛋白和无氮浸出物含量高的优质牧草[5],通常调制成干草或作为青刈饲料、青贮料喂养家畜[6]。20世纪90年代美国研究发现象草可作为能源植物生产乙醇、沼气和电能[7-10],也有人将象草看作一种保护生态和美化环境的植物[11-12]。关于狼尾草属牧草的育种研究工作,美国一直处于领先地位,而中国目前国审象草品种只有6个,其中4个为引进品种,而国审杂交狼尾草品种仅有3个,品种资源的极度匮乏大大阻碍了这两种狼尾草属牧草的利用。象草具有不能形成花粉或雌蕊发育不良的缺点,通常不结实或结实率低,种子活性低,因此,生产上多用象草种茎繁殖后代[13-14]。而杂交狼尾草由于无法产生种子,生产上需要年年制种或利用种茎无性繁殖。这种以无性繁殖为主的繁殖方式大大降低了种质遗传资源多样性,给2种牧草的育种工作带来困难。【前人研究进展】辐射诱变作为一种有效地增加遗传多样性的手段,已被证明造成的变异是可以稳定遗传的[15],该方法已被广泛应用于农作物新品种选育上,但是在牧草上的应用起步较晚。2011年,福建农作物品种审定委员会审定通过了“闽牧6号”品种,该品种是通过辐射杂交狼尾草种子和田间双重筛选选育的狼尾草新品种[16]。除此之外,多数牧草的辐射诱变研究都停留在比较基础的阶段,刘天增等[17]利用60Co-γ射线辐射海滨雀稗()的种茎,初步选育出9个在形态指标上均不同程度优于对照的突变体材料。翁伯琦等[18]通过60Co-γ射线对决明属(spp.)牧草辐射后代的研究发现3个突变体的生物量都比原种有所增加,氨基酸营养成分也呈现出较大的变化。而60Co-γ射线对狼尾草种茎的诱变效应的研究还未见报道。【本研究切入点】目前,分子标记已成为植物遗传多样性鉴定的重要工具。其中SSR(simple sequence repeats)分子标记作为一种共显性标记,因其稳定性好、多态性高等优点,广泛用于群体遗传结构分析和遗传多样性的研究[19-21]。目前,对于狼尾草茎秆适宜辐射剂量以及所产生的诱变效应仍未探明,阻碍了该类牧草辐射诱变育种的工作进程。【拟解决的关键问题】本研究通过对2种狼尾草属牧草种茎进行大量辐射,随后对成熟突变体植株进行形态学测定,并利用SSR标记检测诱变系与对照植株分子水平上的差异,以期探究60Co-γ射线对2种狼尾草属牧草的诱变效应,创制优异新种质。
1 材料与方法
1.1 试验材料
试验材料为种植在四川农业大学崇州实验基地狼尾草种质资源圃中的“热研4号”杂交狼尾草(品种登记号:196)和“华南”象草(品种登记号:066)。种质资源来自于热带农业科学院牧草种质基因库,均为同一无性系扩繁,保证遗传背景一致。挑选成熟健康、长势相近的植株割取种茎,以含有2—3个茎节为标准。
1.2 60Co-γ射线辐射诱变
2017年4月,将割取的种茎送往四川省农业科学院辐射中心,运送过程中保持种茎湿润,减少种茎离体脱水受到的损伤。选用剂量为30 Gy的60Co-γ射线对种茎进行辐射,剂量率为1 Gy·min-1[22]。“热研4号”辐射406根种茎,28根未经辐射处理的茎节作为对照;“华南”辐射390根种茎,34根未经辐射处理的茎节作为对照。将辐射后的种茎种植于四川农业大学崇州实验基地,茎秆斜插入土壤,以土壤埋没一个茎节为标准,株距1 m,行距1 m,采用常规大田管理措施,1个月后统计成活率。
1.3 形态指标测定
等待存活的植株生长成熟后,对2种狼尾草属牧草群体中各自随机挑选30株突变体和3株对照进行编号(表1和表2)和7种形态指标测定,包括分蘖数、株高、茎节数、茎粗、叶宽、叶长和生物量。其中,叶宽与叶长2项指标均选取从下至上倒数第2片叶子进行测量,叶宽以叶片最宽处的测量数据为准。除分蘖数和生物量以外,其余指标均重复测量10次,分蘖数不足10个的植株,则以最大可测量指标数为准。
1.4 SSR分子标记
1.4.1 DNA提取 在测定形态指标的66个单株上选取生长良好的叶片,使用天根植物基因组DNA提取试剂盒提取DNA,并经0.8%琼脂糖凝胶电泳检测其质量,通过核酸蛋白质检测仪检测其纯度和浓度,-20℃保存备用。使用时用TE将浓度稀释至20 ng·μL-1,4℃保存。
1.4.2 引物筛选 2种材料单独筛选引物,各自随机挑选5个突变体和1个对照材料用于筛选引物,70对引物由WANG等[23]象草Survey测序开发,引物合成交由上海生工生物工程技术服务有限公司完成。将扩增后条带清晰且突变体与对照之间存在差异的多态性引物用于后续研究。
1.4.3 PCR扩增及电泳 PCR反应体系为20 ng·μL-1,DNA 1.5 μL、Taq酶0.3 μL、Master Mix 7.5 μL、10 pmol·μL-1上游引物和下游引物各0.6 μL和ddH2O 4.5 μL。PCR反应程序为94℃5 min;94℃30 s,58℃45 s,72℃1 min,35个循环;72℃7 min,4℃保存。产物用8%非变性聚丙烯酰胺凝胶电泳检测,染色。
1.4.4 数据统计与分析 使用Microsoft Excel 2016软件处理66个单株的形态指标数据,并绘制相关图表,采用SPSS 19.0软件进行方差分析。对电泳得到的胶片进行标准化处理,即在相同迁移位置,对稳定且清晰的条带进行统计,有带记为“1”,无带记为“0”,建立原始矩阵。根据统计结果,利用Microsoft Excel 2016统计SSR扩增产物的条带总数(total number of bands,TNB)和多态性条带数(number of polymorphic bands,NPB),并计算多态性条带比率(percentage of polymorphic bands,PPB)和引物的多态信息含量(polymorphism information content,PIC)。利用NTSYSpc2.1(Version2.10s)软件计算遗传相似系数(genetic similarity coefficient,GSC)并绘制UPGMA(unweighted pair-group method with arithmetic means)聚类图。
2 结果
2.1 辐射后种茎成活率分析
796根种茎经过30 Gy的60Co-γ射线辐射后,共获得239株存活的植株,其中“热研4号”的存活数为114株,成活率为28.01%,对照的存活数为22株,成活率为78.57%;“华南”的存活数为125株,成活率为32.05%,对照的存活数为29株,成活率为85.29%。
2.2 2个诱变系群体的表型变异
2.2.1“热研4号”突变体表型的鉴定 随机挑选30株经诱变存活的“热研4号”进行形态测定,与对照相比,30株突变体植株均至少有一项形态指标存在显著或极显著差异(表1)。其中28株的株高、21株的茎节数以及17株的叶宽存在显著或极显著差异,分别占总数的93.3%、70%和56.7%。而叶长和茎粗分别有4株和9株呈显著或极显著差异,仅占总数的13.3%和30%。经分析发现,与对照相比,多数突变体的株高、茎节数呈不同程度的降低或减少,可能造成大部分突变体生物量降低。

表1 “热研4号”杂交狼尾草突变体形态指标
*代表在0.05水平差异显著;**代表在0.01水平差异极显著。下同
* and ** indicate significant differences at 0.05 and 0.01 levels, respectively. The same as below
2.2.2 “华南”突变体表型的鉴定 随机挑选30株经诱变存活的“华南”进行形态测定,与对照相比,有28株至少有一项形态指标存在显著或极显著差异(表2)。其中有20株株高存在显著或极显著差异,占66.7%,而茎节数、茎粗、叶长与叶宽等指标存在显著或极显著差异的植株数分别为2、7、7和11株,占总数的6.7%、23.3%、23.3%和36.7%。经分析发现,与对照相比,多数突变体株高呈不同程度降低,而其他形态指标差异不大。其中HN-12、HN-13和HN-23 3个突变体的各项形态指标均比对照高,生物量也高于对照。
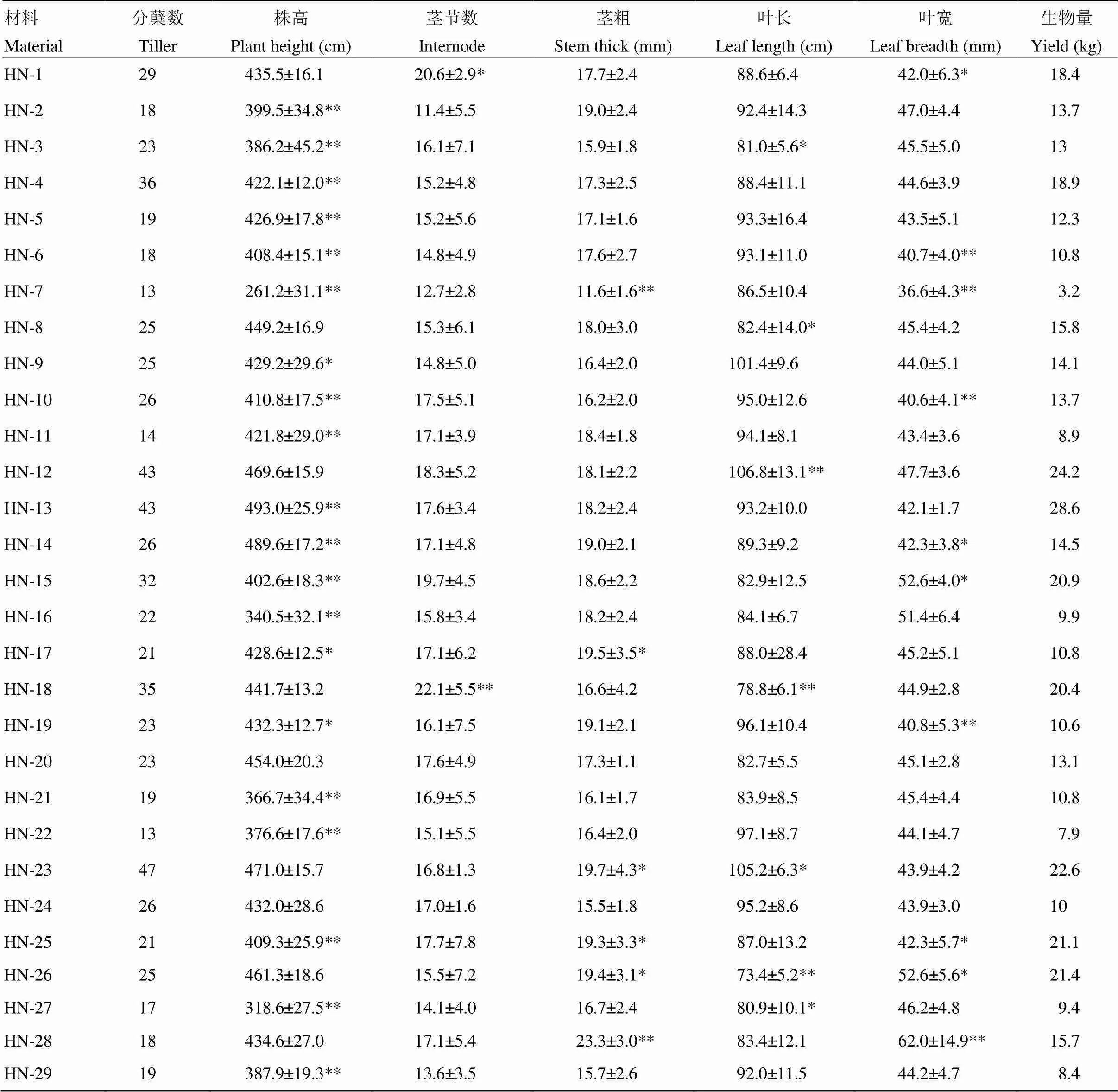
表2 “华南”象草诱变系形态指标
2.3 SSR分子标记
2.3.1 SSR引物多态性 2种狼尾草属牧草单独筛选引物,其中“热研4号”筛选出的20对引物,共扩增出83条清晰稳定的条带,其中多态性条带52条,占比62.7%。每一对引物扩增出2—8条条带,平均扩增4.2条,扩增多态性条带为0—6条,平均扩增2.6条。多态信息含量(PIC)为0—0.76,平均为0.245,其中引物SSR43的PIC最大,SSR24、SSR53和SSR70的PIC最小(表3)。“华南”筛选出的20对引物共扩增出81条清晰稳定的条带(图1),其中多态性条带65条,占比80.2%。每一对引物扩增出2—8条带,平均扩增4.1条,多态性条带2—7条,平均扩增3.3条。PIC为0.04—0.76,平均为0.394,其中引物SSR53的PIC最大,而SSR66的PIC最小(表4)。其中SSR19、SSR24、SSR43、SSR47、SSR50、SSR53、SSR54、SSR55和SSR59共9对引物在2种狼尾草属牧草中均可以扩增出清晰条带。

表4 “华南” 20对SSR引物序列及其扩增结果
2.3.2 遗传相似性分析 通过计算2种狼尾草属牧草诱变系与其对照之间的遗传相似系数(表5),发现“热研4号”诱变系材料与对照之间的遗传相似系数为0.67—0.89,平均值为0.81。“华南”诱变系材料与对照之间的遗传相似系数为0.54—0.86,平均值为0.77。2种牧草诱变系中,突变体RY4-9和HN-24与各自对照的遗传相似系数最小,说明它们与对照的遗传差异最大,而突变体RY4-20和HN-27与各自对照的遗传相似系数最大,说明它们变异程度最小。
2.3.3 SSR标记位点差异分析 根据扩增条带,统计2种诱变系群体与对照之间的差异位点数(表6)。“热研4号”诱变系与对照的差异位点数为9—27,平均15.9个,其中突变体RY4-9的差异位点数最多,为27个,差异位点百分率为32.5%,说明该突变体与对照间的遗传差异最大。“华南”诱变系与对照间的差异位点数为10—38,平均18.8个,其中突变体HN-24与对照间的遗传差异最大,差异位点数最多,为38个,差异位点百分率为46.9%。以上结果与遗传相似性分析的结果一致。

表5 诱变系与对照材料间的遗传相似系数
2.3.4 UPGMA聚类分析 通过对2种狼尾草属牧草诱变系进行非加权平均法(UPGMA)聚类分析(图2),发现“热研4号”突变体RY4-9和RY4-23与对照遗传距离最远,在遗传相似系数为0.72时与其他材料分开,聚为两类,说明其变异程度最大。“华南”突变体HN-24与对照遗传距离最远,在遗传相似系数为0.53时,单独聚为一类,是变异程度最大的突变体。

表6 对照材料与诱变系间的SSR标记位点差异
3 讨论
3.1 60Co-γ射线对2种狼尾草属牧草种茎成活率的影响
近年来,利用γ射线辐射牧草的研究多集中于小型禾本科或豆科牧草[24]。本研究中2种狼尾草属牧草均属于高大型禾本科牧草,考虑到成本与效率,选择用茎秆作为辐射材料。前人研究发现辐射剂量过小,可以保证植株成活率,但诱变效率低,辐射剂量过大又会导致较高的死亡率,所以确定所选的辐射剂量是否接近临界剂量或半致死剂量显得尤为重要[25]。本试验基于前期研究工作选用30 Gy的60Co-γ射线对406根“热研4号”王草种茎和390根“华南”象草种茎进行辐射,2种牧草辐射后代成活率分别为28.01%和32.05%,各自对照的成活率分别为78.57%和85.29%,该结果相较之前的研究结果有所下降,但仍然接近于临界剂量。分析原因可能是本次辐射的材料数量规模较大,在运输过程中增加了茎秆受到其他外源伤害的可能性,从而使成活率有所降低。

M:Marker;CK:对照;1—30:“华南”象草诱变系材料
3.2 60Co-γ射线对2种狼尾草属牧草表型的影响
通过分析2种牧草形态变异,发现“热研4号”诱变系中超过半数的突变体在株高、茎节数和叶宽3项形态指标上与对照材料有显著或极显著差异,而叶长和茎粗变化相对较小。其中突变体RY4-17有31个分蘖,远远高于对照,虽然其株高、茎节数和叶宽比对照降低,但是生物量略高于对照,该植株可能朝着矮小多分蘖型方向变异;“华南”象草诱变系中,多数突变体的株高与对照间差异较大,而其他形态指标差异不大,不过也有少数发生有益突变的植株,例如HN-12、HN-13和HN-23 3个突变体的各项形态指标均比对照高。研究得到的结果与前人研究结果基本一致,既辐射诱变会使生物产生大量的有害突变,例如植株矮小化和生物量降低[26]。宣继萍等[27]利用60Co-γ射线辐射狗牙根()后,发现狗牙根草层高度显著降低,同时还对狗牙根的叶宽、叶长及节间直径有显著影响。张彦芹等[28]利用60Co-γ射线辐射高羊茅()分化苗,得到叶片变细、变小的的突变体。此外,还发现“热研4号”杂交狼尾草与“华南”象草相比较,在植株表型上更容易发生突变,分析可能是因为2种牧草倍性不同导致对60Co-γ射线耐受性不同,四倍体对60Co-γ射线的耐受性强于三倍体,但该假设还需要通过进一步研究来验证。
3.3 60Co-γ射线对2种狼尾草属牧草分子遗传水平的影响
SSR标记作为一种共显性标记,具有重复性高、特异性强、多态性丰富和操作简单的特点,已经广泛用于品种鉴定,指纹图谱构建,亲缘关系鉴定等方面[29-32]。于立伟等[33]利用385对SRR标记对2个玉米()突变体和野生型进行变异分析,证明遗传差异真实存在。抗旱甜菜()突变体的鉴定也用到了这种技术[34]。本研究利用筛选出的SSR引物分别对2种牧草诱变系群体随机挑选的30株植株进行分子水平上的鉴定,发现“热研4号”诱变系与对照之间的遗传相似系数为0.67—0.89,差异位点数为9—27,而“华南”诱变系与对照之间的遗传相似系数为0.54—0.86,差异位点数为10—38。同时UPGMA聚类图表明2个诱变系群体与各自对照之间存在遗传距离,说明2种牧草在受到30 Gy的60Co-γ射线辐射后,在分子水平上均出现了不同程度的变异,并且推测这种变异多数是由于一些遗传片段的缺失导致的(图1)。
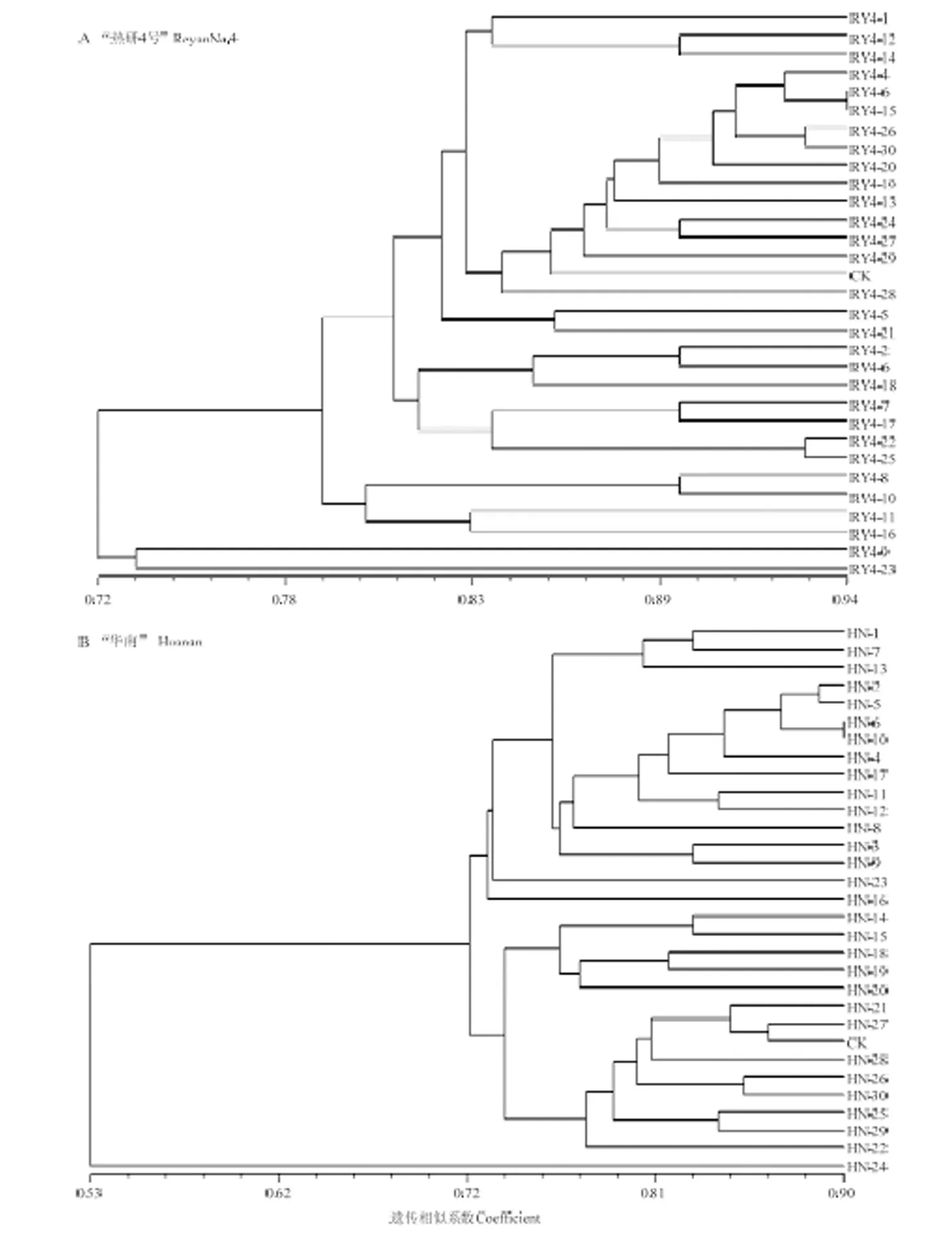
图2 诱变系的UPGMA聚类图
4 结论
受30 Gy60Co-γ射线辐射后,2种狼尾草种茎的成活率大大降低,但同时有效诱导2种狼尾草在形态学和遗传学水平上产生变异。对于以无性繁殖为主而导致遗传资源多样性匮乏的狼尾草而言,使用适宜剂量的60Co-γ射线进行辐射诱变是解决这一问题的有效途径。
[1] 中国科学院中国植物志编辑委员会. 中国植物志. 北京: 科学出版社, 1990.
Reipublicae Popularis Sinicae.. Beijing: Science Press, 1990. (in Chinese)
[2] 郑安俭, 杨地龙, 叶晓青, 顾和平. 杂交狼尾草高产栽培技术. 种子世界, 2003(3): 31.
ZHENG A J, YANG D L, YE X Q, GU H PHigh-yielding cultivation technique of hybrid., 2003(3): 31. (in Chinese)
[3] 刘国道, 白昌军, 王东劲, 易克贤, 韦家少, 何华玄, 周家锁. 热研4号王草选育. 草地学报, 2002, 10(2): 92-96.
LIU G D, BAI C J, WANG D J, YI K X, WEI J S, HE H X, ZHOU J S. The selection and utilization of reyan No.4 king grass., 2002, 10(2): 92-96. (in Chinese)
[4] 陆炳章, 许慰睽, 周春霖, 卞同洋. 杂交狼尾草在盐渍土区生长特性及其应用. 中国草地学报, 1990(2): 30-40.
LU B Z, XU W K, ZHOU C L, BIAN T Y. The growth characteristics and application ofhybrid in saline soil area., 1990(2): 30-40. (in Chinese)
[5] 李茂, 字学娟, 侯冠彧, 周汉林. 体外产气法评价5种热带禾本科牧草营养价值. 草地学报, 2013, 21(5): 1028-1032.
LI M, ZI X J, HOU G Y, ZHOU H L. Nutritional evaluation of five tropical gramineous forages., 2013, 21(5): 1028-1032. (in Chinese)
[6] 荣辉, 徐安凯, 下条雅敬, 邵涛. 初次刈割象草青贮发酵品质动态. 草地学报, 2009, 17(4): 537-539.
RONG H, XU A K, XIA T Y J, SHAO T. Changes in fermentation quality of napiergras harvested the first growth., 2009, 17(4): 537-539. (in Chinese)
[7] Jewell W J, Cummings R J, Richards B K. Methane fermentation of energy crops: maximum conversion kinetics and in situ biogas purification.. 1993, 5(3/4): 261-278.
[8] Stricker J A, Smith D W.. Golden, Colorado: National Renewable Energy Laboratory, 1995.
[9] Woodard K R, Prine G M, Bachrein S. Solar energy recovery by elephantgrass, energycane, and elephantmillet canopies., 1993, 33(4): 824-830.
[10] Schank S C, Chynoweth D P, Turick C E, MENDOZA P E. Napiergrass genotypes and plant parts for biomass energy., 1993, 4(1): 1-7.
[11] 温晓娜, 简有志, 解新明. 象草资源的综合开发利用. 草业科学, 2009, 26(9): 108-112.
WEN X N, JIAN Y Z, XIE X M. The comprehensive exploitation and utilization of., 2009, 26(9): 108-112. (in Chinese)
[12] 信金娜, 徐威, 王志英, 孙超, 张明磊. 狼尾草作为观赏草的应用. 草原与草坪, 2013(5): 90-93.
XIN J N, XU W, WANG Z Y, SUN C, ZHANG M L. Application ofas ornamental grass., 2013(5): 90-93. (in Chinese)
[13] 李有涵, 谢昭良, 解新明. 5个象草品种的构件生物量特征及分配动态. 草业学报, 2011, 20(5): 11-18.
LI Y H, XIE Z L, XIE X M. Characters and dynamics modular biomass and its allocation ratio in five cultivars of elephant grass., 2011, 20(5): 11-18. (in Chinese)
[14] 陈志彤, 何水林, 黄毅斌. 狼尾草属牧草研究进展. 草地学报, 2010, 18(5): 740-748.
CHEN Z T, HE S L, HUANG Y B. Research progress ofrich., 2010, 18(5): 740-748. (in Chinese)
[15] Datta S, Jankowicz Cieslak J, Nielen S, INGELBRECHT L, TILL B J. Induction and recovery of copy number variation in banana through gamma irradiation and low coverage whole genome sequencing., 2018, 16(9): 1644-1653.
[16] 陈钟佃, 黄勤楼, 黄秀声, 冯德庆, 钟珍梅. “闽牧6号”狼尾草的选育及田间种植技术. 家畜生态学报, 2012, 33(1): 53-55.
CHEN Z D, HUANG Q L, HUANG X S, FENG D Q, ZHONG Z M. Breeding and cultivation technology of., 2012, 33(1): 53-55. (in Chinese)
[17] 刘天增, 谢新春, 张巨明. 海滨雀稗60Co-γ辐射诱变突变体筛选. 草业学报, 2017, 26(7): 62-70.
LIU T Z, XIE X C, ZHANG J M. Mutagenic effect of60Co-γ irradiation on turf characteristics of., 2017, 26(7): 62-70. (in Chinese)
[18] 翁伯琦, 徐国忠, 郑向丽, 应朝阳, 黄毅斌. 决明属牧草60Co-γ射线辐射后代的若干特性研究. 中国农业科学, 2005, 38(12): 2566-2570.
WENG B Q, XU G Z, ZHENG X L, YING C Y, HUANG Y B. Study on several characters ofspp. irradiated by60Co-γ., 2005, 38(12): 2566-2570. (in Chinese)
[19] 王晋, 王世红, 赖勇, 孟亚雄, 李葆春, 马小乐, 尚勋武, 王化俊. 大麦SSR标记遗传多样性及群体遗传结构分析. 核农学报, 2014, 28(2): 177-185.
WANG J, WANG S H, LAI Y, MENG Y X, LI B C, MA X L, SHANG X W, WANG H J. Genetic diversity and population genetic structure analysis by using SSR markers in barley., 2014, 28(2): 177-185. (in Chinese)
[20] Yan H, Zhang Y, Zeng B, YIN G, ZHANG X, JI Y, HUANG L, JIANG X, LIU X, PENG Y, MA X, YAN Y. Genetic diversity and association of EST-SSR and SCoT markers with rust traits in orchardgrass (L.)., 2016, 21(1): 66.
[21] 秦家友, 石海春, 柯永培, 余学杰, 袁继超. 玉米辐射诱变系表型及SSR遗传差异研究. 玉米科学, 2012, 20(2): 41-47.
QIN J Y, SHI H C, KE Y P, YU X J, YUAN J C. Research on genetic difference of maize mutants by irradiation based on phenotypic and SSR., 2012, 20(2): 41-47. (in Chinese)
[22] 武炳超, 张欢, 童磊, 杜昭昌, 胡家菱, 陈燚, 张新全, 刘伟, 黄琳凯. 象草不同辐射剂量诱变系表型及遗传变异研究. 草业学报, 2018, 27(11): 77-86.
WU B C, ZHANG H, TONG L, DU Z C, HU J L, CHEN Y, ZHANG X Q, LIU W, HUANG L K. Research on genetic and phenotypic differences ofmutants generated by irradiation., 2018, 27(11): 77-86. (in Chinese)
[23] WANG C R, YAN H D, LI J, ZHOU S F, LIU T, ZHANG X Q, HUANG L K. Genome survey sequencing of purple elephant grass (Schum ‘Zise’) and identification of its SSR markers., 2018, 38(7): 94.
[24] 韩微波, 张月学, 唐凤兰, 刘杰淋, 刘凤歧, 陈积山, 尚晨, 杜优颖. 我国牧草诱变育种研究进展. 核农学报, 2010, 24(1): 62-66.
HAN W B, ZHANG Y X, TANG F L, LIU J L, LIU F Q, CHEN J S, SHANG C, DU Y Y. Research advances in pasture mutation breeding in China., 2010, 24(1): 62-66. (in Chinese)
[25] 谢向誉, 陆柳英, 曾文丹, 赖大欣, 严华兵.60Co-γ射线对木薯成熟种茎的诱变效应. 农学学报, 2014, 4(10): 28-31.
XIE X Y, LU L Y, ZENG W D, LAI D X, YAN H B. The mutagenic effects of60Co-γ on mature stakes of cassava., 2014, 4(10): 28-31. (in Chinese)
[26] 曾捷, 黄琳凯, 张新全, 张瑜, 张博涛, 张婧, 曹蔚, 刘欢, 严海东.60Co-γ辐射扁穗牛鞭草剂量筛选及表型变异研究. 草地学报, 2014, 22(4): 828-833.
ZENG J, HUANG L K, ZHANG X Q, ZHANG Y, ZHANG B T, ZHANG J, CAO W, LIU H, YAN H D. Study on phenotype mutation ofand dose selection of60Co-γ irradiation., 2014, 22(4): 828-833. (in Chinese)
[27] 宣继萍, 郭爱桂, 刘建秀, 周久亚, 郭海林, 车胜利, 朱雪花, 高鹤. 狗牙根辐射诱变后代外部性状变异分析. 草业学报, 2005, 14(6): 107-111.
XUAN J P, GUO A G, LIU J X, ZHOU J Y, GUO H L, CHE S L, ZHU X H, GAO H. Analysis on morphological variation of mutants ofinduced by radiation., 2005, 14(6): 107-111. (in Chinese)
[28] 张彦芹, 贾炜珑, 杨丽莉, 郭先龙, 吴锜, 胡鸢雷, 林忠平.60Co辐射高羊茅性状变异研究. 草业学报, 2005, 14(4): 65-71.
ZHANG Y Q, JIA W L, YANG L L, GUO X L, WU Q, HU Y L, LIN Z P. A Study on character mutation of60Co-γ-ray irradiation in., 2005, 14(4): 65-71. (in Chinese)
[29] 黄婷, 马啸, 张新全, 张新跃, 张瑞珍, 符开欣. 多花黑麦草DUS测定中 SSR 标记品种鉴定比较分析. 中国农业科学, 2015, 48(2): 381-389.
HUANG T, MA X, ZHANG X Q, ZHANG X Y, ZHANG R Z, FU K X.Comparation of SSR molecular markers analysis of annual ryegrass varieties in DUS testing., 2015, 48(2): 381-389. (in Chinese)
[30] 杨盛婷, 武炳超, 冯芹, 黄秀, 张新全, 凌瑶, 黄婷, 黄琳凯. 牛鞭草属DUS测试材料的SSR指纹图谱构建. 分子植物育种, 2017(5): 1790-1799.
YANG S T, WU B C, FENG Q, HUANG X, ZHANG X Q, LING Y, HUANG T, HUANG L K. Constructing SSR fingerprinting of DUS testing materials in., 2017(5): 1790-1799. (in Chinese)
[31] Morgante M, Hanafey M, Powell W. Microsatellites are preferentially associated with nonrepetitive DNA in plant genomes., 2002, 30(2): 194-200.
[32] 罗宗志, 林洁荣, 林志魁, 陈碧成, 梅兰, 林占熺. 热研4号王草和桂闽引象草的核型分析. 草业科学, 2016, 33(9): 1711-1717.
LUO Z Z, LIN J R, LIN Z K, CHEN B C, MEI L, LIN Z X.Karyotype analysis of×cv. Reyan No.4 andcv. Guiminyin., 2016, 33(9): 1711-1717. (in Chinese)
[33] 于立伟, 张林, 李静, 邸宏, 刘显君, 曾兴, 张德贵, 李新海, 王振华. 空间诱变玉米自交系齐319的SSR标记变异分析. 核农学报, 2014, 28(8): 1345-1352.
YU L W, ZHANG L, LI J, DI H, LIU X J, ZENG X, ZHANG D G, LI X H, WANG Z H. SSR analysis of mutants from maize ‘Qi319’ inbred lines induced by space mutagenesis., 2014, 28(8): 1345-1352. (in Chinese)
[34] Sen A, Alikamanoglu S. Analysis of drought-tolerant sugar beet (L.) mutants induced with gamma radiation using SDS-PAGE and ISSR markers., 2012, 738/739(1): 38-44.
Mutagenic Effects of60Co-γ-rays on Two Species ofGenus Forages
WU BingChao, TONG Lei, DU ZhaoChang, HU JiaLing, ZHANG Huan, CHEN Yi, LIU Wei, ZHANG XinQuan, Huang LinKai
(Department of Grassland Science, Sichuan Agricultural University, Chengdu 611130)
【Objective】 Exploring the mutagenic effects of60Co-γ-rays on×. cv. Reyan No.4 andSchum. cv. Huanan and creating new germplasm, which aims to promote the process ofbreeding. 【Method】 Based on the pre-dose screening, using stems of the two species ofas materials and irradiated by60Co-γ-rays and the dose was 30 Gy, the dose rate was 1 Gy·min-1. Then, the irradiated stems were planted in the field and conventional field cultivation management was performed. The survivor rate was counted one month later. After the plants to be survived mature, we randomly selected 30 individual plants from the two speciesand 7 morphological indicators of them were measured. Then, molecular markers were used to explore the effects of radiation on genetic variation. 【Result】30 individual plants of the two specieswere selected randomly to measure the morphological indicators, respectively. The heights of 28 mutants, internodes of 21 mutants and leaf breadth of 17 mutants of Reyan No.4 have significant differences at 0.05 or 0.01 levels with the control. The heights of 20 mutants of Huanan have significant differences at 0.05 or 0.01 levels with the control, but there were no significant differences in other morphological indicators with the control. Most of the two species ofmutants showed a decrease in plant height, and the biomass also decreased. However, we found that a mutant RY4-17 whose biomass is more than control because it has more tillers. The results of SSR molecular markers indicated that the average PIC of the 20 primers was 0.245 in the Reyan No.4 mutants, and a total of 83 bands were obtained, of which 52 bands were polymorphic. The GS between the mutants and the control was 0.67-0.89, the average was 0.81, the number of different sites was 9-27, with an average of 15.9. The UPGMA cluster showed that the distance between RY4-9, RY4-23 and control was the longest and indicated the mutation degree was greatest. In the Huanan mutants, the average PIC of the 20 primers was 0.394, a total of 81 bands were obtained, of which 65 bands were polymorphic. And the GS between the mutants and the control was 0.54-0.86, the average was 0.77, the number of different sites was 10-38, with an average of 18.8. The UPGMA cluster showed that the distance between HN-24 and control was the longest and indicated the mutation degree was greatest. 【Conclusion】 The appropriate dose of60Co-γ-rays radiation can significantly reduce the survival rate of the two species,and can effectively induce the mutations in the morphological and genetic. The method is an effective way to solve the lack of genetic resources caused by asexual reproduction of.
;60Co-γ-rays; phenotypic variation; genetic variation; SSR molecular markers
10.3864/j.issn.0578-1752.2019.03.003
2018-10-31;
2018-11-22
四川省育种攻关项目(2016NYZ0039)、国家农业产业体系四川饲草创新团队
武炳超,E-mail:wubingchao94@163.com。通信作者黄琳凯,E-mail:huanglinkai@sicau.edu.cn
(责任编辑 李莉)
