越橘VcNAC072克隆及其促进花青素积累的功能分析
2019-02-20宋杨刘红弟王海波张红军刘凤之
宋杨,刘红弟,王海波,张红军,刘凤之
越橘克隆及其促进花青素积累的功能分析
宋杨,刘红弟,王海波,张红军,刘凤之
(中国农业科学院果树研究所/农业部园艺作物种质资源利用重点实验室/辽宁省落叶果树矿质营养与肥料高效利用重点实验室,辽宁兴城 125100)
【目的】分离越橘(NAM,ATAF1/2,CUC2)转录因子,分析其表达模式并探讨其在调控花青素合成过程中的功能,为进一步研究越橘花青素积累的调控机理提供理论基础。【方法】以‘公爵’越橘(‘Duke’)为试材,克隆。通过农杆菌介导法获得转基因拟南芥,比较转基因和野生型拟南芥花青素积累的差异。利用酵母单杂交和瞬时表达试验,分析对MYB转录因子的转录调控。【结果】克隆获得越橘,该基因CDS为1 032 bp,编码含有343个氨基酸的蛋白质,含有1个保守的NAC结构域。表达分析显示,该基因在不同发育阶段的果实中均可表达,但表达差异明显,在粉色和蓝色果实中表达量较高,在绿色果实中表达量最低。随着表达的升高,果实中花青素含量呈递增的趋势。分析启动子序列,发现其序列中包含NAC转录因子的结合位点。酵母单杂交和烟草瞬时表达试验结果表明,VcNAC072可与的启动子相互作用,并激活其表达。在野生型拟南芥中异位表达,其种子中花青素积累量显著高于野生型。【结论】推测在越橘果实中正向调节花青素的积累。
越橘;NAC转录因子;花青素;表达分析;功能鉴定
0 引言
【研究意义】越橘亦称蓝莓,作为一种新兴的果树作物之一,近年来其栽培面积和产量稳步增长[1-2]。越橘果实中富含花青素、黄酮醇等次生代谢产物,在提高植物抗逆性和人体免疫力等方面具有一定作用[3-4]。通过分子生物学方法挖掘优异基因,阐释果实花青素积累的调控机理,对越橘新品种选育和品质改良具有重要意义。【前人研究进展】NAC(NAM,ATAF1/2,CUC2)转录因子是一类植物中特有的转录因子,其家族成员最显著的结构特征是其编码蛋白质的N端含有约150个氨基酸的NAC保守结构域。研究表明,NAC转录因子的生物学功能涉及广泛,包括生长发育[5]、信号转导[6]、非生物胁迫[7-8]和次生代谢产物合成[9-11]等方面。ODA-YAMAMIZO等[12]发现,拟南芥正调控叶绿素降解和叶片衰老,过量表达使植株表现早衰和叶绿素含量降低。TAKASAKI等[13]也发现,7个拟南芥NAC转录因子均表现受ABA诱导表达并调控叶片衰老。玉米Calcium/calmodulin-dependent protein kinase(CCaMK)可通过磷酸化ZmNAC84的丝氨酸位点,调控植株由ABA介导的抗氧化性[14]。在调控次生代谢物质积累方面,最近研究发现红肉桃可通过激活的表达促进果肉中花青素积累[15]。在苹果中也发现MdNAC029可通过激活的转录,促进愈伤组织中花青素合成[16]。研究表明,NAC蛋白可通过结合靶基因的CACG或GATTGGAT(AT)CA位点调控靶基因的表达,从而影响植物的抗性、衰老和次生代谢物质合成[7-8,16]。【本研究切入点】NAC转录因子的研究主要集中在水稻[17]和拟南芥[18]等模式植物。目前,越橘中NAC转录因子的研究尚无报道。【拟解决的关键问题】从‘公爵’越橘中分离并鉴定一个NAC转录因子,通过表达模式分析、转基因分析、酵母单杂交及瞬时表达试验,探讨在调控越橘花青素积累过程中的作用,为揭示NAC转录因子调控花青素积累提供理论基础。
1 材料与方法
试验于2016年6月—2018年7月在中国农业科学院果树研究所农业部园艺作物种质资源利用重点实验室和山东农业大学作物生物学国家重点实验室进行。
1.1 试验材料
试验所用的植物材料为8年生越橘品种‘公爵’(‘Duke’)、野生型拟南芥()和本氏烟草()。
1.2 基因克隆和序列分析
从越橘转录组数据库[19]查找NAC基因,并从中筛选发现高表达且在果实成熟过程中呈持续上调表达。根据筛选到的序列设计引物- F/R扩增CDS(coding domain sequence)序列。以越橘果实的cDNA为模板进行PCR扩增。PCR反应程序为:98℃预变性3 min;98℃变性10 s,57℃退火30 s,72℃延伸2 min,30个循环;72℃延伸10 min。PCR产物用1.2%琼脂糖凝胶电泳并回收目的条带,连接到克隆载体pEAST blunt zero进行测序。所用的引物序列见表1。
利用软件CLC Sequence Viewer 6(http://www. cacbio. com)分析VcNAC072蛋白的保守序列。利用软件Mega 6.0(http://www. megasoftware.net)引入拟南芥NAC蛋白(http://www.arabidopsis.org)对VcNAC072蛋白进行聚类分析。利用NCBI网站上的BLASTx程序进行同源序列比对。
1.3 总RNA提取与实时荧光定量PCR分析
总RNA提取采用TaKaRa公司的植物总RNA提取试剂盒(Code No.9769,Takara,Dalian,China)。以总RNA为模板,反转录合成cDNA。在越橘中,qRT-PCR内参基因为。在拟南芥中,以作为内参基因。仪器为Bio-Rad公司的CFX Connect PCR system,试剂为ThermoFisher公司的PowerUpTMSYBRGreen Master Mix(Code No.A25742,Thermo Fisher, China)。反应体系:SYBR Mixture 10.0μL,cDNA 2.0 μL,上、下游引物各0.5 μL,加去离子水至20 μL。PCR反应程序:95℃预变性2 min,95℃变性15 s,58℃退火15 s,72℃延伸1 min,40个循环,每次循环第2步进行荧光采集。最后采用2-ΔΔCT法分析定量数据。所有PCR都设3次重复。实时荧光定量PCR引物见表1。
1.4 基因转化拟南芥
构建pRI101-过量表达载体,并将其转化农杆菌GV3101,利用农杆菌侵染花序法转化野生型拟南芥。在含有卡那霉素的MS固体培养基上筛选T1代转基因植株。将抗性苗移栽至基质中并放入光照培养箱中进行培养,收获的T2代种子用于试验。载体构建时使用的引物见表1。
1.5 酵母单杂交试验(Y1H)
Y1H具体试验方法参照Clontech说明书,设计引物扩增的CDS序列,重组至pGADT7酵母表达载体,生成pGADT7-。扩增拟南芥中调控花青素合成的MYB转录因子的启动子序列,连接至pAbAi酵母表达载体,生成pAbAi-pro。将pAbAi-pro转化至酵母菌株Y1H Gold中,转化后涂布在氨基酸缺陷培养基SD/-Ura上,并筛选AbA(Aureobasidin A)浓度。再将pGADT7-转化至重组酵母菌株中,转化后涂布在含有AbA的氨基酸缺陷培养基SD/-Leu上进行互作筛选。
1.6 烟草瞬时表达试验
具体试验方法参照YIN等[20]和JEFFERSON等[21]。把(GenBank登录号:NM_104541)的启动子序列重组至pCAMBIA1301-GUS载体,生成pro-GUS,转化农杆菌GV3101,再与转化农杆菌的pRI101-共注射烟草叶片。使用荧光分光光度计测定GUS活性。
1.7 花青素含量测定
参照PERTUZATTI等[22]方法,利用高效液相色谱-质谱法对花青素总量进行测定。仪器为岛津LP- 10Avp液相色谱仪,SPD-M10Avp二极管阵列检测器。根据色谱峰面积计算花青素总量。
1.8 统计学分析
使用SPSS软件进行差异显著性分析。不同字母代表差异显著(<0.05)。
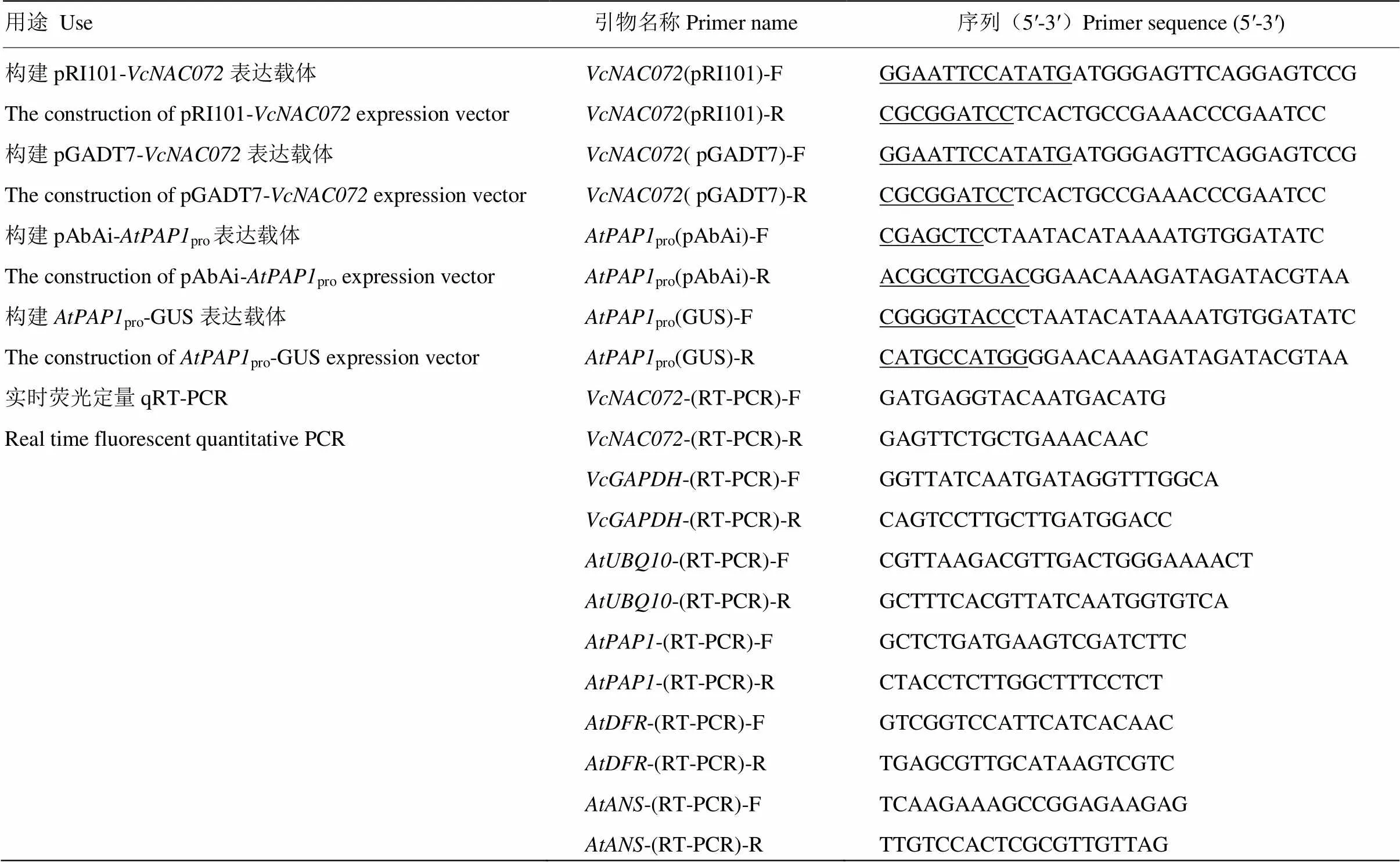
表1 本研究中使用的引物
下划线表示酶切位点Underlines indicate digestion sites
2 结果
2.1 VcNAC072的克隆、保守结构域和系统发生分析
通过RT-PCR技术获得1条大约1 000 bp的条带。对克隆所得片段测序分析,结果显示,的CDS长度为1 032 bp,编码含有343个氨基酸的蛋白质。使用CLC软件分析VcNAC072及其他植物NAC蛋白的保守结构域。结果表明,VcNAC072含有保守的NAC结构域(图1)。将VcNAC072蛋白序列与多个拟南芥NAC蛋白序列进行系统发生分析,以及NCBI序列比对分析发现,VcNAC072与拟南芥ANAC072同源性最高(图2)。因此将该基因命名为(GenBank登录号:MH784502)。
2.2 VcNAC072的表达
在果实不同发育时期,的相对表达量与花青素含量变化见图3。结果发现,在绿果中表达量最低,随着果实成熟,表达量持续升高,在蓝果中最大。总花青素含量变化趋势与的变化相似,这暗示的持续上调表达可能促进了花青素积累。
2.3 异位表达VcNAC072对花青素积累的影响
转基因株系(L1和L2)的种子中明显积累了花青素(图4-A),其花青素含量均显著高于野生型,分别为野生型的38.99倍和32.90倍(图4-B)。qRT-PCR检测花青素合成相关基因的表达,结果发现,过量表达显著促进了及花青素合成基因、的表达(图4-C)。
2.4 VcNAC072对AtPAP1启动子的调控
VcNAC072可与的启动子互作(图5)。为进一步研究VcNAC072对的调控方式,构建了pRI101-和pro-GUS载体,在烟草中瞬时表达。结果显示,共转VcNAC072和启动子的烟草叶片中,其GUS相对活性显著高于对照,为对照的3.57倍,说明VcNAC072可激活的表达(图6)。
3 讨论
目前,在拟南芥中已鉴定了117个NAC转录因子[18]。其中,在植物生长发育和胁迫方面发挥重要作用。例如,正调控植物叶绿素降解,促使叶片衰老[23-24]。被发现能够响应病原菌侵染[25]。还可正调控植物的干旱和高盐胁迫响应[26],但NAC072在调控花青素积累过程中的分子机理还不清楚。本研究利用前期转录组测序数据,从越橘中分离出1个编码NAC蛋白的转录因子,该基因在花青素含量最高的蓝果中表达量最高,并通过转基因试验验证了在野生型拟南芥中过量表达促进花青素积累。Li等[27]和SUN等[28]也利用转录测序技术,在越橘中挖掘出多个与果实中花青素积累紧密相关的花青素合成结构基因,如二氢黄酮醇-4-还原酶(Dihydroflavonol-4-Reductase,DFR)和花青素合成酶(Anthocyanin synthase,ANS)等。
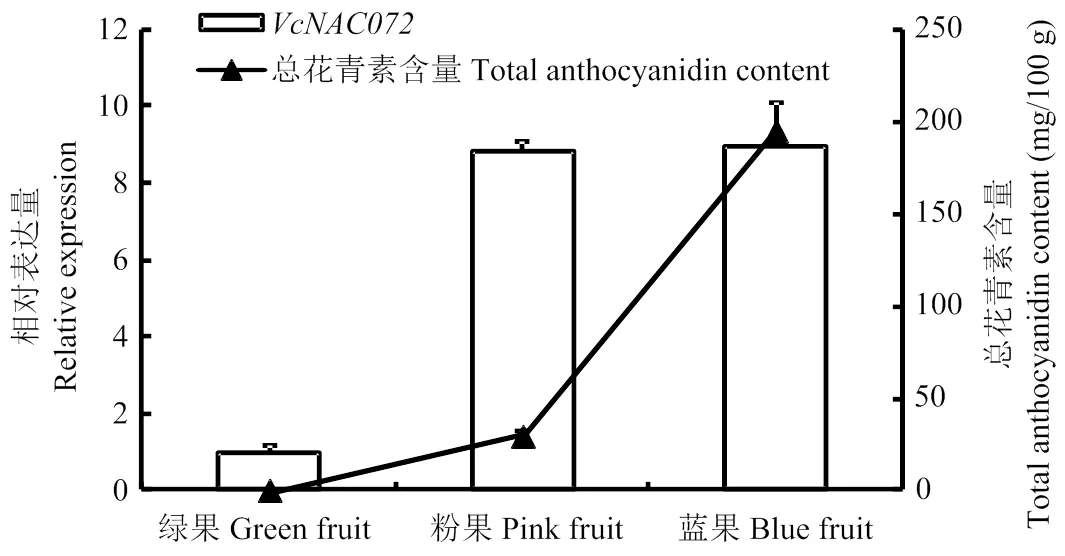
图3 果实发育不同阶段VcNAC072表达和花青素含量变化

A:转基因(L1和L2)和野生型(WT)拟南芥种子中花青素积累情况;B:转基因和野生型拟南芥种子中花青素含量;C:qRT-PCR检测花青素合成相关基因的表达,其在WT中的表达量设为1。不同小写字母表示差异显著(P<0.05)。下同

图5 酵母单杂交检测VcNAC072与AtPAP1启动子的相互作用

A:相对GUS活性。B:瞬时表达试验。a:共注射pRI101空载体和AtPAP1pro-GUS;b:共注射pRI101-VcNAC072和AtPAP1pro-GUS A: Quantitative analysis of relative GUS activity. B: Transient expression assay. a: pRI101 empty vector and AtPAP1pro-GUS. b: pRI101-VcNAC072 and AtPAP1pro-GUS
在拟南芥、苹果和梨等多种植物中,MYB转录因子在调节花青素合成过程中起关键作用。MYB可通过调控、等花青素合成结构基因的表达影响花青素合成[29-31]。JAAKOLA等[32]的研究也认为欧洲越橘MADS-box转录因子可直接或间接调控MYB转录因子的表达,进而调控、等基因的转录,从而影响幼嫩果实中种子和胎座中花青素的积累。
在本研究中,对转基因野生型拟南芥进行基因表达分析发现,异位表达可显著促进MYB转录因子及花青素合成结构基因的表达。NAC转录因子可通过与其靶基因上的CACG位点结合,调控靶基因的表达[33-34]。本研究通过Y1H技术验证了VcNAC072能够与包含CACG位点的启动子互作,并通过瞬时表达试验发现VcNAC072可激活的表达。后期将利用凝胶电泳迁移率试验(EMSA),进一步验证VcNAC072对启动子的结合。
4 结论
本研究克隆获得越橘NAC转录因子,该基因转化野生型拟南芥表现出促进花青素积累的表型。Y1H和瞬时表达试验表明VcNAC072可与MYB转录因子的启动子相结合并促进其表达。研究结果为揭示NAC转录因子调控花青素积累提供了参考。
[1] 李亚东, 孙海悦, 陈丽. 我国蓝莓产业发展报告. 中国果树, 2016(5): 1-10.
LI Y D, SUN H Y, CHEN L. Report on the development of blueberry industry in China., 2016(5): 1-10. (in Chinese)
[2] 吴林. 中国蓝莓35年—科学研究与产业发展. 吉林农业大学学报, 2016, 38(1): 1-11.
WU L. Thirty-five years of research and industry development of blueberry in China., 2016, 38(1): 1-11. (in Chinese)
[3] GORDILLO G, FANG H Q, KHANNA S, HARPER J, PHILIPS G, SEN C K. Oral administration of blueberry inhibits angiogenic tumor growth and enhances survival of mice with endothelial cell neoplasm., 2009, 11(1): 47-58.
[4] BASU A, RHONE M, LYONS T J. Berries: Emerging impact on cardiovascular health., 2010, 68(3): 168-177.
[5] SHAHNEJAT-BUSHEHRI S, TARKOWSKA D, SAKURABA Y, BALAZADEH S.NAC transcription factor JUB1 regulates GA/BR metabolism and signalling., 2016, 2: 16013.
[6] KIM H S, PARK B O, YOO J H, JUNG M S, LEE S M, HAN H J, KIM K E, KIM S H, LIM C O, YUN D J, LEE S Y, CHUNG W S. Identification of a calmodulin-binding NAC protein as a transcriptional repressor in., 2007, 282(50): 36292-36302.
[7] HONG Y B, ZHANG H J, HUANG L, LI D Y, SONG F M. Overexpression of a stress-responsive NAC transcription factor geneimproves drought and salt tolerance in rice., 2016, 7(e0116646): 4.
[8] YU X W, LIU Y M, WANG S, TAO Y, WANG Z K, MIJITI A, WANG Z, ZHANG H, MA H. A chickpea stress-responsive NAC transcription factor,, confers enhanced tolerance to drought stress in transgenic., 2016, 79(2): 187-197.
[9] KO J H, YANG S H, PARK A H, LEROUXEL O, HAN K H. ANAC012, a member of the plant-specific NAC transcription factor family, negatively regulates xylary fiber development in., 2007, 50(6): 1035-1048.
[10] ZHONG R, DEMURA T, YE Z H. SND1, a NAC domain transcription factor, is a key regulator of secondary wall synthesis in fibers of., 2006, 18(11): 3158-3170.
[11] YAMAGUCHI M, KUBO M, FUKUDA H, DEMURA T. Vascular-related NAC-domain7 is involved in the differentiation of all types of xylem vessels inroots and shoots., 2008, 55(4): 652-664.
[12] ODA-YAMAMIZO C, MITSUDA N, SAKAMOTO S, OGAWA D, OHME-TAKAGI M, OHMIYA A. ANAC046 is a positive regulator of chlorophyll degradation and senescence inleaves., 2016, 6: 23609.
[13] TAKASAKI H, MARUYAMA K, TAKAHASHI F, FUJITA M, YOSHIDA T, NAKASHIMA K, MYOUGA F, TOYOOKA K, YAMAGUCHI-SHINOZAKI K, SHINOZAKI K. SNAC-As, stress-responsive NAC transcription factors, mediate ABA-inducible leaf senescence., 2015, 84(6): 1114-1123.
[14] ZHU Y, YAN J W, LIU W J, LIU L, SHENG Y, SUN Y, LI Y Y, SCHELLER H, JIANG M Y, HOU X L, NI L, ZHANG A Y. Phosphorylation of a NAC transcription factor by a calcium/ calmodulin-dependent protein kinase regulates abscisic acid-induced antioxidant defense in maize., 2016, 171(3): 1651-1664.
[15] ZHOU H, WANG K L, WANG H L, GU C, DARE A, ESPLEY R, HE H P, ALLAN A, HAN Y P. Molecular genetics of blood-fleshed peach reveals activation of anthocyanin biosynthesis by NAC transcription factors., 2015, 82(1): 105-121.
[16] 安建平, 宋来庆, 赵玲玲, 由春香, 王小非, 郝玉金. 苹果愈伤组织超表达促进花青苷积累. 园艺学报, 2018, 45(5): 845-854.
AN J P, SONG L Q, ZHAO L L, YOU C X, WANG X F, HAO Y J. Overexpression ofpromotes anthocyanin accumulation in apple calli., 2018, 45(5): 845-854. (in Chinese)
[17] NURUZZAMAN M, MANIMEKALAI R, SHRRONI A M. Genome-wide analysis of NAC transcription factor family in rice., 2010, 465(1/2): 30-44.
[18] KIM S G, LEE S, SEO P J, KIM S K, KIM J K, PARK C M. Genome-scale screening and molecular characterization of membrane- bound transcription factors inand rice., 2010, 95(1): 56-65.
[19] SONG Y, LIU H D, ZHOU Q, ZHANG H J, ZHANG Z D, LI Y D, WANG H B, LIU F Z. High-throughput sequencing of highbush blueberry transcriptome and analysis of basic helix-loop-helix transcription factors., 2017, 16(3): 591-604.
[20] YIN X R, ALLAN A C, CHEN K S, FERGUSON I B. Kiwifruit EIL and ERF genes involved in regulating fruit ripening., 2010, 153(3): 1280-1292.
[21] JEFFERSON R A, KAVANAGH T A, BEVAN M W. GUS fusions:-glucuronidase as a sensitive and versatile gene fusion marker in higher plants., 1987, 6(13), 3901-3907.
[22] Pertuzatti P B, Barcia M T, Rebello L P G, Gómez- Alonso S, Duarte R M T, Duarte M C T, Godoy H T, Hermosín-Gutiérrez I. Antimicrobial activity and differentiation of anthocyanin profiles of rabbiteye and highbush blueberry using HPLC-DAD-ESI-MS and multivariate analysis., 2016, 26: 506-516.
[23] ZHU X Y, CHEN J Y, XIE Z K, GAO J, REN G D, GAO S, ZHOU X, KUAI B K. Jasmonic acid promotes degreening via MYB2/3/4- and ANAC019/055/072-mediated regulation of major chlorophyll catabolic genes., 2015, 84(3): 597-610.
[24] LI S, GAO J, YAO L Y, REN G D, ZHU X Y, GAO S, QIU K, ZHOU X, KUAI B K. The role of ANAC072 in the regulation of chlorophyll degradation during age- and dark- induced leaf senescence., 2016, 35(8): 1729-1741.
[25] HUANG J C, PIATER L A, DUBERY I A. The NAC transcription factor gene ANAC072 is differentially expressed inin response to microbe-associated molecular pattern (MAMP) molecules., 2012, 80(80): 19-27.
[26] TRAN L S, NAKASHIMA K, SAKUMA Y, SIMPSON S D, FUJITA Y, MARUYAMA K, FUJITA M, SEKI M, SHINOZAKI K, YAMAGUCHI-SHINOZAKI K. Isolation and functional analysis ofstress-inducible NAC transcription factors that bind to a drought-responsive cis-element in the early responsive to dehydration stress 1 promoter., 2004, 16(9): 2481-2498.
[27] LI X Y, SUN H Y, PEI J B, DONG Y Y, WANG F W, CHEN H, SUN Y P, WANG N, LI H Y, LI Y D.sequencing and comparative analysis of the blueberry transcriptome to discover putative genes related to antioxidant., 2012, 511(1): 54-61.
[28] SUN H Y, LIU Y S, GAI Y Z, GENG J M, CHEN L, LIU H D, KANG L M, TIAN Y W, LI Y D.sequencing and analysis of the cranberry fruit transcriptome to identify putative genes involved in flavonoid biosynthesis, transport and regulation., 2015, 16(1): 652.
[29] BOREVITZ J O, XIA Y J, BLOUNT J, DIXON R, LAMB C. Activation tagging identifies a conserved MYB regulator of phenylpropanoid biosynthesis., 2000, 12(12): 2383-2393.
[30] TAKOS A, JAFFÉ F, JACOB S, BOGS J, ROBINSON S, WALKER A. Light-induced expression of agene regulates anthocyanin biosynthesis in red apples., 2006, 142(3): 1216-1232.
[31] YAO G F, MING M L, ALLAN A, GU C, LI L T, WU X, WANG R Z, CHANG Y J, QI K J, ZHANG S L, WU J. Map-based cloning of the pear geneidentifies an interaction with other transcription factors to coordinately regulate fruit anthocyanin biosynthesis., 2017, 92: 437-451.
[32] JAAKOLA L, POOLE M O, JONES M, KÄMÄRÄINEN- KARPPINEN T, KOSKIMÄKI J, HOHTOLA A, HÄGGMAN H D, FRASER P, MANNING K J, KING G. A SQUAMOSA MADS box gene involved in the regulation of anthocyanin accumulation in bilberry fruits., 2010, 153(4): 1619-1629.
[33] SAKURABA Y, KIM Y S, HAN S H, LEE B D, PAEK N C. Thetranscription factor NAC016 promotes drought stress responses by repressingtranscription through a trifurcate feed-forward regulatory loop involving NAP., 2015, 27(6): 1771-1787.
[34] QU Y T, DUAN M, ZHANG Z Q, DONG J L, WANG T. Overexpression of theNAC transcription factorenhances cold tolerance in., 2016, 129: 67-76.
Molecular Cloning and Functional Characterization ofReveals Its Involvement in Anthocyanin Accumulation in Blueberry
SONG Yang, LIU HongDi, WANG HaiBo, ZHANG HongJun, LIU FengZhi
(Research Institute of Pomology, Chinese Academy of Agricultural Sciences/Key Laboratory of Fruit Germplasm Resources Utilization, Ministry of Agriculture/Laboratory of Mineral Nutrition and Efficient Fertilization for Deciduous Fruits, Liaoning Province, Xingcheng 125100, Liaoning)
【Objective】The objective of this study was to isolate a transcription factor(NAM, ATAF1/2, CUC2) from blueberry by PCR technology and studying its expression, and to identify its role in anthocyanin biosynthesis. This study laid the foundation for further study of the molecular mechanism ofaffecting anthocyanin biosynthesis in blueberry. 【Method】The blueberrygene was cloned by PCR technology from the fruits of blueberry (‘Duke’). The transgenicwere generated via-mediated transformation. The differences in the anthocyanin accumulation were compared between transgenic and wild-type. The yeast one-hybrid (Y1H) and transient expression assays were carried out to test the transcriptional regulation of MYB transcription factorby. 【Result】A blueberrywas cloned from blueberry. Sequence analysis showed that the coding domain sequence (CDS) ofwas 1 032 bp, which encoded 343 amino acids. Protein structure analysis showed that VcNAC072 contained a NAC domain. Expression analysis showed thatwas expressed at different developmental stages of the blueberry fruits. However, the expression levels varied, with the highest expression level in pink fruits and blue fruits and the relatively low transcript levels in green fruits. The content of anthocyanin in fruits was increased with the elevation of relative expression of. The sequence ofpromoter was analyzed and a NAC binding motif was found. The VcNAC072 protein could interact with the promoter of. Moreover, the VcNAC072 could induce the expression ofand favorably contributed to anthocyanin accumulation in seeds of transgenic. 【Conclusion】It was speculated thatup-regulated anthocyanin accumulation in fruits of blueberry.
blueberry; NAC transcription factor; anthocyanin; expression analysis; functional identification
10.3864/j.issn.0578-1752.2019.03.010
2018-08-27;
2018-09-28
山东农业大学作物生物学国家重点实验室开放课题项目(2018KF08)、辽宁省农业领域青年科技创新人才培养计划项目(2015059)、中国农业科学院科技创新工程、国家自然科学基金(31301754)、中央级公益性科研院所基本科研业务费专项
宋杨,E-mail:songyang1225@163.com。通信作者刘凤之,E-mail:liufengzhi6699@126.com
(责任编辑 赵伶俐)
