大载体转染猪胎儿成纤维细胞的电转条件优化
2019-02-20钟翠丽李国玲王豪强莫健新全绒张献伟李紫聪吴珍芳顾婷蔡更元
钟翠丽,李国玲,王豪强,莫健新,全绒,张献伟,李紫聪,吴珍芳,,顾婷,蔡更元,
大载体转染猪胎儿成纤维细胞的电转条件优化
钟翠丽1,李国玲1,王豪强1,莫健新1,全绒1,张献伟2,李紫聪1,吴珍芳1,2,顾婷1,蔡更元1,2
(1华南农业大学动物科学学院/国家生猪种业工程研究中心,广州 510642;2温氏食品集团股份有限公司,广东新兴 527400)
【背景】随着生物技术发展,研究的生理机制和生物功能日益复杂,提高大载体的转染效率对多基因共表达系统、基因编辑技术、转基因育种等具有重要的意义。在转基因育种中,使用的转基因载体相对较大,而且转基因动物的制备效率也与供体细胞猪胎儿成纤维(porcine Fetal Fibroblasts,PFFs)细胞的转染效率有关。【目的】研究主要从转染参数、质粒用量和拓扑结构三方面,比较3种电转仪ECM®830/NEPA 21/NucleofectorTM2b的大载体转染效率,以探索大载体转染PFFs的最佳条件。【方法】使用3种不同电转仪将长达26 kb的携带增强型绿荧光蛋白基因的pPXAT-EGFP质粒转染1×106个PFFs,48 h后使用流式细胞仪测定荧光细胞比例,从电转参数、质粒用量和拓扑结构三方面分别比较瞬时转染效率。【结果】首先比较电转仪不同参数的转染效率,结果显示当电转参数为脉冲电压300 V,脉冲长度1 ms,脉冲间隔50 ms,脉冲次数3次,NEPA 21转染PFFs的效率最高,为13.24%±1.63%,而NucleofectorTM2b的最佳电转参数为U-023,其转染效率高达46.36%±3.95%。然后在最佳电转参数下分别比较6、8、10和12 µg的26 kb超螺旋质粒的转染效率,ECM®830和NucleofectorTM2b转染PFFs的最佳质粒用量为12 µg,其转染效率分别为8.44%±0.90%(电转参数:脉冲电压300 V,脉冲长度1 ms,脉冲次数3 次)和14.63%±3.21%(电转参数:U-023),而NEPA 21使用10 µg质粒转染PFFs时效率达到最高(6.09%±0.72%)。最后比较不同质粒拓扑结构的转染效率,结果显示线性化质粒的转染效率较低,仅为超螺旋质粒转染效率的34.96%—48.39%。【结论】因此NucleofectorTM2b转染PFFs的最佳条件为:U-023程序、12 µg超螺旋质粒;NEPA 21为:脉冲电压200 V,脉冲长度3 ms,脉冲间隔50 ms,脉冲次数3次、10 µg超螺旋质粒;ECM®830则在脉冲电压300 V,脉冲长度1 ms,脉冲次数3 次条件下转染12 µg超螺旋质粒可获得最佳转染效率。综合比较上述3种电转仪,26 kb大载体转染PFFs的最佳电转仪是NucleofectorTM2b。
电转染;大载体;猪胎儿成纤维细胞;ECM®830;NEPA 21;NucleofectorTM2b
0 引言
【研究意义】为满足日益复杂的生物研究需求,运用的载体分子量越来越大(如本试验所用到26 kb载体),其主要原因有以下两点:(1)载体中两侧同源臂较大:运用同源重组的原理,需要在载体上根据靶点上下序列设计约600—6 000 bp两侧同源臂以定点敲入外源DNA[1-3];(2)多基因共表达的应用:多基因共表达系统能够满足研究复杂的生理机制和实现多种生物功能的需求,在肿瘤多基因治疗和蛋白工程等方面具有重大的应用价值。目前主要提高经济性质的转基因模型载体都在10 kb以上,如腮腺生物反应器的转基因载体[4]。因此优化大载体转染条件对多基因共表达系统、基因编辑、转基因育种等具有重要的意义。【前人研究进展】转基因猪的制备效率与大载体转染供体细胞PFFs的效率有关,大载体转染至PFFs后外源基因可通过随机整合和定点整合两种基因整合方式制备转基因动物。随机整合如系统具有基因转移能力强、整合效率高、转基因稳定表达和遗传等优点,而且整合位点相对安全[5-8]。据统计48.8%的整合位点位于已注释的基因位点[9];而杜新华等(2013)获得的8个转座子的有效整合位点中有5个位于牛基因组的非调控区内[10]。因此可借助增强型绿色荧光蛋白(enhanced green fluorescent protein, EGFP)基因报告载体和系统获得有效整合位点,分析外源基因的表达效果和对内源基因表达的影响等以评估位点的安全性[11]。而基于同源重组的定点整合技术整合效率较低,效率仅0.5%—20%,可选的安全位点较少,主要以为靶点插入外源基因制备转基因动物,如小鼠[12]、羊[13]、猪[11, 14],对20 kb以上的大片段定点整合仍存在极大的技术难度。目前转染方法主要有碳酸钙化学法、脂质体转染法和电穿孔法等。虽然有研究人员通过脂质体法和碳酸钙法可获得阳性PFFs细胞,但是碳酸钙转染效率低,脂质体转染法细胞毒性大[15]。而电穿孔法主要将额外加入的遗传物质从电击形成的瞬时孔隙导入细胞膜甚至细胞核内的一种转染方式,这种方式快速简易、毒性低、而且转染效率相对较高,约30%—90%[16-18]。故相比之下,电穿孔法更适合大载体转染PFFs。市面上电转仪种类繁多,如ECM®830、NEPA 21和NucleofectorTM2b等。ECM®830具有方形波电穿孔系统,通过击穿细胞膜将质粒导入细胞质内来实现高效转染,而NEPA 21和 Nucleofector™2b均能击穿细胞膜及核膜。三者相比,ECM®830转染成本较低;NEPA 21不需要特殊转染试剂盒,多数用于活体转染[19-20],甚少用于体外转染,Ishino等[21]使用NEPA 21成功转染牛耳成纤维细胞,但效率很低(0.35%)。Nucleofector™2b虽然根据细胞类型使用专用转染试剂盒,但无需自行摸索电转条件。【本研究切入点】研究表明上述3种电转仪转染PFFs的小载体(10 kb以内)转染效率可以达到50%以上[16-17, 22],但大载体转染PFFs的效率较低,且相关研究甚少,因此可通过优化电转仪(如ECM®830、NEPA 21和Nucleofector™2b)、电转参数、质粒用量和拓扑结构的转染条件来提高大载体转染PFFs的效率,为新型转基因环保猪的制备提供参考。【拟解决的关键问题】本文比较上述3种常用电转仪的电转参数、质粒用量和拓扑结构对26 kb质粒转染PFFs的影响,以寻找针对猪胎儿成纤维细胞的更高效、合适的大载体转染条件,为多基因共表达系统、基因编辑、转基因育种等的应用提供参考。
1 材料与方法
1.1 材料
电转仪:ECM®830(BTX,美国);Nucleofector™2b(LONZA,德国);NEPA 21(NEPA GENE,日本)。PFFs细胞:由广东温氏食品集团股份有限公司提供。质粒pPXAT-EGFP(26 kb):由国家生猪种业工程技术研究中心提供。
1.2 试验时间和地点
2016年7月广东省广州市华南农业大学国家生猪种业工程技术研究中心。
1.3 方法
1.3.1 质粒准备 pPXAT-EGFP质粒依照Endo-free Plasmid Maxi Kit(Omega,美国)说明书进行抽提,取部分超螺旋质粒使用FastDigest®I(Thermo Scientific,美国)进行酶切线性化,纯化回收备用(图1)。
1.3.2 电转染 将PFFs细胞于39℃、12%胎牛血清(Fetal bovine serum,FBS)的DMEM完全培养基中培养至融合度至80%—90%,胰酶消化后取1×106个细胞悬液至新的离心管中,弃上清,根据不同试验分组添加电转预混液(由电转液和质粒组成的,不电转的空白组以相应体积的电转液代替电转预混液),轻柔打散成单细胞悬浮液,全部转至无菌的2 mm间距电转杯中,根据不同电转参数进行电转,然后转移至含有12% FBS的DMEM完全培养基6孔板,置于39℃,5% CO2的培养箱中培养。电转6 h后更换成含有1×青链霉素(penicillin-streptomycin solution,PS)、12% FBS的DMEM完全培养基继续培养。电转48 h后0.05%胰酶消化,90×g离心5 min,添加1 mL/孔PBS重悬后用流式细胞仪检测转染效率[转染效率=(绿色荧光细胞/细胞总数)×100%]。

图1 pPXAT-EGFP质粒图谱
1.3.3 电转参数优化 ECM®830电转PFFs的最佳电转参数可参考Ross等[18]研究结果(脉冲电压300 V,脉冲长度1 ms,脉冲次数3次),而NEPA 21和Nucleofector™2b转染PFFs细胞的电转参数有待优化。
为获得NEPA 21最佳电转参数,分别采用广州市华粤行仪器有限公司(NEPA 21供货商)提供的4种电转参数转染PFFs,即分为4个处理组(NEPA-1、NEPA-2、NEPA-3和NEPA-4,表1)和一个空白组(不电转,100 µL NEPA电转液代替电转预混液),每个组3个重复,其他电转步骤及检测见1.3.2。此外,NEPA 21电转参数见表1,其电转预混液由100 µL NEPA 21电转液和8 µg质粒组成,而NEPA 21电转液为无血清Opti-MEM。
NucleofectorTM2b则选取文献报道中适用于PFFs的电转参数进行优化[17],即分为2个处理组(LONZA-A:A-033和LONZA-U:U-023,表2)和一个空白组(不电转,100 µL NucleofectorTM2b电转液代替电转预混液),每个处理组重复3次,其他电转步骤及检测见1.3.2。此外,NucleofectorTM2b电转参数为A-033和U-023,其电转预混液由100 µL NucleofectorTM2b电转液和8 µg质粒组成,而 NucleofectorTM2b电转液则来自电转试剂盒Basic Nucleofector Kit for Primary Mammalian Fibroblasts (Amaxa,德国)中Nucleofector™Solution 和supplement按比例4.5﹕1混合的液体。

表1 NEPA21的穿孔脉冲参数
NEPA 21电转参数参考分为两部分:转移脉冲和穿孔脉冲,其中转移脉冲参数不变(脉冲电压20 V,脉冲长度50 ms,脉冲间隔50 ms,脉冲次数5次,电压衰减幅度40%,电极+/-)。上述4种电转参数由NEPA 21供货商广州市华粤行仪器有限公司提供。NEPA 21电转液为无血清Opti-MEM
The electroporation parameter of NEPA 21 is divided into two parts: transfer pulse and poring pulse. The transfer pulse remains fixed(pulse voltage of 20 V, pulse length50 ms , pulse interval 50 ms, pulse number 5 times, Voltage attenuation range 40% , + / -). And the above 4 kinds of poring pulse are provided by Guangzhou Hua Yue Enterprise Holdings Ltd which is the supplier of NEPA 21. In addition, the transfection mixture of NEPA 21 is Opti-MEM without serum

表2 优化Nucleofector™ 2b电转参数的试验分组
1)A-033;2)U-023;3)Nucleofector™2b的电转液由电转试剂盒Basic Nucleofector Kit for Primary Mammalian Fibroblasts(Amaxa,德国)中Nucleofector™Solution 和supplement(4.5﹕1)
1)A-033;2)U-023;3)The transfection mixture of Nucleofector™2b is composed of Nucleofector™Solution and supplement(4.5﹕1) whcih is from Basic Nucleofector Kit for Primary Mammalian Fibroblasts(Amaxa, Germany)
1.3.4 优化质粒用量 使用上述优化的NEPA 21和Nucleofector™2b电转仪参数,及ECM®830电转参数(脉冲电压300 V,脉冲长度1 ms,脉冲次数3次)[18],分别使用6、8、10和12 µg的超螺旋质粒进行转染,即根据电转仪分为3个处理组(ECM®830、NEPA 21和Nucleofector™2b)和对应的3个空白组(不电转,相应电转液代替电转预混液),每个处理组根据质粒用量分为4个小组(6、8、10和12 µg的超螺旋质粒),每个处理小组重复3次,电转步骤及检测见1.3.2。此外ECM®830电转预混液由200 µL的ECM®830电转液和质粒组成,其中电转液是25% Opti-MEM和75% cytosalts(120 mmol·L-1KCl,0.15 mmol·L-1CaCl2,10 mmol·L-1K2HPO4;pH 7.6,5 mmol·L-1MgCl2)的混合液[18]。
1.3.5 质粒拓扑结构的影响 使用3种电转仪的最优电转参数和摸索的最适质粒用量,分别使用超螺旋和线性化的质粒进行转染,即根据电转仪分为3个处理组(ECM®830、NEPA 21和Nucleofector™2b)和对应的3个空白组(不电转,相应电转液代替电转预混液),每个处理组根据质粒分子结构分为2个小组(超螺旋质粒和线性化质粒),每个处理小组重复3次,电转步骤及检测见1.3.2。
1.3.6 比较电转仪的转染效率 根据上述探索的ECM®830,NEPA 21和Nucleofector™2b的最佳电转条件(电转参数、质粒用量和结构)转染PFFs以探索电转仪对转染效率的影响,即分为3个处理组和对应的3个空白组(不电转,相应电转液代替电转预混液),每个处理组重复3次,电转步骤及检测见1.3.2。
1.3.7 统计学处理 采用 SPSS 18软件进行单因素分析(Duncan)。数据以 Mean ± SD表示,显著性水平<0. 05则表示差异有统计学显著性意义。
2 结果
2.1 不同电转参数的比较
分别在不同的电转参数下以8 µg质粒转染PFFs,研究结果表明NEPA 21的最佳电转参数为NEPA-4(脉冲电压300 V,脉冲长度1 ms,脉冲间隔50 ms,脉冲次数3次),转染效率为13.24%±1.63%(>0.05,图2-A)。在Nucleofector™2b的最佳电转参数为U-023,其转染效率高达46.36%±3.95%(<0.05,图2-B)。

A:4种NEPA21电转参数的转染效率比较,NEPA-1~NEPA-4的电转参数见表2;B:2种Nucleofector™ 2b电转参数的转染效率比较,LONZA-A:A-033;LONZA-U:U-023
2.2 不同质粒用量的比较
在最佳电转参数下使用3种电转仪分别转染6、8、10和12 µg的26 kb超螺旋质粒。由图3可知当质粒用量为12 µg时,ECM®830和Nucleofector™2b转染效率最高,分别为8.44%±0.90%(<0.05)和14.63%±3.21%(>0.05)。而NEPA 21使用10 µg质粒转染PFFs时效率达到最高(6.09%±0.72%),但与12 µg质粒的转染效率差异不显著(5.12%±1.96%,>0.05)。
2.3 不同质粒拓扑结构的比较
在上述摸索的最佳参数下ECM®830,NEPA 21和Nucleofector™2b分别将12 µg超螺旋和线性化质粒转染PFFs细胞。结果显示3种电转仪分别使用超螺旋和线性化质粒的转染效率为:16.18%±1.45%和7.83%±1.27%;5.64%±1.12%和2.20%±0.23%;33.15%±1.30%和11.59%±1.20%(图4)。由此可知线性化质粒的转染效率为显著低于其超螺旋结构(<0.05),且仅为超螺旋质粒转染效率的34.96%—48.39%。
2.4 不同电转仪的比较
在最佳电转参数下比较ECM®830、NEPA 21和Nucleofector™2b转染12 µg超螺旋质粒的效率。结果显示3种电转仪的转染效率分别为:16.18%±1.45%、5.64%±1.12%和33.15%±1.30%,即3种电转仪中Nucleofector™2b转染PFFs的转染效率最高(图5)。

BTX:ECM® 830的最佳电转参数(脉冲电压300 V,脉冲长度1 ms,脉冲次数3次);NEPA-4:NEPA 21的最佳电转参数(脉冲电压200 V,脉冲长度3 ms,脉冲间隔50 ms,脉冲次数3次); LONZA-U:Nucleofector™ 2b的最佳电转参数(U-023)
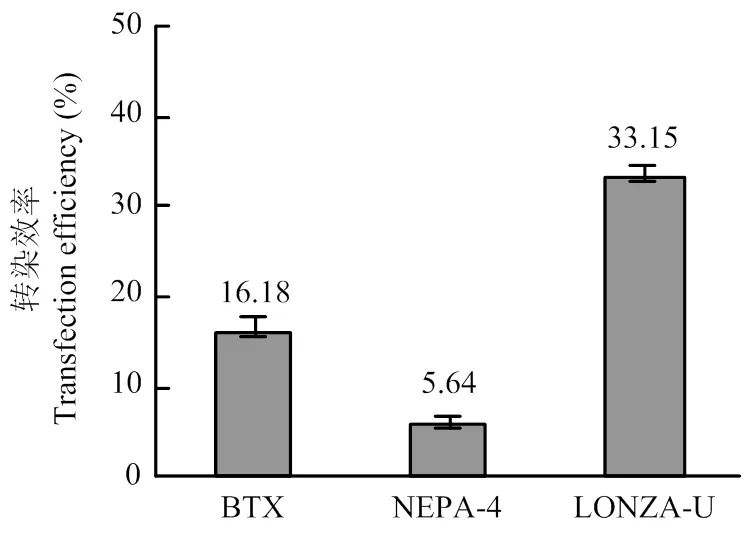
BTX:ECM® 830的最佳电转参数(脉冲电压300 V,脉冲长度1 ms,脉冲次数3次);NEPA-4:NEPA 21的最佳电转参数(脉冲电压200 V,脉冲长度3 ms,脉冲间隔50 ms,脉冲次数3次); LONZA-U:Nucleofector™ 2b的最佳电转参数(U-023)
3 讨论
市面上电转仪种类繁多,除了使用广泛的ECM®830以外,还出现了很多转染效率高的新型电转仪,如NEPA 21和NucleofectorTM2b,本研究主要是与ECM®830相比,探索新型电转仪转染PFFs的效果并优化大载体转染条件。ECM®830转染条件借鉴Ross等[18]研究,文献结果显示在优化的转染参数下将2.5 µg/200 µL的5.8 kb超螺旋质粒电转1×106个PFFs,其最高转染效率在70%左右。据报道使用NEPA 21将7 µg/100 µL的9 kb环状质粒转染至牛耳成纤维细胞,其转染效率仅为0.35%[21]。而Nakayama等[17]使用Nucleofector™2b的U-023程序转染3.5 kb超螺旋质粒,PFFs的转染效率为79%。
相比之下,本试验结果显示26 kb质粒转染至PFFs的转染效率最高仅为46.36%±3.95%(Nucleofector™2b),NEPA 21的效率不足10%,而ECM®830在Ross等[18]优化的电转参数下转染26 kb超螺旋质粒的效率低于16%,而明显低于上述小载体的转染效率,表明质粒大小与转染效率成反比的关系。本试验还探索不同拓扑结构的质粒对转染效率的影响,结果显示超螺旋质粒转染PFFs的效率高于线性化质粒效率的两倍(图4),这可能由于线性质粒的空间位阻较大[23]。而且有报道显示超螺旋质粒和线性化质粒的细胞死亡率和转染效率分别为:15%和35%、76%和11%[24]。推测线性化质粒对细胞的毒性较大,很可能影响后期猪体细胞克隆效率,因此超螺旋质粒更利于转染。
此外,电转仪也是显著影响转染效率的一个重要因素。3种电转仪相比,Nucleofector™2b的转染效率显著高于ECM®830和NEPA 21(图5),而且应用于小载体转染时效率亦可高达79%,这可能由于Nucleofector™2b的电流同时击穿细胞膜和细胞核膜更利于外源遗传物质转染。因此转染26 kb大载体的最佳电转仪是Nucleofector™2b,而且被广泛大量运用于转染成纤维细胞以制备转基因动物。结合钟翠丽等[22]研究结果认为电转成本较低且转染效率高达90%的ECM®830、ECM®2001等电转仪更适合小载体转染PFFs。此外ECM®830还具有对细胞损伤小的优势,如图4-A中虽然ECM®830转染12 µg线性化质粒的效率低于NEPA 21和Nucleofector™2b,但是存活率较高且荧光细胞总数相对较多。最后,NEPA 21在本试验中应用于转染PFFs,26 kb超螺旋质粒的转染效率较低(4%—13%),而7.6 kb超螺旋质粒的效率可达80%以上[22]。相比之下,NEPA 21不适合大载体转染PFFs。
本试验主要通过优化电转参数、质粒用量和拓扑结构等条件以提高大载体转染效率,对多基因共表达系统、基因编辑和转基因育种等的应用具有重要的意义。大载体的低转染效率是上述技术的难点之一,因此除了通过探索电转条件,还可以通过降低载体大小来提高转染效率。结合本试验结果及前人研究提出以下策略:(1)构建单启动子表达多基因或无启动子基因打靶载体,其中单启动子载体需要选择一个强启动子以启动多个基因表达,而无启动子基因载体则是借助内源启动子实现多基因表达[25-26];(2)运用IRES和2A序列等元件构建多顺反子[27-28];(3)缩短同源臂长度(短至300 bp)[29],能大幅度降低载体负载量,有利于提高转染效率,或运用同源臂长度仅5—25 bp的微同源重组技术[30]。
4 结论
针对目前大载体转染PFFs的效率较低且优化转染条件的研究甚少的情况,本研究通过在不同的电转仪(ECM®830/NEPA 21/Nucleofector™2b)、电转参数、质粒用量和拓扑结构的条件下转染PFFs以优化大载体的转染条件,为多基因共表达系统、基因编辑、转基因育种等提供参考数据。本研究结果显示3种电转仪中,Nucleofector™2b是大载体转染PFFs的理想电转仪,且在U-023的程序下转染12 µg的26 kb超螺旋质粒时可达到最高转染效率。
[1] RUAN J, LI H, XU K, WU T, WEI J, ZHOU R, LIU Z, MU Y, YANG S, OUYANG H, CHEN-TSAI R Y, LI K. Highly efficient CRISPR/Cas9-mediated transgene knock in at the H11 locus in pigs., 2015, 5: 14253.
[2] 王金霞, 徐影琪, 魏政立, 杨葳, 张梅英, 郑志红. 一种能实现蛋白可逆表达的敲入载体构建方法. 辽宁农业科学, 2016(4): 27-32.
WANG J X, XU Y Q, WEI Z L, YANG W, ZHANG M Y, ZHENG Z H. A method of constructing a knock-in vector which can achieve reversible protein expression.2016(4): 27-32. (in Chinese)
[3] 张驹. CRISPR/Cas9系统介导羊MSTN基因敲除和定点整合fat-1基因的研究[D]. 呼和浩特: 内蒙古大学, 2016.
ZHANG J. Generation ofgene knock-out andgene Knock-in goat via CRISPER/CAS9[D]. Huhhot: Inner Mongolia University, 2016. (in Chinese)
[4] GUAN L Z, SUN Y P, XI Q Y, WANG J L, ZHOU J Y, SHU G, JIANG Q Y, ZHANG Y L. β-Glucanase specific expression in the parotid gland of transgenic mice., 2013, 22(4): 805-812.
[5] CLARK K J, CARLSON D F, FAHRENKRUG S C. Pigs taking wing with transposons and recombinases., 2007, 8(Suppl 1): S13.
[6] DING S, WU X, LI G, HAN M, ZHUANG Y, XU T. Efficient transposition of the(PB) transposon in mammalian cells and mice., 2005, 122(3): 473-483.
[7] LI M A, TURNER D J, NING Z, YUSA K, LIANG Q, ECKERT S, RAD L, FITZGERALD T W, CRAIG N L, BRADLEY A. Mobilization of gianttransposons in the mouse genome., 2011, 39(22): e148.
[8] WU S C, MEIR Y J, COATES C J, HANDLER A M, PELCZAR P, MOISYADI S, KAMINSKI J M. piggyBac is a flexible and highly active transposon as compared to sleeping beauty, Tol2, and Mos1 in mammalian cells., 2006, 103(41): 15008-15013.
[9] WILSON M H, COATES C J, GEORGE AL JR.transposon-mediated gene transfer in human cells., 2007, 15(1): 139-145.
[10] 杜新华, 高雪, 张路培, 高会江, 李俊雅, 许尚忠. Piggybac转座子在牛基因组的整合位点及特征分析. 遗传, 2013, 35(6): 771-777.
DU X H, GAO X, ZHANG L P, GAO H J, LI J Y, XU S Z. Integration sites and their characteristic analysis oftransposon in cattle genome., 2013, 35(6): 771-777. (in Chinese)
[11] Xie Z, Pang D, Wang K, Li M, Guo N, Yuan H, Li J, Zou X, Jiao H, Ouyang H, Li Z, Tang X. Optimization of a CRISPR/Cas9-mediated knock-in strategy at the porcine Rosa26 locus in porcine foetal fibroblasts., 2017, 7(1): 3036.
[12] CHU V T, WEBER T, GRAF R, SOMMERMANN T, PETSCH K, SACK U, VOLCHKOV P, RAJEWSKY K, KÜHN R. Efficient generation of Rosa26 knock-in mice using CRISPR/Cas9 in C57BL/6 zygotes., 2016, 16: 4.
[13] WU M, WEI C, LIAN Z, LIU R, ZHU C, WANG H, CAO J, SHEN Y, ZHAO F, ZHANG L, MU Z, WANG Y, WANG X, DU L, WANG C. Rosa26-targeted sheep gene knock-in via CRISPR-Cas9 system., 2016, 6: 24360.
[14] LAI S, WEI S, ZHAO B, OUYANG Z, ZHANG Q, FAN N, LIU Z, ZHAO Y, YAN Q, ZHOU X, LI L, XIN J, ZENG Y, LAI L, ZOU Q. Generation of knock-in pigs carrying oct4-tdtomato reporter through CRISPR/Cas9-mediated genome engineering., 2016, 11(1). doi:10.1371/journal.pone.0146562.
[15] 覃兆鲜, 潘天彪, 谢炳坤. 猪成纤维细胞转染方法的比较. 江苏农业科学, 2011(3): 250-251.
QIN Z X, PAN T B, XIE B K. Comparison of the transfection methods for porcine fibroblasts cell., 2011(3): 250-251. (in Chinese)
[16] RICHTER A, KUROME M, KESSLER B, ZAKHARTCHENKO V, KLYMIUK N, NAGASHIMA H, WOLF E, WUENSCH A. Potential of primary kidney cells for somatic cell nuclear transfer mediated transgenesis in pig., 2012, 12(1): 84.
[17] NAKAYAMA A, SATO M, SHINOHARA M, MATSUBARA S, YOKOMINE T, AKASAKA E, YOSHIDA M, TAKAO S. Efficient transfection of primarily cultured porcine embryonic fibroblasts using the Amaxa Nucleofection System™., 2007, 9(4): 523-534.
[18] ROSS J W, WHYTE J J, ZHAO J, SAMUEL M, WELLS K D, PRATHER R S. Optimization of square-wave electroporation for transfection of porcine fetal fibroblasts., 2009, 19(4): 611-620.
[19] BARNABÉ-HEIDER F, MELETIS K, ERIKSSON M, BERGMANN O, SABELSTRÖM H, HARVEY MA, MIKKERS H, FRISÉN J. Genetic manipulation of adult mouse neurogenic niches by in vivo electroporation., 2008, 5(2): 189-196.
[20] Zou M, Koninck P D, Neve R L, Friedrich R W. Fast gene transfer into the adult zebrafish brain by herpes simplex virus 1 (hsv-1) and electroporation: methods and optogenetic applications.s, 2014, 8(7): 41.
[21] ISHINO T, HASHIMOTO M, AMAGASA M, SAITO N, DOCHI O, KIRISAWA R. Establishment of protocol for preparation of gene-edited bovine ear-derived fibroblasts for somatic cell nuclear transplantation., 2018, 39(2): 95-104.
[22] 钟翠丽, 李国玲, 莫健新, 全绒, 王豪强, 李紫聪, 吴珍芳, 张献伟. 不同电转仪的电转参数、质粒用量和拓扑结构对猪胎儿成纤维细胞转染效率的影响. 遗传, 2017(10): 930-938.
ZHONG C L, LI G L, MO J X, QUAN R, WANG H Q, LI Z C, WU Z F, ZHANG X W. Effects of parameters, plasmid dosages and topological structures on transfection efficiency of porcine fetal fibroblasts using different electroporators., 2017(10): 930-938. (in Chinese)
[23] VON GROLL A, LEVIN Y, BARBOSA M C, RAVAZZOLO A P. Linear DNA low efficiency transfection by liposome can be improved by the use of cationic lipid as charge neutralizer., 2006, 22(4): 1220-1224.
[24] AUER T O, DUROURE K, DE CIAN A, CONCORDET J P, DEL BENE F. Highly efficient CRISPR/Cas9-mediated knock-in in zebrafish by homology-independent DNA repair., 2014, 24(1): 142-153.
[25] 楚素霞, 姚伦广, 邢延豪, 周延清. 多基因表达系统研究进展. 中国生物工程杂志, 2011, 31(6): 116-123.
CHU S X, YAO L G, XING Y H, ZHOU Y Q. Progress in research on multiple gene expression system., 2011, 31(6): 116-123. (in Chinese)
[26] 李瑞国, 苗朝华, 侯健, 关宏, 安晓荣, 陈永福. 牛β-酪蛋白座位无启动子基因打靶载体的构建. 华北农学报, 2010, 25(4): 17-24.
LI R G, MIAO Z H, HOU J, GUAN H, AN X R, CHEN Y F. Non-promotor gene targeting vector construction for bovine β-casein site., 2010, 25(4): 17-24. (in Chinese)
[27] 沈俊杰, 单娟娟, 骆菁菁, 刘立, 钱程. 构建多顺反子表达载体系统的新策略[J]. 浙江理工大学学报, 2009, 26(4): 561-566.
SHEN J J, SHAN J J, LUO J J, LIU L, QIAN C. New strategy for construction of polycistron expression vector., 2009, 26(4): 561-566. (in Chinese)
[28] DENG W, YANG D, ZHAO B, OUYANG Z, SONG J, FAN N, LIU Z, ZHAO Y, WU Q, NASHUN B, TANG J, WU Z, GU W, LAI L. Use of the 2A Peptide for Generation of multi-transgenic pigs through a single round of nuclear transfer., 2011, 6(5): e19986.
[29] SATO M, KAGOSHIMA A, SAITOH I, INADA E, MIYOSHI K, OHTSUKA M, NAKAMURA S, SAKURAI T, WATANABE S. Generation of α-1, 3-galactosyltransferase-deficient porcine embryonic fibroblasts by CRISPR/Cas9-mediated knock-in of a small mutated sequence and a targeted toxin-based selection system., 2015, 50(5): 872-880.
[30] NAKADE S, TSUBOTA T, SAKANE Y, KUME S, SAKAMOTO N, OBARA M, DAIMON T, SEZUTSU H, YAMAMOTO T, SAKUMA T, SUZUKI K T. Microhomology-mediated end-joining-dependent integration of donor DNA in cells and animals using TALENs and CRISPR/Cas9., 2014, 5: 5560.
Optimizing the Electroporation Condition of Porcine Fetal Fibroblasts for Large Plasmid
ZHONG CuiLi1, LI GuoLing1, WANG HaoQiang1, MO JianXin1, QUAN Rong1, ZHANG XianWei2, LI ZiCong1, WU ZhenFang1,2, GU Ting1, CAI GengYuan1,2
(1College of Animal Science, South China Agricultural University/National Engineering Research Center for Breeding swine Industry, Guangzhou 510642;2Wenshi Food Group Co. Ltd., Xinxing 527400, Guangdong)
【Background】With the development of biotechnology, the physiological mechanisms and biological functions of research are becoming more and more complex, and improving the transfection efficiency of large vectors is of great significance for multi-gene co-expression systems, genome editing, and transgenic breeding. In transgenic breeding, the transgenic vectors is relatively large, and the efficiency of generating transgenic animals is also attributed to the transfection efficiency of porcine fetal fibroblasts (PFFs). 【Objective】Therefore, this study mainly compared the electroporation efficiency of three electroporation apparatus ECM®830/NEPA 21/NucleofectorTM2b on various parameters, plasmid dosage and topology, to explore the optimal electroporation condition of large vector in PFFs. 【Method】we transfected a 26 kb plasmid, namely pPXAT-EGFP, into the PFFs, and then the electroporation efficiencies of various parameters of three electroporation apparatus ECM® 830/NEPA 21/Nucleofector™2b, and the dosage and topological structure of the plasmid by the flow cytometry were compared.【Result】By comparing the transfection efficiency of different transfection parameters, the results showed that the highest transfection efficiency of NEPA 21 was 13.24%±1.63% at pulse voltage 300 V, pulse length 1 ms, pulse interval 50 ms, pulse number 3 times, and the optimal electrical rotation parameter of NucleofectorTM2b was U-023, whose transfection efficiency was 46.36%±3.95%. In addition, the transfection efficiencies of 6, 8, 10 and 12 μg 26 kb supercoiled plasmids were compared under the optimal electroporation parameters, and the results showed that the optimal plasmid dosage for ECM® 830 and NucleofectorTM2b transfected PFFs was 12 μg with 8.44% ± 0.90% efficiency (transfection parameters: pulse voltage 300 V, pulse length 1 ms, pulse number 3 times) and 14.63% ± 3.21% (U-023), while the NEPA 21 achieved the highest efficiency of 6.09% ± 0.72% with 10 μg plasmid. Finally, we compared the transfection efficiency of different quality topologies and found that the transfection efficiency of linearized plasmids was low, only 34.96%-48.39% of the supercoiled plasmids. 【Conclusion】 Therefore, the optimal electroporation condition of PFFs by Nucleofector™2b was U-023 procedure, 12 μg supercoiled plasmid; NEPA 21 was pulse voltage 200 V, pulse length 3 ms, pulse interval 50 ms, pulse number 3 times, and 10 μg supercoiled plasmid; ECM® 830 was transfected with 12 μg supercoiled plasmid at pulse voltage 300 V, pulse length 1 ms, and pulse number 3 times to obtain the highest transfection efficiency. Comprehensive comparison of the above three kinds of electroporation apparatus, the optimum for transfecting PFFs with 26 kb large carrier was Nucleofector™2b.
electroporation; large plasmid; porcine fetal fibroblasts; ECM®830; NEPA 21; Nucleofector™2b
10.3864/j.issn.0578-1752.2019.03.013
2018-09-18;
2018-12-29
国家科技重大专项(2016ZX08006002)、国家自然科学基金(31802036)、广东省自然科学基金(2017A030310001)
钟翠丽,E-mail:1014942996@qq.com。通信作者蔡更元,E-mail:cgy0415@163.com。通信作者顾婷,E-mail:tinggu@scau.edu.cn
(责任编辑 林鉴非)
