紫小麦麸皮花色苷提取及应用研究
2019-02-20杨三维李刘军赵佳佳郑兴卫芦艳珍
杨三维,李刘军,乔 玲,赵佳佳,郑兴卫,葛 川,芦艳珍,田 鹏
(1山西省农业科学院小麦研究所,山西临汾041000;2山西大学商务学院体育系,太原030006)
0 引言
当前食品和饮料等行业多使用合成色素作为着色剂,合成色素往往具有致癌、致突变等副作用,易对人体健康产生不良影响[1]。天然色素除可作为着色剂使用外,还具有营养价值和药理作用。随着人们不断追求健康、天然和高品质的生活质量,天然色素必将取代化学合成色素。花色苷作为一种安全、无毒的天然色素,对人体具有多种保健功能,常用于清除体内自由基、增殖叶黄素,具有抗肿瘤、抗癌、抗炎、抑制脂质过氧化和血小板凝集等作用[2-3]。目前植物花色苷的提取多以新鲜植物为原料,受季节影响很大,已有从蓝莓、桑葚、葡萄皮、黑加仑和紫薯等植物中提取花色苷方法的报道,提取出的花色苷应用于食品、化妆品、医药、工业等领域,体现出较大的应用潜力[5-7]。植物花色苷的提取方法多采用酸碱溶液分步提取法,存在提取率低、活性差的缺点,酸碱液对后续的纯化设备损害也比较大。此外,这些方法提取出的花色苷杂质较多,其中的多糖、蛋白和淀粉容易对人产生过敏等影响。也有利用超声波和复合酶等方法提取花色苷的报道[8-9],具有周期短、得率高的特点,但尚未应用于实际生产。因此,寻找、开发新的植物花色苷来源以及高纯度的提取方法具有重要意义。
紫小麦是一种理想的天然食品资源,紫小麦种皮富含天然花色苷类化合物而呈现紫色,其紫粒特性是由长穗偃麦草和四倍体与小麦的远缘杂交而来,不同来源紫小麦所含有的紫色素成分不同[10]。关于紫小麦花色苷的提取已有报道,傅虹飞等[11]和蒋彦婕等[8]研究了紫小麦花色苷超声波辅助提取工艺,李伟等[12]利用酸化乙醇法提取麸皮中花色苷的工艺。与紫薯和蓝莓等其他植物相比,小麦花色苷的提取率偏低,所用紫麦品种不明确也导致其花色苷种类未知,这些因素限制了小麦花色苷的进一步开发和应用。因此,寻找、挖掘稳定的紫麦花色苷来源以及高纯度的提取方法一直倍受重视。为提升紫小麦综合利用价值,本文提供了一种高纯度、低成本的花色苷提取工艺,研究了小麦花色苷的抗氧化和染毛特性,以期为紫小麦花色苷的进一步应用开发提供新方法和新材料。
1 材料与方法
1.1 供试材料
当前推广面积较大的紫小麦品种‘农大3753’,由山西省农科院小麦研究所保存。
1.2 原料预处理
收集出粉率为75%左右的紫小麦麸皮,麸皮主要成分为种皮、胚和少量胚乳,将麸皮用麦麸粉碎机(WFJ-15,佳科机械制造有限公司)粉碎至200目后贮藏备用。
1.3 花色苷提取工艺
CTAB(十六烷基三甲基溴化铵)浸提液配方为:十六烷基三甲基溴化铵23 g,乙二胺四乙酸二钠3 g,蔗糖5 g,柠檬酸6 g,定容至1 L;所用试剂均为国产分析纯(北京化工厂),试验过程参考文献[13]进行,增加脱蛋白和去多糖等步骤。
1.4 小麦花色苷的提取工艺优化
以料液比、提取次数和提取时间为自变量,单因素试验优化紫小麦花色苷提取的最优工艺参数。
1.5 花色苷的含量和色价测定
参考文献[14],采用pH值示差法测定花色苷含量,具体步骤为:取pH 1.0氯化钾-盐酸缓冲液和pH 4.5醋酸钠缓冲液各9 mL,加入待测样品1 mL混匀后,利用紫外-可见分光光度计(日立U-2010型)检测。根据式(1)计算花色苷含量。式(2)用于起始标量的计算。
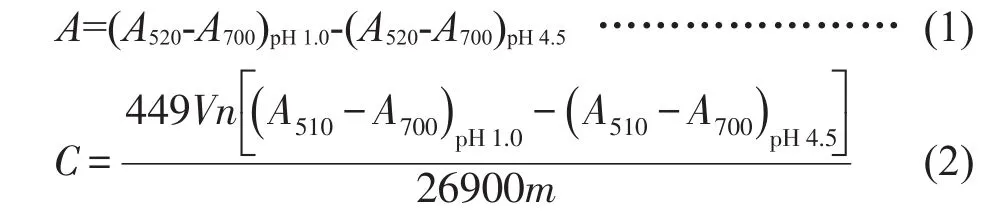
式中,V为提取总体积,n为稀释倍数,449为矢车菊色素-3-葡萄糖苷的摩尔质量(g/mol),26900为矢车菊色素-3-葡萄糖苷的摩尔消光系数(L·mol/cm),m为样品质量(g)。
通过520 nm的吸光值测定花色苷色价值,具体方法为:称取1 g花色苷粉末,用pH 3.0的柠檬酸缓冲液溶解并定容至100 mL,再进行适当稀释使吸光值在0.2~0.8,缓冲液作对照,计算如式(3),式中,%表示试样浓度为1%的色价。

1.6 花色苷成品标准检测
采用电感耦合等离子体原子发射光谱仪(法国JY138)和原子吸收光谱仪(日立-Z5000)检测提取物金属含量。元素标准溶液(100 μg/mL)由国家标准溶液(NCS)稀释而成,试验用水为去离子水。ICP分析条件:谱线波长As为193.7 nm,工作功率1250 W,入射狭缝18 nm,出射狭缝79 nm,进样速率1.5 mL/min,载气压力0.25 MPa,护套气量0.18 L/min,冷却气流量18 L/min。原子吸收分析条件:灯电流7.5 mA,狭缝1.3 nm,燃烧器高度7.5 mm,火焰类型为贫燃。提取物中金属总含量通过比色法测定,按照国家标准《有机化工产品中重金属的测定》编号GB/T 7532—2008进行。
1.7 花色苷抗氧化活性检测
在含有H2O2鲁米诺发光体系中检测不同浓度小麦花色苷的清除活性氧的IC50,在测定瓶中依次加入100 μL浓度为5 mol/L的H2O2和0.2 mol/L pH 9.7的碳酸钠-碳酸氢钠缓冲液500 μL,再加入不同浓度的供试样品,蒸馏水作为空白对照;混合均匀后加入5 mol/L的鲁米诺和10 mol/L的CTMAB(十六烷基三甲基溴化铵)等量混合液500 μL启动反应,将样品置于液闪测定仪中,延时10 s,测定12 s内的发光强度。
1.8 紫小麦花色苷羊毛染色
将羊毛放入Na2CO3溶液中浸泡,可以促使染料分子与毛发蛋白结合;再用金属盐作为媒染剂与花色苷分子显色,并固定染料分子;最后将花色苷与金属离子作用显色并固定,从而使羊毛着色。具体方法为:先将洗净的白色羊毛放入Na2CO3预处理液中10 min,在金属离子媒染剂中处理10 min后洗净,最后放入3%花色苷溶液中染色10 min,观察其颜色的变化。
2 结果与分析
2.1 花色苷提取工艺
在对紫小麦麦麸进行充分粉碎的条件下,采用改良CTAB法在室温下提取花色苷,同时使用pH值沉淀和有机溶剂沉淀去除蛋白和多糖等杂质。具体工艺为:(1)取粉碎后的麦麸0.5 kg,按照一定(m/v)比例使用CTAB液浸提,12000 g离心10 min,取上清。(2)使用HCl将离心后上清液调至pH 4.2,10000 g离心15 min,弃沉淀。(3)用NaOH将上清液调节至pH 8.0,10000 g离心15 min。(4)旋转蒸发器将以上提取液浓缩至0.25 L后,再加入2倍体积99%的乙醇去除多糖,12000 g离心10 min弃沉淀。(5)大孔吸附树脂(AB-8)吸附色素后,20%~30%的乙醇洗脱杂质,再用60%的乙醇解吸树脂中吸附的色素。(6)使用耐乙醇的有机钠滤膜对解吸液进行浓缩,得到浓度10%左右的浓缩液。(7)采用旋转蒸发器进一步浓缩样品至100 mL左右,12000 g离心10 min,去除杂质和不溶络合物。(8)设定干燥器进风温度为160℃,出风温度为75℃,喷雾干燥得到花色苷成品。
2.2 小麦花色苷的提取方法优化
已有文献研究表明,提取次数、提取温度、提取时间和料液比是影响小麦花色苷提率的主要因素[9,11-12]。为了保持花色苷稳定性,在室温条件下优化小麦花色苷的提取方法,以提取次数、提取时间和料液比为自变量,提取量为响应值进行单因素试验。试验结果表明,随着提取时间的增加,花色苷的提取率提高,当提取时间超过60 min后花色苷提取率则出现下降趋势(图1A)。原因可能是提取时间过长,使得组织中大量的细胞破裂,细胞内大量不溶物及黏性物质等混入到提取液中,导致溶液中杂质增多,黏度增大,影响了花色苷的溶出;另一方面随着提取时间的延长,花色苷的多糖分子链断裂,在醇沉处理过程中损失增大,从而降低了花色苷的提取率,由此,确定花色苷的最佳提取时间为60 min(图1B)。将麦麸粉以不同比例加提取液进行提取,随着提取液用量的不断增大,花色苷提取率明显提高,原因可能是溶剂比例的增加可有效降低溶液的黏度,提高了浓度差,有利于花色苷分子扩散(图1C),确定花色苷提取的料液比为1:3为宜。以料液比为1:3,提取时间60 min条件下,研究了提取次数对花色苷提取率的影响,从图1A中可以看出,随着提取次数增多,花色苷的得率增加,但超过3次以后,提取率降低。因此,根据单因素确定的最佳提取参数,采用提取次数为3次、提取时间为60 min和料液比为1:3.2在室温下进行小麦花色苷提取,花色苷的得率为3.20 g/kg。
2.3 紫小麦花色苷紫外光谱分析
从图2中可以看出,提取出的花色苷样品只在520~540 nm处有较强的花色苷吸收峰出现,310~355 nm处花青素酰基结构的特征峰峰位没有出现,表明花色苷纯度较高;280 nm处蛋白质吸收峰较低,说明采用pH值沉淀法有效脱除了蛋白。花色苷为糖配体,分子量较大,导致提取物中含有大量的多糖、蛋白和淀粉,极大地限制了花色苷的应用,而用本工艺提取的花色苷杂质少、纯度较高。
2.4 花色苷成品标准检测
为进一步明确提取出的花色苷中金属含量等相关指标,采用比色法测定总金属含量,原子吸收光谱仪和离子体原子发射光谱仪测定铅和砷等物质的含量。从表1可以看出,提取的花色苷其色价为170,其中,重金属总含量小于29 μg/g,远低于国家标准;铅和砷等毒性较大的金属离子均未检出;干燥失重后仅为4.6%,灰分成分为2.4%,2项指标均达到了商业化标准[20]。

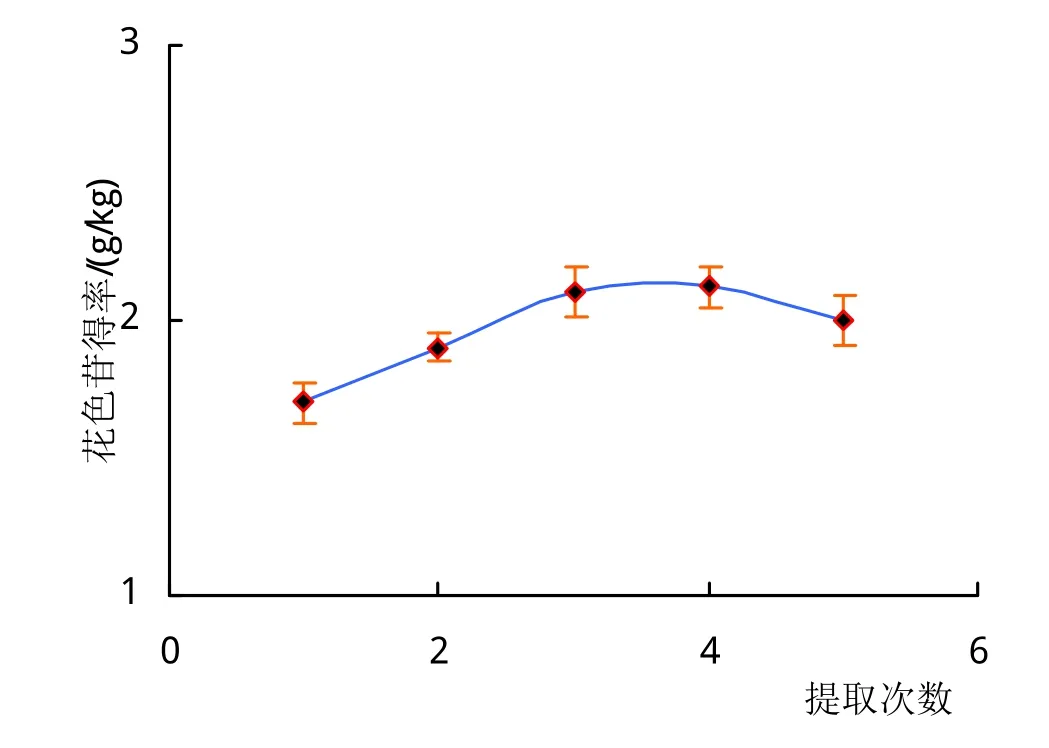
图1 不同条件对花色苷提取率的影响
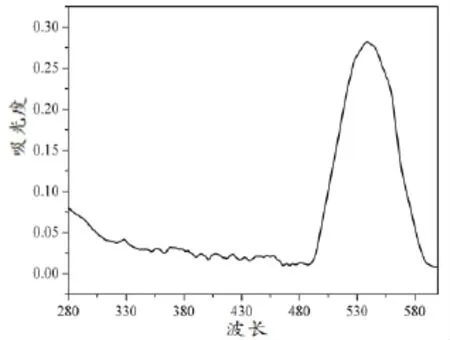
图2 花色苷提取的紫外-可见光谱
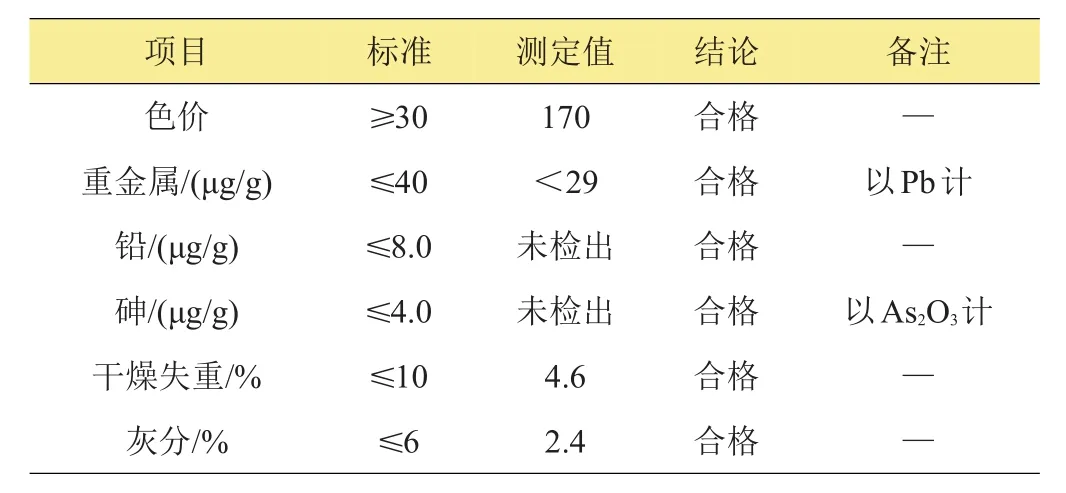
表1 紫小麦种皮花色苷性质检测
2.5 花色苷抗氧化性评价
傅虹飞等[11]研究证明小麦花色苷具有较强的清除DPPH自由基和ABTS自由基的能力,但未与相关抗氧化剂进行对比。为明确‘农大3753’紫小麦花色苷的抗氧化特性,在含有H2O2鲁米诺发光体系中进行检测,试验结果表明,加入的抗氧化剂浓度越高,对活性氧的清除率越高。IC50为抑制氧化发光50%时所需清除剂浓度,以清除百分率对清除剂浓度比较可计算出IC50为1.52。张立伟等[14]发现连翘活性物对活性氧具有较强的清除能力,对H2O2清除能力IC50为1.618,相同浓度的条件下,小麦花色苷具有较强的清除H2O2的能力。
2.6 小麦花色苷羊毛染色
小麦花色苷应用研究开展较少,未见用于毛发染色的有关报道。本工艺提取的紫小麦花色苷具有较高的纯度和色价,因此,进行了羊毛染色的相关试验。从图3看出,花色苷与不同金属元素作用可将羊毛染成不同颜色,MgSO4-花色苷显紫红色,FeSO4-花色苷显土黄色,AlCl3-花色苷显棕色,FeCl3-花色苷显蓝紫色。
3 讨论
近年来,国内紫小麦的种植面积不断增加,‘农大3753’、‘宁春46’和‘河东乌麦’已有稳定种植面积[15]。紫小麦的开发大多以面粉为主,富含花色苷的麦麸产量大,但利用率却很低,大部分用作动物饲料,造成了原料的廉价消耗。当前,小麦花色苷的提取多采用酸碱抽提,刘慧芳等[15]采用酸化乙醇浸提法提取的紫小麦花色苷得率为(0.87±0.21)g/kg;也有利用超声波和高温提取的报道[16-17],如傅虹飞等[11]采用超声波辅助提取得到小麦花色苷得率为(1.82±0.23)g/kg,是普通浸提法的2倍。由于麦麸中含有较多的淀粉和蛋白,加之酸碱裂解,导致提取出的花色苷活性较低,极大地限制了小麦花色苷的开发和利用。CTAB法目前主要用于植物DNA的提取,是一种较为温和高效的植物破除细胞壁的方法,目前尚未见利用CTAB法提取植物色素的研究报道。笔者改良CTAB法后用于提取小麦麸皮中的花色苷,紫小麦花色苷得率为3.20 g/kg,高于前2种方法。此外,在提取过程中添加了去多糖和淀粉的步骤大大提高花色苷的纯度,为小麦花色苷的进一步利用奠定了基础。

图3 花色苷羊毛染色样品.
在抗氧化方面,张立伟等[14]发现连翘活性物对活性氧具有较强的清除能力,笔者提取的花色苷对H2O2清除能力高于连翘皂甙。此外,金属元素分析研究表明,CTAB法提取出的花色苷重金属含量很低,达到了国家食品药品的相关标准。可见紫小麦麸皮花色苷的体外抗氧化活性高,在抗氧化功能性食品或功能因子添加剂方面具有较大的开发应用价值。毛发染色已成为美妆领域最流行的产品,目前全球染发需求市场年平均增长约5%,在未来仍将不断增长[18-19]。目前永久型染发剂的染料中间体一般采用具有毒性的苯二胺及其衍生物[20-22],因此,随着人类健康意识的增强和科技的进步,有毒染料会逐渐退出市场。法国、英国等欧洲国家已研制出苏木精为原料的植物染发剂,日本也有市售的辣椒素、单宁酸、胭脂红酸等植物天然毛发染色剂[19,23-24]。在中国历来就有利用何首乌、苏木精和胡桃醌等天然色素进行染发的传统[25],均是基于花色苷可与多种金属元素结合显色的原理。因此,笔者采用与人类头发组织结构相似的羊毛为原料,通过不同金属元素与花色苷结合进行羊毛染色,初步结果表明小麦花色苷作为染发剂的可行性和着色稳定性,这些结果进一步拓宽了小麦花色苷的应用和研究范围。
