猪源大肠杆菌耐药性及超广谱β-内酰胺酶流行性分析
2019-02-19邱华
,, ,,,邱华,,,
大肠杆菌(Escherichiacoli)属于革兰氏阴性菌,广泛存在于自然界,为人和动物肠道中的常居菌,在一定条件下可引起仔猪黄、白痢和仔猪水肿病,在兽医临床上属于多发常见病,发病率和死亡率普遍较高。β-内酰胺类药物是兽医临床重要的抗感染药物,广泛用于动物疾病的治疗。随着近十多年来,β-内酰胺类药物在兽医临床上长期不合理的使用,导致耐药菌株的产生并且广泛扩散流行,抗菌效果降低甚至丧失,导致大批量动物死亡,给猪场养殖业带来巨大的经济损失。超广谱β-内酰胺酶(ESBLs)是介导大肠杆菌对第三代头孢菌素耐药的重要机制。ESBLs耐药基因由质粒携带可通水平传播,在全球范围内迅速扩散,造成耐药。同时动物源产 ESBLs 大肠杆菌可经食物链直接或间接传播给人,给人类的健康造成严重威胁。
目前,福建地区猪源大肠杆菌ESBLs流行病学的研究资料相对较少。因此,本实验对该地区分离的猪源大肠杆菌ESBLs流行性进行调查以及种系发育进行分析,旨在阐明该地区分离株的ESBLs流行分布特征和种系发育进行情况,以期对该病原菌耐药性风险评估及兽医临床合理使用药提供一定的科学依据。
1 材料和方法
1.1细菌分离与鉴定 2014-2016年采用肛门拭子采集规模化猪场粪便样品,将采集的粪便样品在洁净工作台中接种于3 mL灭菌的LB肉汤中,37 ℃震荡培养箱增菌12~24 h,再用接种环接取少量菌液均匀划线于麦康凯琼脂上, 37 ℃培养箱12~24 h,挑取麦康凯琼脂上红色不透明中等大小可疑单菌落进行纯化并鉴定。所有分离株经革兰氏染色后镜检、生化鉴定和16S rRNA[1](F:AGAGTTTGATCTGGCTCAG,R:GGTTACCTTGTTACG-ACTT)分析检测。分离株保存在终浓度为30.0%甘油肉汤中,-20 ℃冰箱保存备用。大肠杆菌ATCC 25922作为药敏质控菌,由本实验室保存。
1.2药物与试剂 麦康凯琼脂(MacConkey Agar),LB肉汤(LB Broth),LB琼脂(LB Agar),水解酪蛋白琼脂(MH Agar),水解酪蛋白肉汤(MH Broth),均购自广州环凯微生物科技有限公司;氨苄西林、头孢噻呋、庆大霉素、卡那霉素、四环素、多西环素、氟苯尼考、萘啶酸、恩诺沙星、环丙沙星和甲氧苄啶/磺胺甲噁唑,购自中国兽医药品监察所;头孢噻肟购自中国药品生物制品检定所;rTaqDNA聚合酶购自宝生物工程(大连)有限公司;引物合成和PCR产物序列测定由华大生物科技(上海)有限公司完成。
1.3药物敏感性测定 大肠杆菌药物敏感性的测定方法参考美国临床实验室标准化委员会(M100-S25)推荐方法执行,采用琼脂二倍稀释法测定分离菌株的最低抑菌浓度(MIC),以完全抑制细菌生长的最低浓度为最低抑菌浓度。其中头孢噻呋[2]和氟苯尼考[3]的耐药折点参考文献报道,恩诺沙星的耐药折点参考(CLSI,M3-A3)鸡大肠杆菌的耐药折点,并根据MIC的测定值,计算每种药物的MIC50和MIC90。大肠杆菌ATCC 25922作为药敏质控菌株。
1.4基因组DNA提取 用水煮法提取DNA模板,将鉴定纯化的大肠杆菌划线接种于麦康凯琼脂平板上,37 ℃培养12~24 h后,挑取单个菌落接种于4 mL LB肉汤中,37 ℃振荡培养12~24 h,将菌液分装到2 mL 的EP管中12 000 r/min离心2 min,弃上清,加入250~300 μL 灭菌超纯水,置于沸水浴10 min,冰浴5 min后,12 000 r/min离心5 min,取上清液至另一灭菌EP管,储于4 ℃冰箱保存。
1.5ESBLs基因的检测及CTX-M亚型分析 试验检测了ESBLs耐药基因,包括TEM、SHV、OXA和CTX-M基因,其中CTX-M 型包括CTX-M-1G和CTX-M-9G,引物序列参考相关文献报道,见表1。PCR 产物经1%琼脂糖凝胶电泳检测,目的基因的PCR产物经序列测定后提交NCBI平台通过BLAST进行分析确认。
1.6种系发育关系分析 根据Clermont等文献报道的方法判断大肠杆菌种族系统进化关系[4]。采用多重PCR及交叉式检索表的方法,以chuA基因、yjaA基因及一个未知 DNA片段 TspE4.C2的存在或缺少为依据来判定菌株所在的种族。
表1 基因引物序列及片段长度
Tab.1 Primer sequences of genes and gene length

基因类别基因名称 引物序列(5'-3')片段长度(bp)超广谱β-内酰胺酶TEM5'-ATAAAATTCTTGAAGACGAAA-3'1080[5]5'-GACAGTTACCAATGCTTAATC-3'SHV5'-CACTCAAGGATGTATTGTG-3'885[6]5'-TTAGCGTTGCCAGTGCTCG-3'OXA5'-TGAAGGGTTGGGCGATTT-3'925[7]5'-ACCCGGAGCCTCATTAATTGT-3'CTX-M-1G5'-CTTCCAGAATAAGGAATCCC-3'949[8]5'-CGTCTAAGGCGATAAACAAA-3'CTX-M-9G5'-GTGACAAAGAGAGTGCAACGG-3'857[6]5'-ATGATTCTCGCCGCTGAAGCC-3'种系发育chuA5'-GACGAACCAACGGTCAGGAT-3'279[4]5'-TGCCGCCAGTACCAAAGACA-3'yjaA5'-TGAAGTGTCAGGAGACGCTG-3'211[4]5'-ATGGAGAATGCGTTCCTCAAC-3'TspE4C25'-GAGTAATGTCGGGGCATTCA-3'152[4]5'-CGCGCCAACAAAGTATTACG-3'
注:F,上游引物;R,下游引物
2 结 果
2.1细菌分离情况 2014-2016年期间,从福建地区规模化猪场粪便中共分离大肠杆菌373株。大肠杆菌在麦康凯培养基上菌落呈圆形凸起,边缘整齐,粉色至深红色;在伊红美蓝培养基上,菌落中心呈黑色,有金属光泽。分离株经革兰氏染色及油镜观察,呈红色短杆菌;生化鉴定结果符合大肠杆菌的相关特征;16S rRNA检测,可获得1 500 bp的目的条带,经测序并分析,确认分离株为大肠杆菌。
表2 大肠杆菌对抗菌药物的最低抑菌浓度
Tab.2 Distribution of minimum inhibitory concentration values for antimicrobials inEscherichiacoliisolates
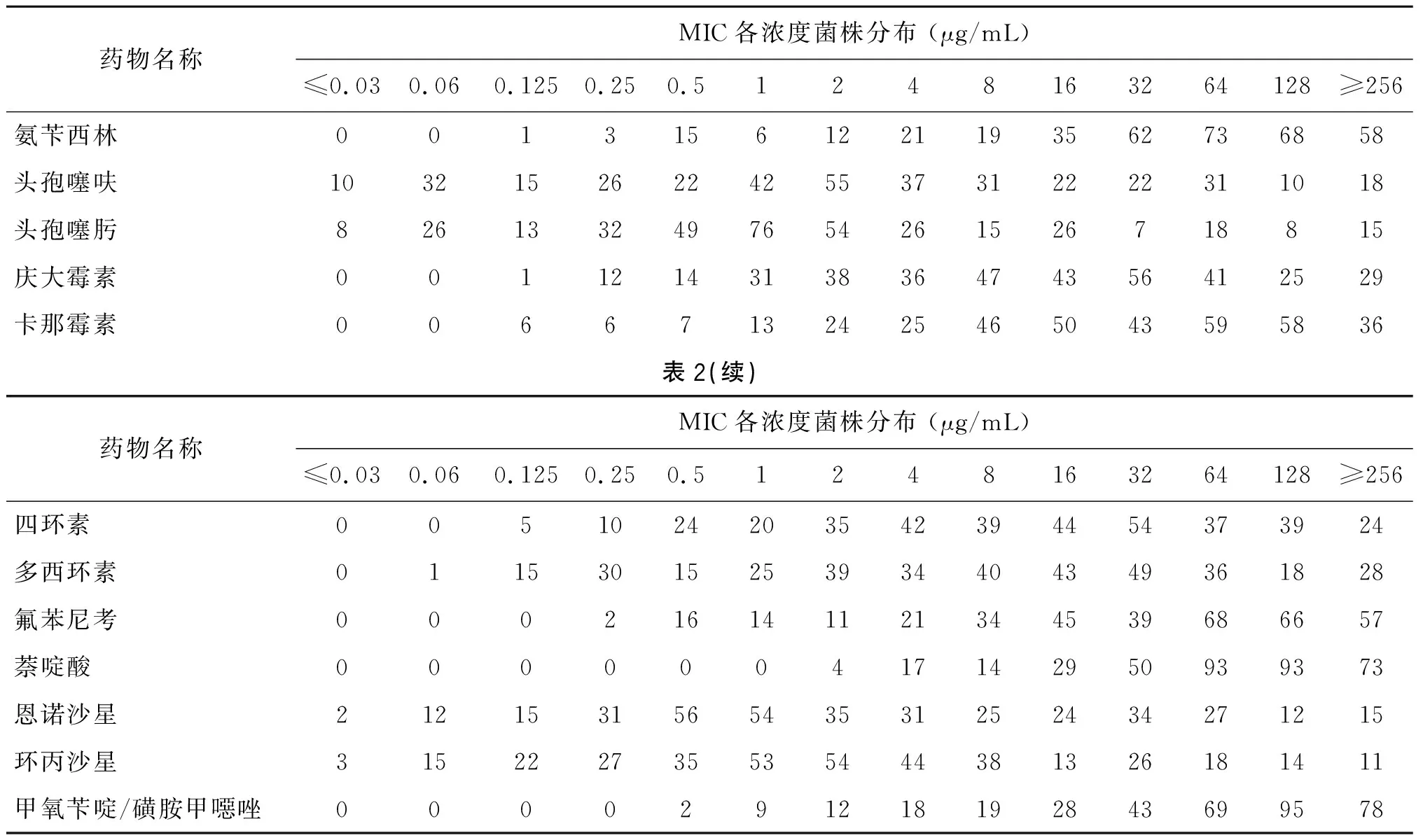
药物名称MIC各浓度菌株分布 (μg/mL)≤0.030.060.1250.250.51248163264128≥256氨苄西林00131561221193562736858头孢噻呋1032152622425537312222311018头孢噻肟8261332497654261526718815庆大霉素0011214313836474356412529卡那霉素00667132425465043595836表2(续)药物名称MIC各浓度菌株分布 (μg/mL)≤0.030.060.1250.250.51248163264128≥256四环素0051024203542394454373924多西环素01153015253934404349361828氟苯尼考000216141121344539686657萘啶酸000000417142950939373 恩诺沙星212153156543531252434271215环丙沙星315222735535444381326181411甲氧苄啶/磺胺甲噁唑0000291218192843699578
表3 大肠杆菌对抗菌药物的MIC50、MIC90和耐药率
Tab.3 MIC50, MIC90and resistance rates for antimicrobials inEscherichiacoli
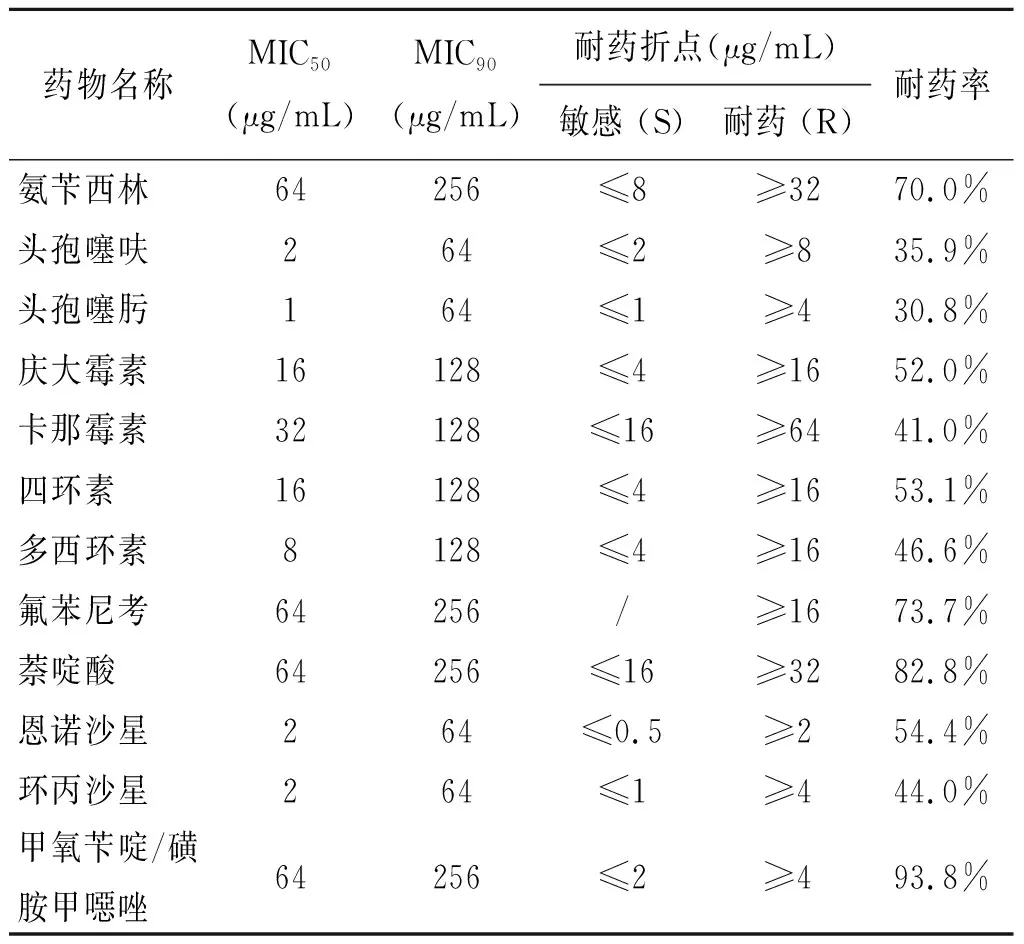
药物名称MIC50(μg/mL)MIC90(μg/mL)耐药折点(μg/mL)敏感 (S)耐药 (R)耐药率氨苄西林64256≤8≥3270.0%头孢噻呋264≤2≥835.9%头孢噻肟164≤1≥430.8%庆大霉素16128≤4≥1652.0%卡那霉素32128≤16≥6441.0%四环素16128≤4≥1653.1%多西环素8128≤4≥1646.6%氟苯尼考64256/≥1673.7%萘啶酸64256≤16≥3282.8%恩诺沙星264≤0.5≥254.4%环丙沙星264≤1≥444.0%甲氧苄啶/磺胺甲噁唑64256≤2≥493.8%
注:“ / ” 表示无耐药折点可参考。
2.3ESBLs基因的流行情况 采用PCR方法检测了ESBLs耐药基因,在373株大肠杆菌中,共有122株菌携带有ESBLs耐药基因,检出率为32.7%,其中CTX-M、TEM及OXA的检出率分别是18.0%(67)、12.1%(45)和7.5%(28),SHV基因未检出,并且CTX-M以CTX-M-9G的检出率最高14.7%(55/373),CTX-M-1G的检出率为3.2%(12/373)。CTX-M-9G亚型分析表明CTX-M-14最为流行(61.9%,38/55),其次是CTX-M-65(21.8%,12/55)和CTX-M-48(9.1%,5/55),其种系发育显示分离株主要分布在A群,其次是D群。CTX-M-1G主要以CTX-M-55亚型最为流行(83.3%,10/12),主要以A群为主。部分CTX-M阳性株还携带有其他的ESBLs基因,其中有10株菌同时携带CTX和TEM基因,另有8株菌同时携带CTX和OXA基因,试验结果见表4。
表4 大肠杆菌耐药基因CTX-M亚型及种系发育分布
Tab.4 Distribution of the subtype and phylogeny of theEscherichiacolicarried CTX-M genes
3 讨 论
本研究调查了福建地区猪源大肠杆菌对临床常用的12种抗菌药耐药情况,结果表明该地区猪源大肠杆菌耐药性较为严重,主要体现在耐药率及耐药水平均较高。对甲氧苄啶/磺胺甲噁唑、萘啶酸、氟苯尼考及氨苄西林的耐药率在70%~93.8%之间,并且MIC值大于等于64 μg/mL菌株数均超过50%,在51.2%~69.4%。β-内酰胺类药物作为兽医临床重药的抗感染药物,尤其是第三代头孢菌素,在本试验中分离株对头孢噻肟(30.8%)和头孢噻呋(35.9%)表现出较强的耐药性,与广东(34.5%,37.9%)和四川(40.4%,头孢噻呋)的报道相接近,但是明显低于贵州(93.29%,头孢噻呋)的耐药率,另一常用药氨苄西林的耐药率为70%,与广东,四川、贵州等地相似(79.3%~91.25%)[9-11],均处于在较高的耐药水平。β-内酰胺类药物耐药性快速增长,可能跟该类药物的大量使用有关。氟苯尼考作为广谱抗菌药同样被大量使用,本实验中氟苯尼考的耐药率高达73.7%,该结果与四川73.97%相似[9],但贵州地区的实验结果显示氟苯尼考的耐药率仅为21.95%[10],表现出相对较好的敏感性。
目前,ESBLs以TEM、SHV、CTX-M和OXA型较为常见,其中以CTX-M型最为流行[12-14]。到目前为止CTX-M型已有100多种,并可分为 5个亚群:CTX-M-1G、CTX-M-2G、CTX-M-8G、CTX-M-9G 和CTX-M-25G[15],并且在CTX-M阳性大肠杆菌中CTX-M-9G基因检出率最高[13, 16]。本研究在福建多个地区采集的373株大肠杆菌中,32.7%的菌株携带有ESBLs基因,高于2015年福建闽西的地区28.6%的检出率[17],其中CTX-M的检出率最高为18.0%,同样以CTX-M-9G最为流行(55/67),但是也有不同的情况,王基伟[18]及佐明开[19]对吉林和江西的研究结果表明,最为流行是TEM型,而非CTX-M型。
本研究显示CTX-M中最为流行亚型是CTX-M-14、其次CTX-M-65和CTX-M-55,然而2015年福建闽西地区调查结果显示,最为流行的亚型是CTX-M-15[17],与本试验结果明显不同,CTX-M-14属于CTX-M-9G,而CTX-M-15属于CTX-M-1G,并且CTX-M-15在本研究中未检出,说明在该地区流行的亚型很可能已经发生改变。2011年,郑红青等研究广东地区猪源产ESBLs大肠杆菌,结果表明CTX-M-14最为流行,其次是CTX-M-55和CTX-M-65[16]。然而2016年,靳婵调查广东地区屠宰前猪源大肠杆菌CTX-M流行情况时,发现不仅CTX-M的检出率相对较低,其流行的亚型也不一样,检出率最高的为CTX-M-55,其次为CTX-M-14和CTX-M-65[20],以上研究结果表明检出率和流行的亚型存在一定的差异,可能是与样品来源不同、地域差异及管理水平等因素有关。值得注意的是同一个养殖场,不同的样品来源,CTX-M的流行亚型也不同[21]。
种系发育是大肠杆菌分子流行病学的重要特征,根据TSPE4.C2、yjaA及chuA这三个基因的不同组合,可将大肠杆菌分为 A、B1、B2 和 D 这 4 个种系发育型。共生型大肠杆菌主要分布在A组,毒力因子较多的常常位于B2组和D组[22-24]。健康猪源大肠杆菌主要分布在A群和B1群,腹泻仔猪大肠杆菌分布在B2和D群的比例显著高于健康猪源[18]。有资料表明,动物源CTX-M-14和CTX-M-55基因阳性的大肠杆菌,其种系发育均以A组为主[13, 25]。本实验中,CTX-M-14、CTX-M-65和CTX-M-55,大多数属于A组,占CTX-M阳性菌的70.1%,与他人的研究结果一致,说明CTX-M阳性菌多数以共生型大肠杆菌为主。
利益冲突:无
