棘球蚴(包虫)病疫苗研究进展
2019-02-19,,,,2
,, ,, 2
绦虫蚴病(Metacestodiasis)是由绦虫的幼虫寄生在动物(包括人)体内引起的一类寄生虫病。带科(Taeniidae)的带属(Taenia)和棘球属(Echinococcus)绦虫的幼虫危害尤为严重[1-2],分别称为囊尾蚴(俗称囊虫)和棘球蚴(俗称包虫),它们通过消化道感染宿主,借助血液或者淋巴循环迁移到寄生部位,广泛寄生于草食性动物或杂食性动物(包括人)等的体内,分别引起囊尾蚴病(Cysticercosis,俗称囊虫病)和棘球蚴病(Echinococcosis,俗称包虫病)。棘球蚴病中危害最严重的是细粒棘球蚴和多房棘球蚴,分别引起中间宿主(包括人)的囊型棘球蚴病(Cystic echinococcosis, CE)和泡型棘球蚴病(Alveolar echinococcosis, AE),全球每年因棘球蚴病给畜牧业造成的经济损失和用于棘球蚴病患者的治疗费用合计高达30亿美元,仅囊型棘球蚴病每年可造全球1 000 000~3 000 000的伤残调整生命年(DALYs,disability adjusted life years)的损失(http://www.who.int/echinococcosis/epidemiology/en/);多房棘球蚴病更有“虫癌”之称,感染后未经治疗的多房棘球蚴患者的10年病死率可高达94%[3]。因此,带科绦虫尤其是棘球绦虫,不但对畜牧业的发展影响巨大,而且严重危害人类身体健康,在公共卫生学上具有重要意义[4-5]。
棘球蚴病不仅给养殖业造成了严重危害,而且人感染棘球蚴病的报道也居高不下,为了防治本病,驱虫药被大量投入使用,并取得了一定的效果,但是由于长期使用化学药物,出现了耐药性、药物残留、环境污染等一系列问题。而疫苗具有安全、无残留、动物无休药期、符合“预防为主,治疗为辅”工作方针等优点,是疫病防控的重要手段之一,同时现代生活中宠物数量越来越多,宠物主人对宠物的寄生虫防治更倾向疫苗防治,所以研制有效的寄生虫病疫苗对畜牧业发展和人民生活质量提高都有重要意义[6]。
棘球蚴疫苗研制经历了传统的六钩蚴、细胞培养物等组织细胞疫苗;到新型疫苗的出现,如多肽疫苗、核酸疫苗、基因工程亚单位疫苗、基因工程活载体疫苗、以及利用基因工程技术开发的转基因植物疫苗等。随着时代和技术的进步,更加理想的新型疫苗相信也会相继出现。总的来说,寻找具有更加高效、持久、广谱、简便、廉价、安全等优点的疫苗是疫苗研制发展的方向[7],下面对棘球蚴病疫苗研究进展做一综述。
1 组织细胞疫苗
早期的棘球蚴病疫苗主要是由棘球绦虫分泌物和代谢物、虫卵、六钩蚴或原头蚴分泌物、细胞培养物等制成的,免疫动物可以得到强的免疫保护力,朱兴全等[8]和Osborn等[9]分别对细粒棘球绦虫六钩蚴分泌物抗原性研究发现,其免疫保护力分别可达96.04%和99.40%,但是因为粗制抗原成分复杂,含有多种抗原蛋白[10],生产成本高,难以进行批量生产[11],并且饲养犬只可能会造成工作人员被感染,存在有公共卫生隐患等问题。所以随着分子生物学的发展,组织细胞疫苗不可避免地已被其他类型的疫苗所代替。
2 合成肽疫苗
棘球蚴病合成肽疫苗是根据棘球蚴的有效保护性免疫抗原中已知或预测的某段抗原表位的氨基酸序列,通过人工设计和合成的具有免疫原性的多肽疫苗。目前寄生虫病中研究较多的主要是疟疾和血吸虫病合成肽疫苗,合成肽疫苗在棘球蚴病和囊尾蚴病方面也有研究和应用。
Eg95蛋白广泛存在于细粒棘球绦虫六钩蚴、育囊生发层、原头蚴以及成虫体表[12],在细粒棘球绦虫生长发育中必不可少,这提示Eg95蛋白能够诱导宿主产生免疫保护。Woollard等[13]对细粒棘球绦虫的保护性抗原Eg95进行抗原表位分析,根据分析结果人工合成4条短肽,免疫羔羊试验显示这4条短肽仅具有免疫原性,能够诱导产生明显的特异性抗体,但没有反应原性,免疫保护力(0%)远不如Eg95(保护力高达99.8%),说明两种抗体之间存在着差异,这些多肽和Eg95疫苗对宿主免疫保护的关系还需后续研究。Woollard等[14]也对重组疫苗抗原Eg95的保护性多肽做了定位分析,结果表明Eg95疫苗诱导免疫应答的主要部位是构象表位,宿主的保护性抗原表位也是构象表位,这为棘球蚴病合成肽疫苗的研制提供了理论依据。
合成肽疫苗完全是人工合成,不含核酸,能够克服常规疫苗的一些缺陷,被认为是一种更加高效、简便、稳定、经济的疫苗,但是合成肽疫苗的抗原性及其免疫原性受自身组成及宿主免疫系统等多种因素的影响,并且发现免疫力不能垂直传递,新生仔猪对囊尾蚴仍易感,需要再次免疫[15],还有中和表位多为构象表位,这些问题都给合成肽疫苗的研制和推广应用带来了阻力。目前合成肽疫苗是预防和控制感染性疾病和恶性肿瘤的主要新型疫苗研制方向之一,在棘球蚴病中研究较少,所以更加有效、实用的棘球蚴病合成肽疫苗需要进一步的探究。
3 基因工程重组疫苗
基因工程重组疫苗是运用DNA重组技术,将编码病原保护性抗原的基因导入原核或真核表达系统,使其高效表达,提取保护性抗原肽链,加入佐剂即制成基因工程重组疫苗。与传统疫苗相比,基因工程疫苗具有以下优点:1)可大量生产,降低生产陈本;2)可以研制多价疫苗,达到一针防多病的目的;3)安全性好。总得来说,绦虫的保护性抗原主要有以下4类,即16K、18K、45W和Eg95(如表1所示),其保护率多高于95%[16],这些保护性抗原主要在绦虫六钩蚴时期表达,能够诱导宿主很好的免疫保护力,其中部分疫苗(如细粒棘球绦虫疫苗Eg95)已经商业化,所以有效的保护性抗原研究对疫苗制备至关重要。
表1 带科绦虫常见保护性抗原
Tab.1 The common protective antigens ofTaeniidaecestode
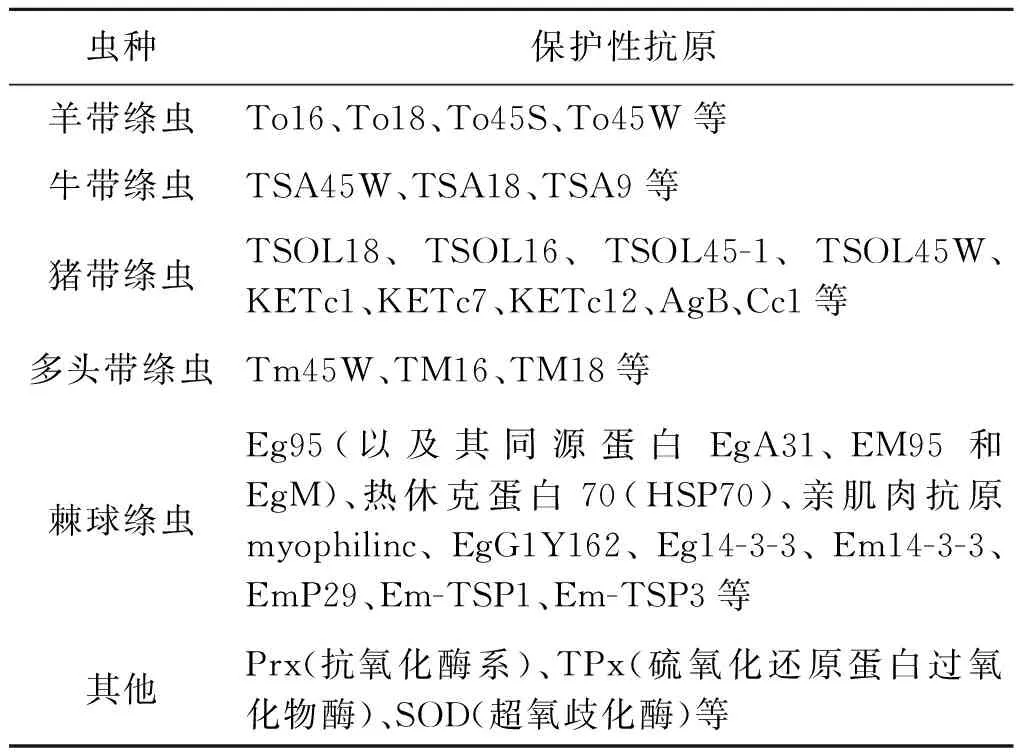
虫种保护性抗原羊带绦虫To16、To18、To45S、To45W等牛带绦虫TSA45W、TSA18、TSA9等猪带绦虫TSOL18、TSOL16、TSOL45-1、TSOL45W、KETc1、KETc7、KETc12、AgB、Cc1等多头带绦虫Tm45W、TM16、TM18等棘球绦虫Eg95(以及其同源蛋白EgA31、EM95和EgM)、热休克蛋白70(HSP70)、亲肌肉抗原myophilinc、EgG1Y162、Eg14-3-3、Em14-3-3、EmP29、Em-TSP1、Em-TSP3等其他Prx(抗氧化酶系)、TPx(硫氧化还原蛋白过氧化物酶)、SOD(超氧歧化酶)等
3.1 基因工程重组蛋白疫苗
3.1.1针对中间宿主的疫苗 近年来,随着组学和大数据时代的到来,多种棘球绦虫抗原靶分子被挖掘发现,其中,棘球绦虫Eg95重组蛋白的研究一直是棘球绦虫疫苗研究的热点,并取得了很大的进展,目前,重组蛋白的获取有多种途径,如大肠杆菌原核表达、酵母真核表达、昆虫杆状病毒表达等,不同的方法各有优缺点,真核表达系统具有分泌性高效表达外源蛋白、可对蛋白进行加工修饰(如糖基化、磷酸化和形成二硫键等功能)、蛋白更加接近天然状态等原核系统所不具备的诸多优点[17-18],在将来,真核表达系统将具有原核表达系统不可比拟的研究和开发潜力。
Eg95是迄今发现对细粒棘球绦虫最有效的保护性抗原,三次免疫接种能诱导绵羊高达99%的保护率,免疫保护时间能长达11个月[19];细粒棘球绦虫硫氧还蛋白过氧化物酶(EgTPx)在保护虫体免受宿主氧化损伤过程中起着关键的抗氧化作用,对虫体在人和其他中间宿主体内稳定寄生、生长和存活十分必要,王慧等[20]对EgTPx的编码基因进行原核表达,通过免疫小鼠,成功制备了EgTPx抗体(抗体效价高达1∶256 000),为包虫病疫苗和相关诊断试剂盒的研制奠定了一定的基础,也对疫苗研制提供了一个新的思路。
作者所在的实验室已获得毕赤酵母系统高效表达Eg95重组蛋白国家技术发明专利(申请号:CN201210103512.1),高密度发酵时上清中目的蛋白表达量在2 g/L以上,纯度超过90%,产业化前景十分诱人。王慧等[21]将细粒棘球绦虫的TPx基因在毕赤酵母中成功表达,获得了具有高效表达能力的EgTPx基因工程真核表达菌株,并检测到产物具有免疫反应性和抗氧化活性。目前,关于绦虫代谢的抗氧化酶系的报道较少,但是依据抗氧化酶系在其他寄生虫上的重要性推测,Prx或TPx在绦虫的抗氧化作用中起清除过氧化氢等方面将有开拓性的发现[22]。
杆状病毒表达系统最突出的特点就是能够获得高水平的蛋白表达,目的蛋白表达量最高可达到细胞总蛋白的50%[23],同时还具有安全性好、能同时表达多个基因、重组蛋白翻译后加工完整等特点。于琳琳等[24]成功构建获得了Eg95-(C3d)3重组杆状病毒表达系统,并且重组蛋白具有良好的免疫原性,同时证明用该重组蛋白检测羊棘球蚴抗体有良好的敏感性和特异性。
哺乳动物细胞表达系统虽然其表达产量相对其他真核表达系统低,但是翻译后加工更加精细,表达的蛋白质更加接近天然蛋白质,目前已成为多种生物药物的首选宿主细胞[25],王昌源等[26]成功构建了多房棘球绦虫elp基因的真核细胞COS7表达系统,绦虫蚴病疫苗在哺乳动物细胞表达系统中的研究工作相对较少,技术尚不成熟,有待进一步研究。
3.1.2针对终末宿主的疫苗 相对棘球绦虫成虫危害来说,棘球蚴对畜牧发展和人类健康造成的威胁远大于成虫,但是,成虫大量寄生在犬等终末宿主肠道,终末宿主可以向外界排放大量的虫卵,这使得犬等终末宿主成为棘球蚴病的主要传染源,所以研制针对棘球绦虫成虫病的疫苗对绦虫蚴病的防治也有重要的意义。EgA31是细粒棘球绦虫成虫发育调控的重要抗原蛋白之一,与原头蚴和成虫发育有密切关系,是疫病诊断和犬细粒棘球绦虫蚴病的疫苗研制的候选抗原[27],Petavy等[28]用沙门氏菌弱毒株成功制备了EgA31和EgTrp口服重组疫苗,对犬口服免疫,感染26~29 d后剖检十二指肠发现,免疫犬细粒棘球绦虫的荷虫量减少了70%~80%,并减缓了虫体发育的速度;EgM家族重组蛋白可以抑制了虫体生长,尤其是虫卵和胚胎的发育,由egm4、egm9和egm123三种蛋白编码基因构建的重组疫苗,用原头节对犬攻虫,这三种蛋白可以诱导犬高达97%~100%的保护率[29]。
3.2基因工程重组病毒载体活疫苗 重组病毒载体活疫苗是人类免疫接种中应用最广泛的疫苗,在天花、狂犬病、鼠疫等疫病的防控中起了重要作用,重组病毒载体活疫苗具有重组体用量少,抗体不需要纯化,载体本身可发挥佐剂的作用等优点,同样也具有一定的缺点:如感染或者接种过该病毒的动物或者人,对该载体病毒具有了免疫记忆,会影响免疫接种效果。
痘病毒常作为重组疫苗病毒(Recombinant vaccinia virus, VACV)载体,在基因工程重组载体病毒活疫苗中有广泛应用。羊口疮病毒(Orf virus)属于痘病毒科副痘病毒属的双链DNA病毒,能够引起绵羊、山羊和人严重的皮肤病变。Tan等[30]用羊口疮病毒作为VACA,构建Eg95载体病毒活疫苗,目的是获得双价疫苗,结果产生针对羊口疮病毒和针对Eg95的两种特异性抗体,并且针对Eg95抗原的抗体水平与用纯化抗原制备的疫苗水平相当,此实验结果表明,羊口疮病毒活载体疫苗有望成为新一代的二联重组疫苗。同样,Dutton等[31]将重VACA作为Eg95蛋白的传输载体,将Eg95蛋白的编码基因插入VACV中,成功构建了重组痘病毒疫苗VV399,绵羊和小鼠试验结果显示该疫苗可以诱导免疫动物产生特异性抗体,并且免疫后的动物血清对六钩蚴也有一定的杀伤作用。
3.3基因工程重组细菌载体活疫苗 同重组病毒载体活疫苗一样,重组细菌载体活疫苗也有上述类似的优缺点。减毒沙门氏菌载体作为口服活疫苗载体具有广泛的应用价值,是新型疫苗研究的热点之一[32],王志昇等[33]成功构建了以减毒鼠伤寒沙门氏菌(Salmonellatyphimurium)为载体的细粒棘球绦虫Eg95蛋白的口服活载体疫苗,通过灌胃BALB/c小鼠四周后抗体水平高达1∶1 700,并且安全性实验显示安全性良好,说明该细菌载体活疫苗具有良好的免疫原性和安全性。
4 核酸疫苗
核酸疫苗又称DNA疫苗,是通过宿主接种编码特定抗原蛋白的核酸,使其在宿主体内表达,刺激宿主对该抗原蛋白产生特异性免疫应答反应,达到预防和治疗疾病的目的。核酸疫苗是继灭活疫苗、减毒疫苗、基因工程重组亚单位疫苗之后的“第三代”疫苗,目前疟疾、弓形虫病、血吸虫病、棘球蚴病、囊尾蚴病等寄生虫病的预防也开始应用核酸疫苗,并显示有广阔的应用前景[34]。
林仁勇等[35]用pcDNA3-Eg95核酸疫苗免疫BALB/c小鼠,探讨其诱导小鼠的体液和细胞免疫效果,结果显示此核酸疫苗能够在小鼠体内产生明显的免疫反应。丁剑冰等[36]用细粒棘球绦虫的Eg95核酸疫苗与Eg95重组亚单位疫苗做了比较,发现用前者免疫接种的小鼠产生IgG抗体滴度水平(1∶3 200)低于后者(1∶25 600),但IgG2a亚类抗体水平却明显高于重组蛋白免疫实验组,这证明了细粒棘球绦虫Eg95重组抗原和核酸疫苗均可诱发小鼠产生特异性免疫应答。杨娇馥等[37]将构建的重组质粒pcDNA3·1-eg95转染绵羊胎儿成纤维细胞,检测结果发现eg95基因在绵羊胎儿成纤维细胞中得到了转录,这为利用pcDNA3·1-eg95制备实用的棘球蚴病核酸疫苗提供了科学依据。
总之,核酸疫苗与普通疫苗相比具有更加快速、方便、特异性高、无危害性等优点,除此之外,核酸疫苗因其经济成本较低,易与运输和储存,可以诱导机体产生全面的免疫反应,有制备多价苗的潜力(对不同亚型的病原体有交叉防御作用),并且核酸疫苗可以在免疫动物体内直接表达,具有很好的应用前景[38],但是绦虫蚴病核酸疫苗研究较少,技术路线尚不成熟,安全性评估还存在很多的问题[39],还需要进一步的研究。
5 转基因植物疫苗
转基因植物疫苗具有易运输、可大规模生产、成本低廉、易获得多价苗、使用方便(直接食用就可以较强的体液和黏膜免疫反应)等优点,苜蓿是草食性动物主要的饲料来源,并且蛋白含量高,营养丰富,所以常被选作是转基因植物疫苗的对象。周辉等[40]对转细粒棘球绦虫Eg95-EgA31融合基因苜蓿疫苗载体进行了成功的构建,叶艳菊等[41-42]在其基础上研究了该疫苗的保护力及其免疫机制,结果表明转基因苜蓿叶的蛋白提取液经口服和滴鼻接种都能诱导免疫鼠产生一定的保护力,并且Th1型免疫应答在免疫保护机制中起重要作用。
6 多价苗和联苗
多价疫苗和联苗对疫病的防控实施有重要的意义,多价苗和联苗可以避免多次免疫,降低基层工作压力,减少人力、物力的消耗,减少被接种动物的应激反应次数,到达一针防多病的目的。基因工程疫苗和核酸疫苗都具有多价苗和联苗研制的潜力,所以有很大的发展空间,如上文描述的基因工程重组羊口疮病毒活疫苗,就是一种对羊口疮病毒和细粒棘球蚴感染同时有免疫预防作用的二联苗[30];细粒棘球绦虫种内变异现象非常突出,G1(绵羊株)和G6(骆驼株,现命名为加拿大棘球绦虫,E.canadensis)基因型在家畜中分布最为广泛,pET30a-EgA31-Eg95重组质粒的成功构建[43],对棘球蚴病多价疫苗的开发有重要指导作用,如可以研制棘球蚴病Eg95-Ec95基因工程重组亚单位双价疫苗;pTc-sp7核酸疫苗就是一种对肥头绦虫和猪带绦虫成虫及其六钩蚴有高保护率的联苗[44]。总得来说,绦虫蚴病种类繁多,危害严重,研制有效的联苗和多价苗是一个亟待解决的问题。
7 其 他
随着科学技术的发展和研究的不断深入,绦虫蚴病疫苗除了以上所述外,新型疫苗也会层出不穷:1)重组噬菌体疫苗作为新型疫苗,可以诱导机体产生较高的免疫保护力,并且生产成本低,具有普通疫苗没有的优点,是理想的新型疫苗之一,已有试验证明噬菌体可以诱导猪的体液免疫和细胞免疫[45];2)微胶囊可控缓释疫苗使用微胶囊技术将特定的抗原包裹后制成的疫苗,缓冲胃酸等消化液的消化,绦虫成虫又多寄生在肠道,这对绦虫蚴病(包括棘球蚴病)疫苗的研制有一定的指导作用;3)树突状疫苗在肿瘤免疫中取得了一定的成功,多房棘球蚴病生长为浸润性生长,与肿瘤相似,有“虫癌”之称,相信不久的将来树突状疫苗也会在包括棘球蚴病在内的绦虫蚴病中得到应用。
8 小结与展望
棘球蚴病是一类严重的人兽共患寄生虫病。随着对抗寄生虫药物耐药性和药物残留等副作用的逐渐关注和重视,抗寄生虫疫苗被广泛接受和研发,疫苗作为有效防治疫病的手段之一,具有很好的应用前景。虽然绦虫(蚴)病(包括棘球蚴病)疫苗已有组织细胞疫苗、合成肽疫苗、DNA疫苗、基因工程疫苗、转基因苜蓿疫苗、以及重组双歧杆菌疫苗等多种类型疫苗的研究,对绦虫蚴病的防控、畜牧业发展、食品安全以及人类身体健康等有重要意义,但是更加有效、实用、安全的绦虫(蚴)病疫苗的研制还有很长的路要走。
目前,棘球蚴病疫苗还存在众多问题。一、疫苗研制中宿主动物数量是否符合统计学意义对试验结果的可靠性有重要作用,许多已发表的试验结果不能有效、明确的评估实验结果的优劣[46];二、目前绦虫(蚴)病疫苗针对性单一,大多数研究对象是绦虫六钩蚴时期的保护性抗原(如16K、18K、45W和Eg95四类抗原),而对参与绦虫代谢的抗氧化酶系、水解酶等研究较少,并且,目前绦虫(蚴)病疫苗的研制多为只针对某一种病,所以研制针对寄生虫多个阶段的多价疫苗和同时可以预防多种寄生虫的多联疫苗,都是值得思考的问题;三、表达系统的问题,真核和原核表达都存在各自的优点和缺点[17, 47],所以说,如何选择有效的表达系统,是实验前必须考虑的问题,表达量高、成本低、蛋白更接近天然构象的表达系统是亟待解决的问题之一;四、目前棘球蚴病疫苗仅限于兽用疫苗的研制,还没有人用疫苗被研制成功,所以在未来,研制有效的人用棘球蚴病疫苗,在高危人群中使用,对广大牧民以及从事相关工作人员的身体健康具有重要的公共卫生意义。
随着生物技术的不断发展,棘球蚴病疫苗的研究有了更多的思路和方法。首先,通过人工化学合成技术制备疫苗,可以有效解决一些病原体不能在体外培养获得足够抗原的困境,在未来疫苗领域有很大的应用空间;其次,随着测序和高通量筛选技术的发展,为靶抗原的筛选提供了有力的技术支撑,以及长链非编码RNA(Long non-coding RNA, lncRNA)、微小核糖核酸(MicroRNAs, miRNAs)等非编码序列的广泛研究为疫病疫苗的研制提供了新的思路[48];而且,高效基因编辑技术(CRISPR/Cas9)的出现和广泛应用,一方面为新基因功能研究和疫苗候选分子筛选开启了新的道路,另一方面,通过基因编辑改良的家畜新品种和动物模型研究成为可能(已有抗朊病毒的基因缺陷牛模型[49]),这些对疫病防控、畜牧业发展、公共卫生等都有重要的意义。
利益冲突:无
