结核分枝杆菌环丝氨酸药物敏感性及耐药机制研究
2019-02-19,,,,
,,,,
耐药结核病是造成结核病疫情居高不下的主要因素之一,MDR-TB(耐多药结核病)及XDR-TB(广泛耐药结核病)的治疗是控制耐药结核病的关键。环丝氨酸(Cycloserine,Cs),1982年就被美国FDA批准上市,其抗结核分枝杆菌的作用弱于异烟肼及链霉素,世界卫生组织最新的耐药结核病治疗指南[1]将环丝氨酸列入治疗MDR-TB的核心药物之一。根据国内外已有的报道提示结核分枝杆菌对环丝氨酸的耐药率较低[2-5],然而近年来,随着指南的出台及耐药结核病疫情的控制压力,国内外使用环丝氨酸的病例在逐步增多,却仍然缺乏可靠的环丝氨酸的药敏实验方法,也缺乏目前流行的结核分枝杆菌(Mycobacteriumtuberculosis, MTB)对该药的耐药情况的了解。因此,本研究通过一定数量的MTB临床分离株的药敏试验,了解MDR-TB及XDR-TB临床分离株对环丝氨酸的耐药情况,为未来有效的优化抗结核方案提供可靠的依据。目前国际上对环丝氨酸采取的药敏方法大都是以罗氏固体培养基为基础的绝对浓度法和比例法[2-5],该培养基的制作需要加热[6],药物存在着一定程度的损失,因此,本研究选取Middlebrook 7H9液体培养基,在96孔板中建立液体药敏实验方法,根据对140株耐药MTB临床分离株及37株全敏MTB临床分离株的MIC结果,寻找判定MTB对环丝氨酸耐药的临界值。
在环丝氨酸耐药机制的研究中,环丝氨酸可能起作用的靶标基因点为Ald、Alr、ddlA,由于目前研究耐药机制的方法都是将基因克隆、转化到大肠杆菌中进行研究[7-8],并非针对来自临床的环丝氨酸耐药的分离菌株进行研究,因此,本研究通过上述的液体药敏法从临床病人的痰标本MTB分离株中筛选出环丝氨酸耐药的菌株,并随机抽取对环丝氨酸敏感的菌株,与H37Rv标准株一起,提取DNA和RNA,针对Ald、Alr、ddlA基因点设计引物,分别进行PCR基因扩增及Real-time PCR扩增,分析对环丝氨酸耐药株有无明确的基因突变或有无基因表达量的变化,为建立环丝氨酸耐药的快速分子检测方法提供理论依据。
1 材 料
1.1菌株来源 结核分枝杆菌标准株(H37Rv ATCC27294)购自国家菌种保藏中心,177株MTB临床分离株来自上海市肺科医院结核科收治的患者,其中100株MDR-TB、40株XDR-TB及37株全敏MTB临床分离株。肺结核病的诊断遵循中华医学会结核病分会制定的《肺结核诊断和治疗指南标准》。对临床标本判断是否耐药的实验室药敏方法为BACTEC MGIT 960法,MDR-TB指体外药敏实验证实至少同时对异烟肼和利福平耐药的MTB, XDR-TB指体外药敏实验证实至少同时对异烟肼和利福平耐药外,还对任何氟喹诺酮类药物耐药,以及3种二线注射类药物(卷曲霉素、卡那霉素和阿米卡星)中的至少1种耐药的结核病。全敏MTB是指使用BACTEC MGIT 960法检测对所有检测的药物(异烟肼、利福平、链霉素、乙胺丁醇、氧氟沙星、卷曲霉素、阿米卡星)均敏感[9]。
1.2主要试剂与仪器 环丝氨酸药物、吐温-80购自美国 Sigma公司;药敏培养基所用的药物Middlebrook 7H9 Broth、Middlebrook OADC Enrichment均购自美国Becton, Dickinson and Company;结核分枝杆菌的分离培养中所用的营养增菌液参考《结核病诊断实验室检验规程》[6]于实验室中自制;注射用青霉素钠购自华北制药股份有限公司;GNP一92700 隔水式培养箱购自上海精宏实验设备有限公司。
2 方 法
2.1试剂配置 液体培养基的配置:向270 mL Middlebrook 7H9液体培养基中加30 mL Middlebrook OADC Enrichment、750 μL 5%的吐温-80、加入青霉素使其终浓度为100单位/mL。药物配置:环丝氨酸用上述液体培养基配制,然后用0.22 μm无菌滤器(美国Millpore 公司)过滤除菌 ,分装保存于-70 ℃,实验前将含环丝氨酸的液体培养基加入96孔U型培养板中,每孔100 μL,将配好的药敏板置于37 ℃恒温培养箱过夜,若没有污染,则可进行下一步实验。
2.2MIC检测 按《结核病诊断细菌学检验规程》规定要求进行分离培养、分枝杆菌菌种初步鉴定。将待检结核分枝杆菌临床分离株转接到5 mL的Middlebrook 7H9液体培养基中,在37 ℃恒温培养箱中培养两周后,加人玻璃珠在涡旋振荡器上磨菌5~10 min后静置10~15 min,取上层均匀的悬浊液用Middlebrook 7H9液体培养基比浊至1 mg/mL待用。在含药96孔U型板中,每孔加入稀释后的100 μL含有菌液的液体培养基,使菌液终浓度为10-2mg/mL,加入菌液后药物的终浓度为128,64,32,16,8,4,2,1 μg/mL,同时设置100%菌量生长对照孔、10%菌量生长对照孔、1%菌量生长对照孔和阴性对照孔,贴上封板膜 ,37 ℃恒温培养,每天观察 1 次结果,2周后记录每株菌的MIC结果。
2.3结果读取 用放大镜观察并记录结果,孔底出现肉眼可见白色菌体沉淀的为阳性,无肉眼可见菌体沉淀的为阴性,每个药物出现阴性的最低药物浓度为 MIC值。
2.4质量控制 每次实验均以H37Rv为质量控制,同一菌株的 MIC 值重复检测 3 次。
2.5PCR基因扩增及测序 根据MIC结果,筛选出3株对环丝氨酸耐药MTB菌株和53株对环丝氨酸敏感的MTB菌株,与H37Rv标准株进行培养两周后抽提基因组DNA。运用PrimeSTAR PCR反应试剂(购自Takara公司),配制50.0 μL反应体系:10.0 μL 5×PS Buffer,4.0 μL dNTP Mix,0.5 μL Prime STAR,正向、反向引物(10 μmol/L,引物序列见表1)各1.0 μL,DNA模板2.0 μL,补加ddH2O至50.0 μL,于PCR仪器上运行程序:95 ℃ 10 s,65 ℃ 10 s,72 ℃ 30 s×35;72 ℃ 7 min×1;4 ℃ ∞。制作1%的琼脂糖凝胶,扩增结束后,进行电泳检测,扩增成功的送华大基因公司进行基因测序。运用BioEdit、DNAMAN和Chromas软件对测序成功的序列进行比对分析。
表1 PCR扩增引物序列
Tab.1 Primer sequence of PCR amplification

基因名称引物名称引物序列(5'→3')片段大小Ald2780F:CCTCATCAAGTTCAGCGGGT1 216 bpR:CTTCCCTTACTCCCGACGTGAlr3423F:CACTGCAACTGTTTCCTGCC1 327 bpR:CTTTCGGTCGTCTGCGGATAddlA2981F:TGCGTCGTCGAGATACTTGG1 000 bpR:TCATAAAGGGCTGTCGGTGG
2.6Real-time PCR 根据MIC结果,筛选出3株环丝氨酸耐药株及53株环丝氨酸敏感株,与H37Rv标准株一起进行培养2周后抽提RNA。运用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(购自Takara公司),根据说明书配制反应体系并对RNA进行逆转录,得到cDNA。再运用SuperReal PreMix(SYBR Green)试剂盒(购自TIANGEN公司),进行Real-time PCR反应。首先向每支2×SuperReal PreMix Plus中加入50 μL 50×ROX Reference Dye,之后于冰上配制20.0 μL 反应体系:10.0 μL 2×SuperReal PreMix Plus,正向、反向引物(10 μmol/L,引物序列见表2)各0.6 μL,5.0 μL cDNA,补加RNase Free ddH2O至20.0 μL。配制好后,于荧光定量PCR仪(ABI 7500)中运行程序:95 ℃ 15 min×1;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 1 min×40。
表2 Real-time PCR引物序列
Tab.2 Primer sequence of real-time PCR

引物名称引物序列(5'→3')SIGAF:GAGATCGGCCAGGTCTACGGCGTGR:CTGACATGGGGGCCCGCTACGTTGmRNA2780F:GCACCACGTCAATTGCCTACR:GGGTTCGCATCAGGTGGTAAmRNA3423F:TCGCATATGGTTTACGCCGAR:GATAGATGCGCCACCTCGAAmRNA2981F:AATGCGGTGTGCTCGAAATGR:TGCGTCGTCGAGATACTTGG
2.7统计学分析 运用Origin 9.0对177株MTB临床分离株的MIC结果进行作图分析。采用SPSS 19.0对数据进行统计学分析。
3 结 果
3.1MTB临床分离株的MIC结果 100株MDR-TB、40株XDR-TB及37株全敏MTB的MIC结果显示,由表3及图1可见,耐药和全敏MTB的MIC值大小及分布没有太大的差别,对其进行统计学分析,P=0.681>0.05,表明差异不存在统计学意义。与敏感MTB菌株比较,两组的MIC无明显差异,证明目前大多数的MDR的结核分枝杆菌菌株大部分也对环丝氨酸敏感,在MIC检测数值中发现耐药菌株中(MDR-MTB、XDR-MTB)仅有几株MIC值较高,最高达32 μg/mL,大部分耐药菌株的MIC值介于8~16 μg/mL之间,因此,本研究将微量液体药敏方法中界定结核菌对环丝氨酸耐药的药物浓度值初步定为32 μg/mL,即MIC≥32 μg/mL的MTB菌株为对环丝氨酸耐药,反之则敏感。根据这个结果,计算得出在140株耐药MTB临床分离株对环丝氨酸的耐药率仅为4.28%。由此推测,目前临床上病例即便是MDR-TB和XDR-TB对环丝氨酸仍然敏感,将环丝氨酸用于MDR-TB和XDR-TB治疗理论上具有较高的疗效。
3.2PCR基因扩增测序结果 根据MIC结果,筛选出3株对环丝氨酸耐药的MTB和53株对环丝氨酸敏感的MTB以及H37Rv标准株,对Ald、Alr、ddlA基因位点进行PCR扩增及测序,结果表明,无论是对环丝氨酸耐药的MTB还是敏感的MTB,Alr和ddlA基因点皆无突变;而Ald启动子处大部分MTB都发生了突变(见表4)。因此,我们对Ald启动子处的突变和MTB是否对环丝氨酸耐药进行了Fisher相关性分析,P=0.155>0.05,由此进行推测,该点的突变与菌株是否对环丝氨酸耐药可能不相关。
表3 140株耐药MTB和37株全敏MTB菌株MIC值分布(株)
Tab.3 MICs of 140 strains of drug-resistant and 37 strains of drug-susceptible MTB
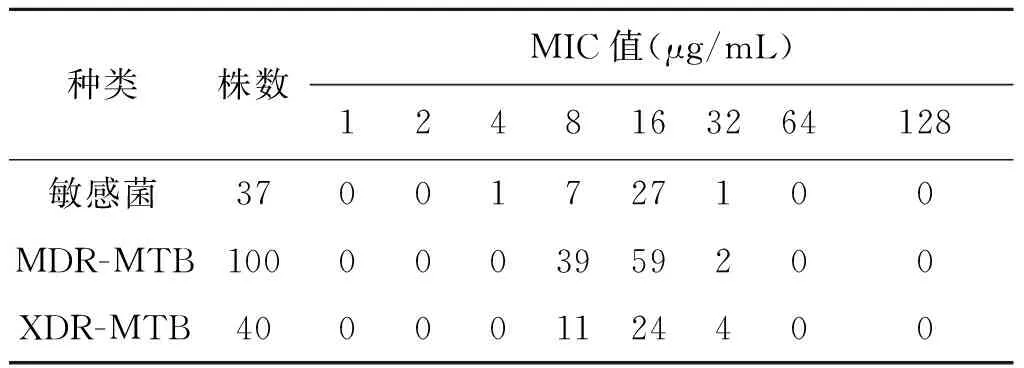
种类株数MIC值(μg/mL)1248163264128敏感菌37001727100MDR-MTB1000003959200XDR-MTB400001124400
注:敏感菌和XDR-MTB中各有一株未长

图1 140株耐药结核分枝杆菌和37株全敏结核分枝杆菌的MIC值Fig.1 MICs of 140 strains of drug-resistant and 37 strains of drug-susceptible mycobacterium
表4 结核分枝杆菌对环丝氨酸耐药性×Ald启动子有无突变交叉制表
Tab.4 Tuberculosis resistance to cycloserine in the mutation ofAldcross tabulation
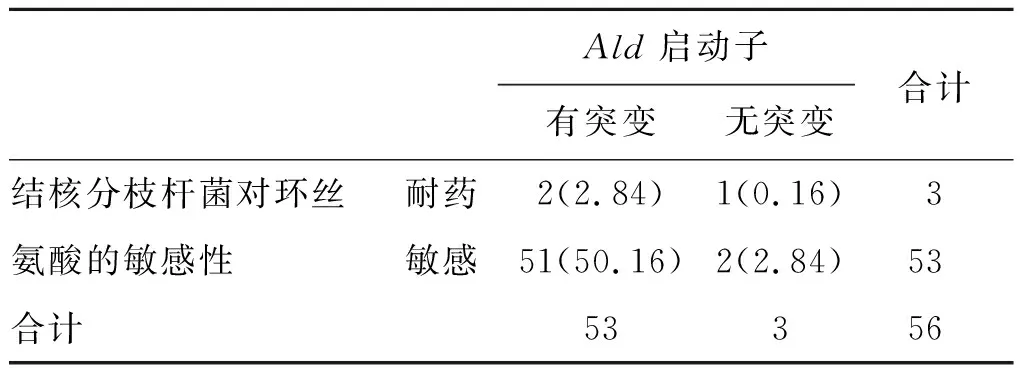
Ald启动子合计有突变无突变结核分枝杆菌对环丝耐药2(2.84)1(0.16)3氨酸的敏感性敏感51(50.16)2(2.84)53合计53356
3.3Real-time PCR扩增结果 根据图2,可以明确的看到对环丝氨酸耐药及敏感的MTB在Ald、Alr及ddlA处基因表达量的对比,对其进行统计学分析(见表5),结果表明,对环丝氨酸耐药及敏感的MTB在Ald、ddlA处基因表达量无统计学差异,环丝氨酸耐药菌Alr基因表达量高于环丝氨酸敏感菌,差异具有统计学意义,P=0.0003。因此,结核分枝杆菌中Alr基因的过表达可作为提示环丝氨酸耐药的标志。
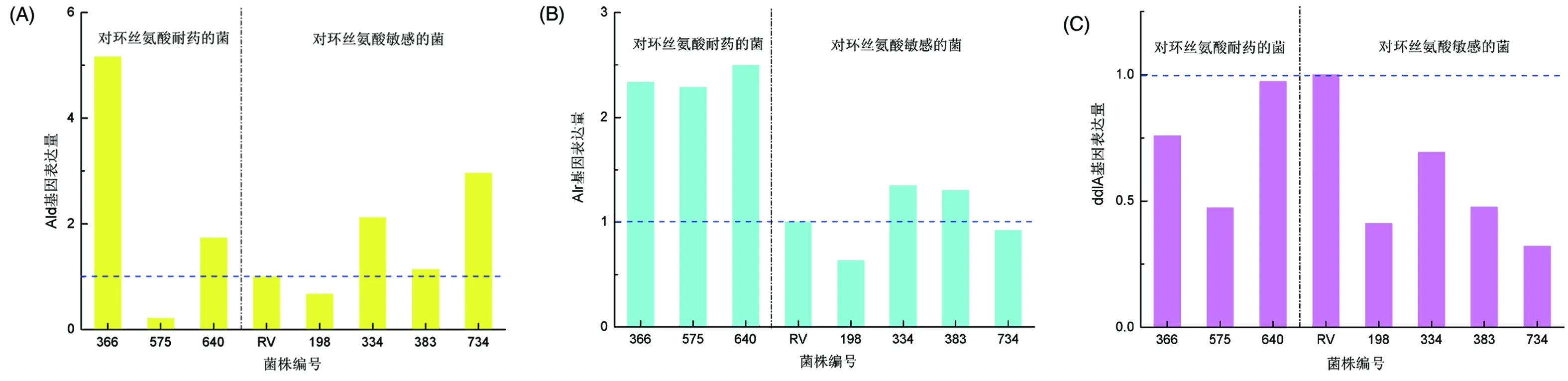
图2 (a)(b)(c)分别为对环丝氨酸耐药和敏感结核分枝杆菌的Ald、Alr、ddlA点基因表达量Fig.2 (a) (b) (c) is the gene expression of D-cycloserine-resistant and susceptible in Ald, Alr, ddlA respectively
表5 对环丝氨酸耐药和敏感的MTB基因表达量统计学差异
Tab.5 Statistically differences in gene expression level between D-cycloserine-resistant and D-cycloserine-susceptible mycobacterium

P值Ald表达量Alr表达量ddlA表达量对环丝氨酸耐药的MTB0.536>0.050.0003<0.050.454>0.05对环丝氨酸敏感的MTB
4 讨 论
结核病是危害人类健康的重大传染病之一,我国的结核病疫情位居全球第3,最近数据显示全球新发结核病人1 040万[10]。由于管理、药物、患者方面以及HIV/AIDS流行、缺乏抗结核新药等因素的存在,造成了耐药结核病的发生及流行,这对结核病有效护理和预防结核病全球化产生了一定程度的阻碍。MDR-TB及XDR-TB治疗成功率低下。我国仍然是MDR-TB高负担国家。临床上需要一种有效药来对治耐药结核病,环丝氨酸是美国于上世纪70年代研制出的产品,由于其具有精神、神经系统的副作用,长期以来得不到临床的广泛应用。该药在近五年的时间内逐步在国内外得到广泛应用,本研究则是从大批量的来自临床的MDR-TB菌株进行环丝氨酸耐药检测及机制方面的初探。
首先从耐药检测方法的探索方面,目前对MTB环丝氨酸的药敏检测方法是以罗氏固体培养基为基础的绝对浓度法和比例法,近年来国内外有少数研究进行了对该药的耐药率检测,比如俄罗斯一项研究[3]2001-2002年间采用比例法测得69株MDR-TB对环丝氨酸的耐药率为7.4%。韩国[5]2010-2014年间用绝对浓度法测得378例MDR-TB对环丝氨酸的耐药率仅为7.1%。陈松华等[11]使用绝对浓度法,对浙江省30个县区抽取的1077株结核分枝杆菌测得的环丝氨酸耐药率仅为5.77%,赵冰等[12]采用比例法,对从耐药基线调查点选取的126株MDR-TB测得的环丝氨酸耐药率为13.5%,相比于其他抗结核药物MTB对环丝氨酸的耐药率是较低的。但绝对浓度法和比例法无法准确判断MTB对环丝氨酸耐药的临界值并且药物存在热损失,本研究针对上述问题,建立了微量MIC法检测结核分枝杆菌的耐药性,并用临床分离株进行初步验证。通过对177株MTB临床分离株的微量MIC值判断结果显示,耐药MTB和全敏MTB的MIC值无统计学差异,且绝大部分菌株的MIC都介于8μg/mL-16μg/mL之间,只有个别菌株的MIC值为32 μg/mL,因此,将微量MIC法中界定MTB对环丝氨酸耐药的药物浓度值初步定为32 μg/mL,即MIC值高于或等于32 μg/mL的为耐药,反之则敏感,从而计算出140株耐药MTB临床分离株对环丝氨酸的耐药率仅为4.28%,这说明环丝氨酸在治疗耐药性结核分枝杆菌中有应用价值,值得在临床上推广应用。
其次从耐药机制的探索方面,环丝氨酸是D-丙氨酸类似物,与其他药物无交叉耐药性,作为二线抗结核药物用于MDR-TB和XDR-TB的治疗[13]。Ald、Alr和ddlA基因分别编码L-丙氨酸脱氢酶、丙氨酸消旋酶和D-ala-D-ala连接酶,与MTB细胞壁的形成有关,Ald在NADH的参与下催化丙酮酸转化为L-丙氨酸,Alr将L-丙氨酸转换为D-丙氨酸,两个D-丙氨酸分子通过ddlA连接成二肽,进一步形成细胞壁的肽聚糖肽链,环丝氨酸可能通过作用于Ald、Alr及ddlA基因,抑制L-丙氨酸脱氢酶、D-Ala-D-Ala连接酶和D-丙氨酸的消旋酶的作用,阻碍肽多糖的生物合成,进而使结核分枝杆菌的细胞壁缺损[13-15]。研究表明在BCG和耻垢分枝杆菌中过表达Alr基因和ddlA基因可以提高对环丝氨酸的耐药[8, 16],当Alr基因和ddlA基因失活后耻垢分枝杆菌对环丝氨酸的易感性增加[17]。于霞[18]等人指出Alr编码基因的突变会影响细菌对环丝氨酸的耐药性。Desjardins C A[19]等人检测敏感MTB菌株、耐药菌株、Ald敲除菌株的环丝氨酸MIC,结果显示Ald敲除菌株的环丝氨酸MIC值大于敏感MTB菌株的MIC,小于耐药菌株的MIC,表明Ald基因缺失增加MTB对环丝氨酸的耐药性。Gareth A[20]等人用基于代谢组学的稳定同位素质谱方法研究发现,D-环丝氨酸的异构体L-环丝氨酸可以抑制Alr基因的表达,对ddlA基因没有影响,当外源补充D-丙氨酸或L-丙氨酸时可缓解L-环丝氨酸对Alr基因的作用,说明L-丙氨酸可以与Alr竞争结合L-环丝氨酸。CycA是细菌丝氨酸/L -丙氨酸/甘氨酸/ D-环丝氨酸的质子转运体,含有12个氨基酸转运子形成的螺旋跨膜区,属于AAT家族[21],Jeffrey M. Chen[22]等人研究发现CycA位点突变可导致BCG疫苗株对D-环丝氨酸产生耐药性。我们根据177株MTB的MIC测定结果,筛选出对环丝氨酸耐药/敏感的MTB,对Ald、Alr、ddlA基因位点进行PCR扩增及Real-time PCR扩增,分析得出,对环丝氨酸耐药的MTB确实存在Alr基因的过表达,但是并没有发现明确的基因突变点。
从该研究的结果看出,微量MIC法检测MTB对环丝氨酸的耐药率仅为4.28%,因此目前临床使用环丝氨酸用来治疗MDR-TB应该非常有效。尚未发现环丝氨酸明确的耐药突变位点,但Alr基因的过表达与MTB环丝氨酸耐药高度相关,其可能是环丝氨酸耐药的新机制。未来的研究需要进一步寻找与MTB环丝氨酸耐药相关的基因新位点。
利益冲突:无
