基于表面增强拉曼光谱的养殖水中硝基呋喃类抗生素残留检测
2019-02-18,*
,*
(1.上海市食品药品检验所,上海 201203; 2.赛默飞世尔科技(中国)有限公司,上海 201206)
硝基呋喃类药物(Nitrofurans)是一类人工合成的具有5-硝基呋喃基本结构的广谱抗菌药物,常用的有呋喃唑酮(Furazolidone,FZD)、呋喃西林(Nitrofurazone,NFZ)、呋喃妥因(Nitrofurantion,NFT)和呋喃它酮(Furaltadone,FTD)等,4种呋喃类抗生素分子结构式如图1所示。硝基呋喃类作为广谱性抗菌药曾广泛应用于畜禽和水产养殖业中,用于治疗因革兰氏阴性菌、真菌和一些原虫引起的疾病[1]。但由于该类药物及其代谢物具有显著的致畸、致癌、致突变等毒性作用,欧盟、美国、日本等多个国家都明令禁止其在水产养殖中的应用[2-4],我国农业部也于2002年在第193号公告中规定禁止在食用动物上使用硝基呋喃类药物[5]。但因硝基呋喃类药物的价格低廉且药效显著,在水产养殖中仍常有违法使用的情况,水产养殖动物中硝基呋喃类药物残留仍不容乐观。根据近年来的风险隐患排查结果,硝基呋喃仍是检出率最高的违禁药物之一[6]。

图1 四种硝基呋喃类抗生素的分子结构式Fig.1 Molecular structures of four nitrofuran antibiotics
因硝基呋喃类药物半衰期很短,在动物体内能迅速代谢,目前硝基呋喃类药物的残留检测对象主要集中于其代谢物的检测,分析手段包括高效液相色谱法[7-8]、液相色谱-质谱联用法[9-10]、免疫分析法[10-12]等。其中,高效液相色谱法和液相色谱-质谱联用法样品前处理过程复杂、分析周期长、有机溶剂消耗量大,且对操作者专业能力要求较高,不便于基层推广使用。酶联免疫法易受外界环境干扰,易发生交叉反应,假阳性率较高。在水产养殖过程中硝基呋喃类药物往往是直接投喂使用,造成其可能未经过生物体代谢而直接在池塘的底泥沉积物中不断蓄积,随着外界环境的变化进一步向水体中缓慢释放,产生二次污染,由此导致的质量安全问题亟待解决[4,13-14]。目前针对养殖环境中的生产养殖及流通过程中硝基呋喃类抗生素残留测定的方法相对较少,有必要建立准确、可靠、快速的检测方法,从源头上对水产品生产养殖和流通环节进行安全监控。
表面增强拉曼光谱技术克服了传统拉曼光谱灵敏度低的缺点,能够实现痕量物质的检测,同时还具有无需样品前处理(或前处理简单)、检测速度快、易实现现场检测等优点[15]。因此,目前已广泛应用于食品快检、环境监测、生物医学等领域,在食品中农兽药残留、限用或禁用添加剂中已展现出良好的应用前景[16-18]。
结合便携式拉曼光谱仪,本研究拟建立一种利用表面增强拉曼光谱快速检测养殖水中硝基呋喃类药物残留量的方法,为生产、流通环节中硝基呋喃类药物残留的现场、快速检测探索新的途径和方法。
1 材料和方法
1.1 材料与仪器
空白试样的选择 选取鱼养殖用水作为空白试样,购自上海本地菜场,按确证方法SZDB/Z 323-2018 《水产品养殖水中21种磺胺类、氯霉素类、四环素类、硝基呋喃类、喹诺酮类和孔雀石绿的测定高效液相色谱-串联质谱法》进行检测,经测试不含硝基呋喃类抗生素;呋喃妥因、呋喃唑酮、呋喃它酮 Dr. Ehrenstorfer公司,纯度均大于98.0%;呋喃西林 中国食品药品检定研究院,纯度99.40%;硝酸银、柠檬酸三钠 美国Sigma公司,纯度均大于99.0%;氯金酸 J&K Scientific公司,纯度99.99%;甲醇、乙酸乙酯、正己烷、乙腈 色谱纯,德国Merck公司;氯化钠 分析纯,国药集团化学试剂有限公司;0.45 μm水相滤膜 天津津滕公司;实验室用水为Milli-Q超纯水;所用玻璃仪器均用王水彻底浸泡,并用超纯水反复清洗。
Food Defender RM便携式拉曼光谱仪、SORVALL ST40R高速离心机 美国Thermo Fisher Scientific公司;VORTEX 4 digital涡旋仪 德国IKA公司;Organomation MULTIVAP氮吹仪 美国Organomation Associates公司;Sartorius BS 2202S/CP225D天平 德国Sartorius公司。
1.2 实验方法
1.2.1 试剂的制备 按照文献所述方法制备金溶胶[19]和银溶胶[20]。 金溶胶的制备:精确称量0.0787 g氯金酸于1 L容量瓶中配制2×10-4mol/L的氯金酸水溶液,取50 mL 2×10-4mol/L的氯金酸水溶液于三口烧瓶中,在油浴锅内加热至沸,磁力搅拌下迅速加入0.74 mL质量浓度为1%的柠檬酸三钠水溶液,继续加热5 min后停止,然后将金溶胶放入水中冷却至室温,再置于冰箱内4 ℃避光保存。
银溶胶的制备:称取45 mg硝酸银于圆底烧瓶中,加入250 mL超纯水溶解,安装好冷凝回流装置,加热至沸,逐滴加入5 mL质量浓度为1%的柠檬酸三钠水溶液,继续加热1 h后停止。冷却至室温后于4 ℃冰箱内避光保存。
1.2.2 标准溶液配制 硝基呋喃类抗生素储备溶液(0.5 mg/mL):分别准确称取呋喃妥因、呋喃西林、呋喃唑酮和呋喃它酮标准品各25 mg,分别置于50 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀。
硝基呋喃类抗生素工作溶液(10 μg/mL):分别精密量取呋喃妥因、呋喃西林、呋喃唑酮和呋喃它酮标准储备溶液各200 μL,分别置于10 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀。
1.2.3 样品检测方法 取养殖水适量,用0.45 μm水相滤膜过滤,待测。各硝基呋喃类抗生素SERS拉曼检测方法具体方法如下:
呋喃妥因:取200 μL养殖水,加入20 μL 0.1 mol/L MgCl2溶液及20 μL 0.01 mol/L KOH溶液,混匀,加入20 μL银溶胶,充分混匀,1 min后检测分析。
呋喃西林:取200 μL养殖水,加入20 μL 0.1 mol/L MgCl2溶液及20 μL 0.01 mol/L KOH溶液,混匀,加入20 μL金溶胶,充分混匀,1 min后检测分析。
呋喃它酮:取200 μL养殖水,加入20 μL 0.1 mol/L MgCl2溶液混匀,加入20 μL金溶胶,充分混匀,1 min后检测分析。
呋喃唑酮:取200 μL养殖水,加入20 μL 0.1 mol/L MgSO4溶液及20 μL 0.01 mol/L KOH溶液,混匀,加入50 μL金溶胶,充分混匀,1 min后检测分析。
1.2.4 拉曼光谱测定 激发光源波长785 nm,激光光源功率250 mW,光谱采集范围250~2875 cm-1。每个样品重复3次,并将采集的光谱计算平均值用于数据分析。
1.3 数据处理
文中图表处理主要采用Origin 8.0与Microsoft Excel软件。
2 结果与分析
2.1 四种硝基呋喃类抗生素特征峰归属
呋喃妥因、呋喃西林、呋喃唑酮和呋喃它酮的的SERS谱图如图2所示。硝基呋喃类抗生素的主要组成部分即呋喃环、NO2、C-C=N的拉曼频率主要集中在800~1620 cm-1,以呋喃唑酮为例,其主要特征峰在图谱中清晰可见,具体归属如下:801 cm-1处H-C-C-H的面外弯曲振动;1022 cm-1处H-C-H的面内弯曲振动、NO2的伸缩振动;1186 cm-1处的C-O伸缩振动;1333 cm-1处的H-C-H对称伸缩振动、呋喃环摇摆振动;1470 cm-1处的呋喃环面内对称伸缩振动;1578 cm-1处的NO2非对称伸缩振动及呋喃环的对称伸缩振动;1602 cm-1处的C=N面内对称伸缩振动。在这四种硝基呋喃类物质中,这些主要振动都有所体现,但有一定的位移。

图2 四种硝基呋喃类抗生素的拉曼光谱图Fig.2 Raman spectra of four nitrofuran antibiotics
这些共同的主要振动在四种物质之间也体现出一定的差异。在峰强方面,呋喃妥因1609 cm-1处的特征峰归属于C=N面内对称伸缩振动,其峰强明显大于其它三个化合物;对应于呋喃环伸缩振动的特征峰中,1333 cm-1的谱峰是这四类化合物中最强特征峰,但呋喃它酮中位于1466 cm-1的谱峰峰强比其它三个化合物较为强烈;呋喃西林、呋喃它酮和呋喃妥因分别在1171 cm-1、1170cm-1、1174 cm-1处有不同层度的C-N-N振动,但在呋喃唑酮拉曼光谱图中未有体现。
2.2 拉曼检测条件的优化
2.2.1 促凝剂的优化 为检测养殖水中微量的硝基呋喃类化合物,需要使用SERS增强试剂对其信号放大,同时也需要加入具有促凝作用的纳米溶胶的促凝剂。本实验分别使用氯化钠、碳酸钠、氯化钾、溴化钾、碘化钾、碳酸钾、硫酸镁、氯化镁试剂作为促凝剂,检测了浓度为10 μg/mL的四种硝基呋喃类抗生素水溶液的SERS光谱图。检测时溶液中选用的促凝剂的浓度均为0.1 mol/L,添加体积为20 μL,在促凝剂加入1 min后采集SERS光谱以保证溶胶的促凝达到稳定状态。4种硝基呋喃类抗生素促凝剂优化的拉曼光谱图如图3所示。从图3中可以看到,以氯化镁作为溶胶促凝剂,呋喃妥因、呋喃西林、呋喃它酮的拉曼光谱可观测到非常明显的拉曼特征峰,而呋喃唑酮选用硫酸镁具有更好的SERS增强效果。
2.2.2 纳米增强试剂的优化 本实验比较了金纳米溶胶及银纳米溶胶对四种硝基呋喃类抗生素的增强效果,图谱如图4。金纳米溶胶与水结合,干扰小,基本不出现拉曼峰,可排除空白溶剂峰的干扰。金纳米对四种硝基呋喃类抗生素的都具有增强效果,拉曼信号都较强,且主要的拉曼特征峰都得到了增强。银纳米溶胶对呋喃它酮的增强效果不如金纳米溶胶明显,对呋喃西林和呋喃唑酮也只有在1020和1470 cm-1左右出现两个峰,而对呋喃妥因具有明显的增强效果。综上所述,考虑干扰大小、增强效果与峰形规则性等因素,金纳米溶胶是检测呋喃西林、呋喃唑酮和呋喃它酮比较理想的纳米增强试剂,银纳米溶胶更适合检测呋喃妥因。
2.2.3 pH的影响 通过控制纳米颗粒的pH,能增加分析物与金属表面有效接触,从而增强拉曼信号,因此本实验使用 0.1 mol/L HCl溶液和0.1 mol/L KOH溶液在pH2、3、5、7范围内调节纳米溶胶的pH,用以考查pH对于SERS信号的影响。实验发现原始制备的金胶(pH=3)对呋喃它酮的SERS检测效果最佳,当加入适量0.1 mol/L KOH溶液调节pH时(pH=5),呋喃妥因、呋喃西林、呋喃唑酮SERS检测效果最佳。以呋喃妥因为例,结果如图5所示,呋喃妥因当加入少量0.1 mol/L KOH溶液(pH=5)时,金属纳米粒子会发生一定程度的团聚,有利于“热点”的产生,从而使得增强效果增加。当加入过多酸pH降低时,纳米粒子会过度团聚,降低增强效果;当加入过量碱pH太高时,由于H+较少,没有将表面的负离子完全中和,静电荷的“同性相斥”原理使得金属粒子间的距离太远,也会造成增强效果不佳。这是由于调整体系的pH可以改变纳米粒子表面的电荷,从而改变其聚集程度,调控纳米粒子间距从而形成耦合效应,并对拉曼信号的增强起到促进作用[21]。因此,pH=5时呋喃妥因标准溶液的SERS检测效果最佳。
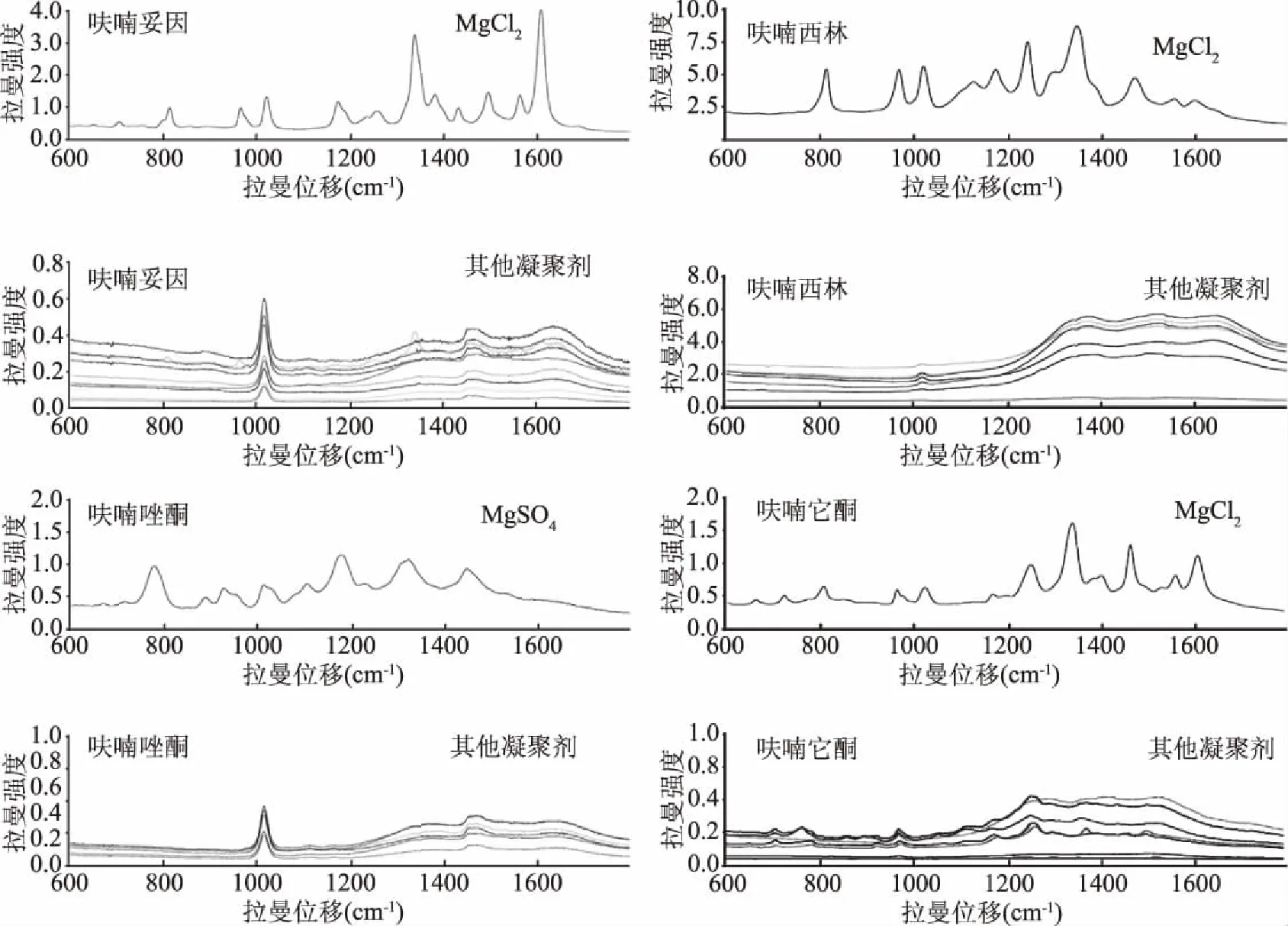
图3 四种硝基呋喃类抗生素促凝剂优化拉曼光谱图Fig.3 Raman spectra of four kind nitrofuran antibiotics in different solvents
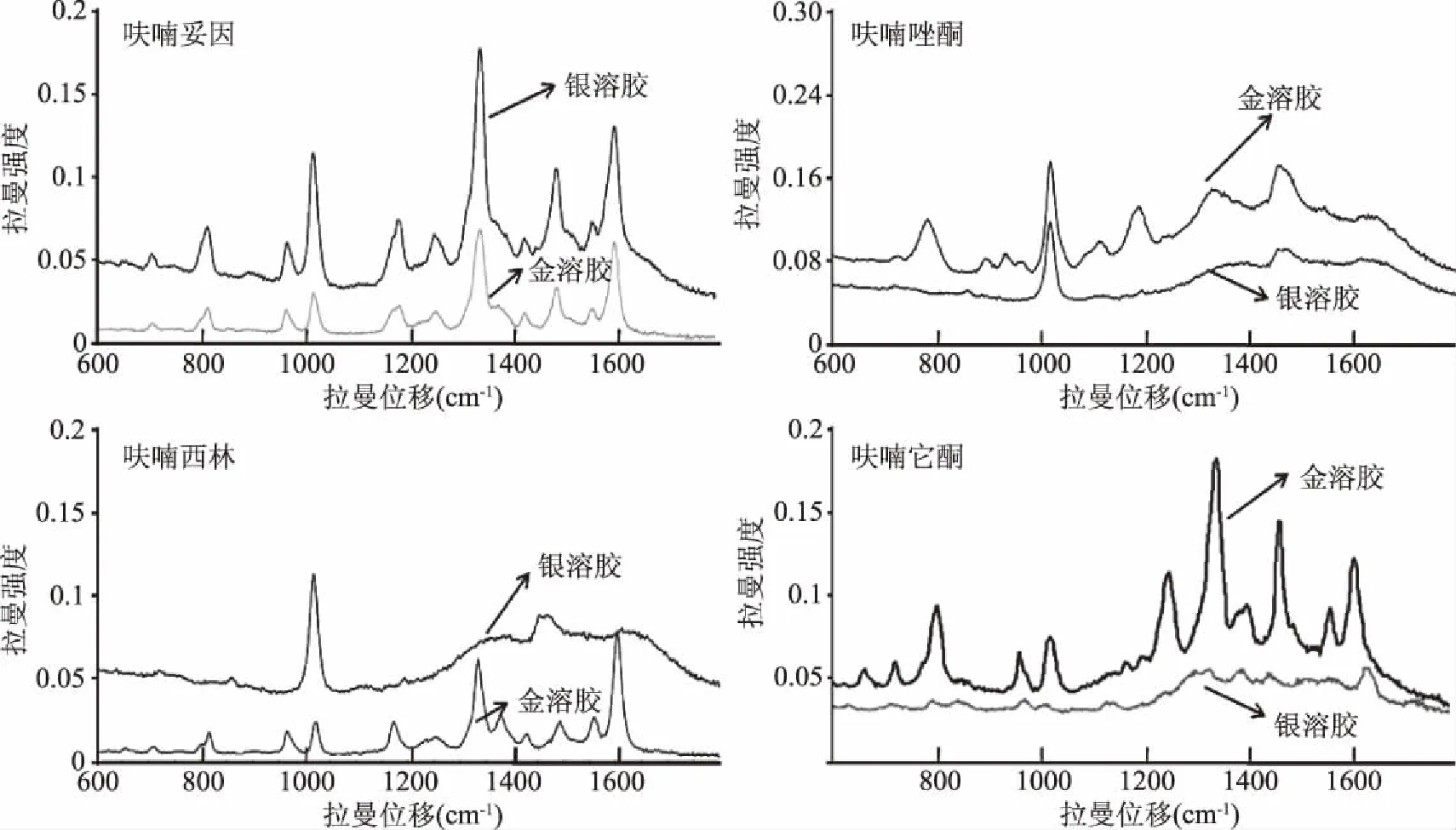
图4 四种硝基呋喃类抗生素纳米增强试剂优化拉曼光谱图Fig.4 Raman spectra of four nitrofuran antibiotics in different colloidal nanoparticles
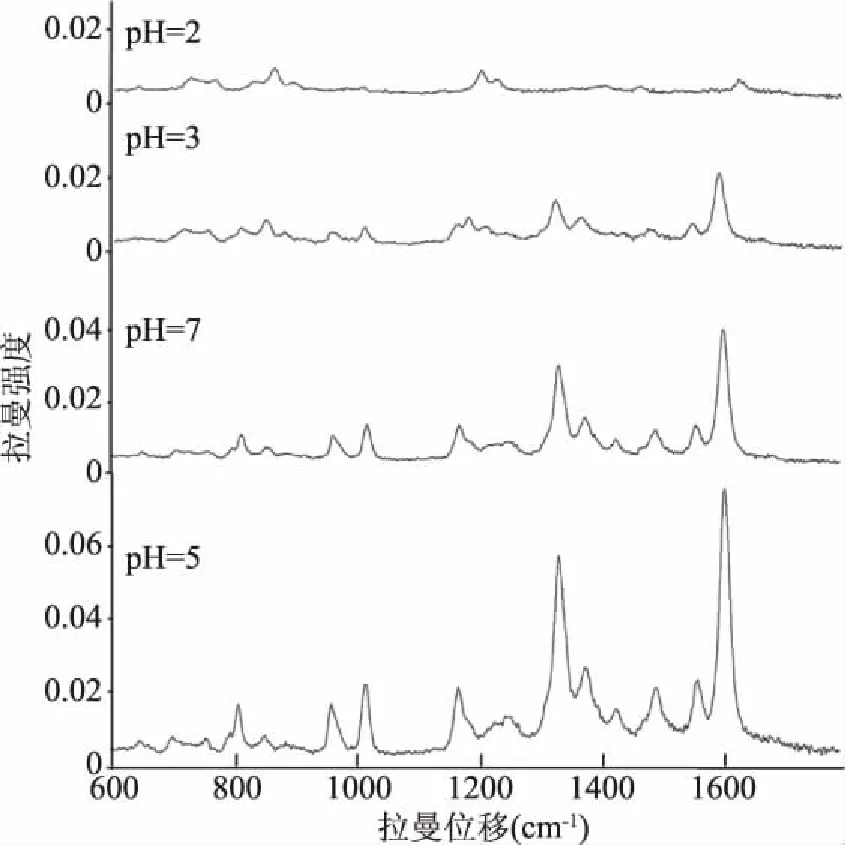
图5 pH对SERS强度的影响Fig.5 Effect of pH level on SERS intensity
2.2.4 纳米溶胶体积 纳米溶胶是一种液态SERS基底,在使用时可以与待测样品溶液以任意比例混合。不同的混合比例导致最终体系的纳米颗粒的浓度和待测样品的浓度都不相同。当纳米粒子用量的增加时,物质与纳米粒子结合更充分,拉曼响应信号有一定程度的增强,但当纳米粒子用量增加到一定程度时,可能会对物质形成比较厚的包裹层,降低物质拉曼信号的检测[22]。因此,选择合适的比例有利于物质的检测,实验中选用20 μL 0.1 mol/L促凝剂溶液,研究了加入不同体积纳米溶胶对硝基呋喃检测效果的影响,且选用峰强较强、峰形较好且附近基线平滑的光谱峰作为特征峰,呋喃妥因、呋喃唑酮、呋喃西林、呋喃它酮分别选取了1337、1185、1239、1342 cm-1处作为特征峰。如图6所示,逐渐增加纳米溶胶体积后,特征峰的强度呈现先增后减的趋势。当呋喃妥因、呋喃唑酮、呋喃西林、呋喃它酮纳米溶胶体积分别为20、50、20、20 μL,增强效果最明显。
2.2.5 吸附等待时间 研究发现,待测物质与纳米增强试剂的结合时间对 SERS 增强效果具有一定的影响。将一定比例的纳米溶胶与呋喃妥因抗生素溶液混合进行SERS检测。如图7所示,随着等待时间的延长,拉曼效应有所增强。在等待时间为1 min时,SERS效果可达到最佳。在第5 min时,SERS效果开始明显减弱。因此,当纳米溶胶与呋喃类抗生素混合1 min时进行SERS检测的效果最佳。
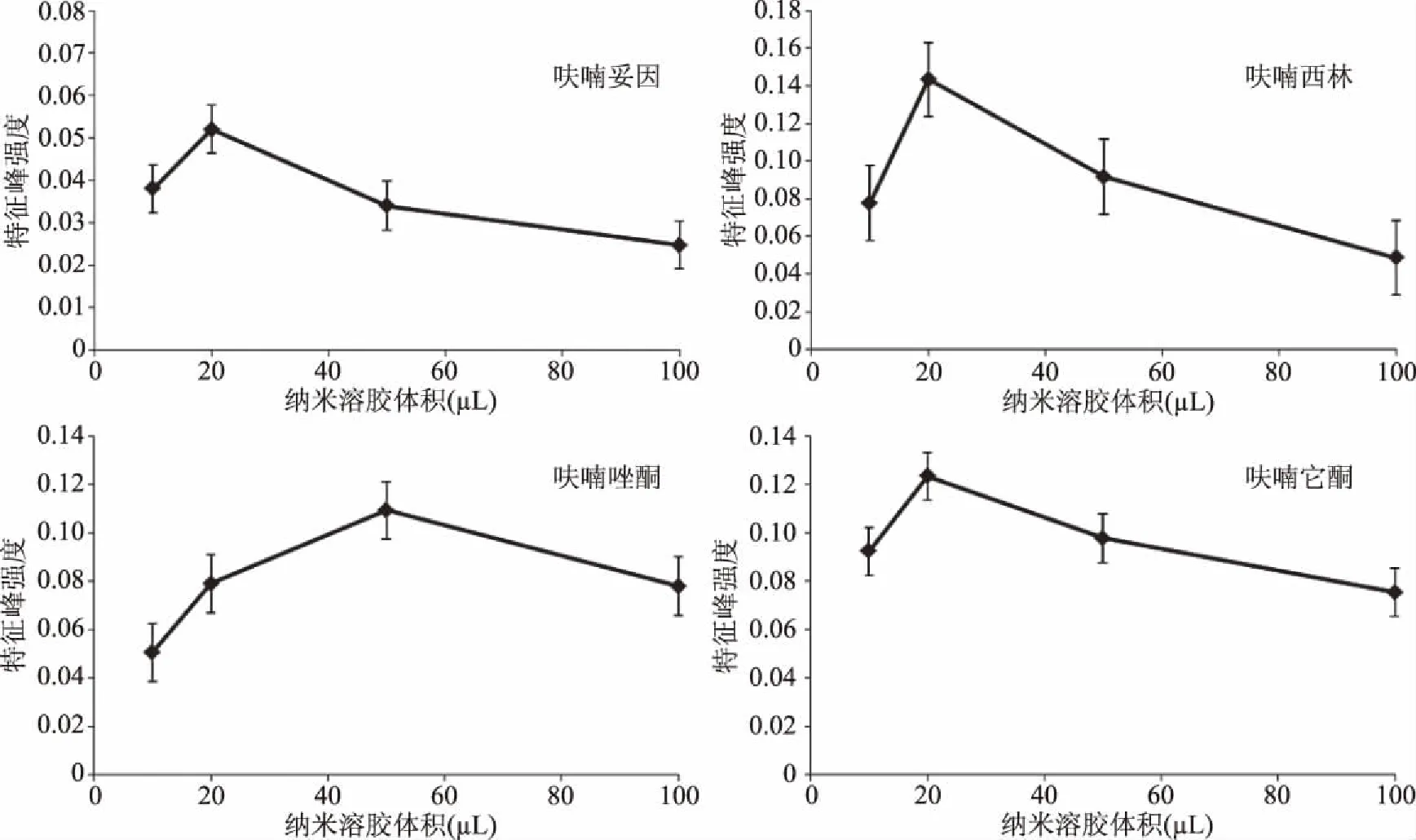
图6 不同体积纳米溶胶对四种硝基呋喃类抗生素拉曼光谱强度的影响Fig.6 Effects of different volumesof nanosols on Raman spectral intensity of four nitroturan antibiotics colloidal nanoparticles solution
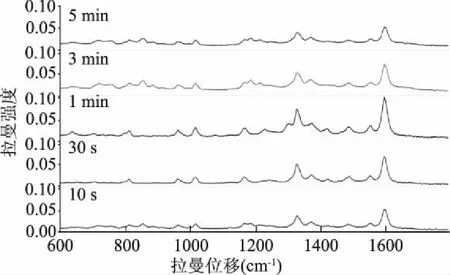
图7 纳米溶胶在放置不同时间后 对呋喃妥因增强效果对比图Fig.7 Comparison of SERS spectra of nitrofurantion in colloidal nanoparticles in different time
2.3 方法学考察
依据食药监科便函[2016]83号《食品快速检测方法评价技术规范》的要求,对建立的4种硝基呋喃类抗生素SERS增强拉曼快检方法进行方法学考查,评价指标包括:检出限、假阴性率和假阳性率、特异性、交叉反应、与现有方法一致性分析,各评价指标具体内容如下,方法学评价详细计算结果详见表1。
2.3.1 检测限 取空白养殖用水若干份,分别添加质量浓度为0、1、2 μg/mL呋喃妥因、0、0.1、0.2 μg/mL呋喃西林、0、5、10 μg/mL呋喃唑酮、0、0.1、0.2 μg/mL呋喃它酮标准品至空白样本中,按照分析步骤进行测定,每个浓度重复测定3次,观察检测结果,当呋喃妥因、呋喃西林、呋喃唑酮、呋喃它酮添加浓度分别为1、0.1、5、0.1 μg/mL时,拉曼检测结果均为阳性,最终确定呋喃妥因、呋喃西林、呋喃唑酮、呋喃它酮的检测限分别为1、0.1、5及0.1 μg/mL。
2.3.2 假阴性率和假阳性率 取空白养殖水若干,分别添加4种硝基呋喃标准溶液,分别制成添加水平为0、最低检出限、2倍最低检出限的样品各一式 20 份,按各硝基呋喃类抗生素前处理方法和分析步骤进行结果测定。4种硝基呋喃抗生素的检测结果显示,呋喃妥因、呋喃西林、呋喃唑酮、呋喃它酮中20份空白样本的检测结果为阴性的分别为20、20、20和19个,相应的有0、0、0和1个为阳性,假阳性率分别为0%、0%、0%和5%;呋喃妥因、呋喃西林、呋喃唑酮、呋喃它酮中40份阳性添加浓度样本的检测结果为阳性的分别为38、40、38和40个,相应的有2、0、2和0个为阴性,假阴性率分别为5%、0%、5%和0%。

表1 4种硝基呋喃类抗生素方法学评价结果Table 1 Results of methodological evaluation of SERS methods of four nitrofuran antibiotics
2.3.3 特异性分析 特异性是考查在实验条件下达到的实际最低检出限水平时,检出阴性结果的阴性样品数占总阴性样品数的百分比。呋喃妥因、呋喃西林、呋喃唑酮、呋喃它酮的特异性分别为100%、100%、100%和95%,符合食药监科便函[2016]83号《食品快速检测方法评价技术规范》要求。
2.3.4 交叉反应 分别以浓度为50 μg/kg的呋喃妥因、呋喃西林、呋喃唑酮、呋喃它酮混合标准溶液考察4种呋喃类抗生素交叉反应情况时,发现在呋喃西林、呋喃它酮和呋喃唑酮均存在交叉反应,呋喃妥因使用的纳米银溶胶,与其他3种呋喃类抗生素均不存在交叉反应。
2.3.5 与现有方法一致性分析 将本研究方法与基准方法SZDB/Z 323-2018 《水产品养殖水中21种磺胺类、氯霉素类、四环素类、硝基呋喃类、喹诺酮类和孔雀石绿的测定高效液相色谱-串联质谱法》检测所得到的阳性结果比率相比较,这两种方法在5%置信区间内不存在统计学差异(χ2=<3.84);同时方法的灵敏度、特异性≥95%、假阴性率和假阳性率≤5%,均符合食药监科便函[2016]83号《食品快速检测方法评价技术规范》的要求。
2.4 实际样品测定
为验证方法可行性,收集各品种水产品养殖水,包括虾类、鱼类、贝类等样品基质养殖用水共60批样品,分别按照SERS拉曼法与确证方法SZDB/Z 323-2018 《水产品养殖水中21种磺胺类、氯霉素类、四环素类、硝基呋喃类、喹诺酮类和孔雀石绿的测定高效液相色谱-串联质谱法》进行检测,测定结果一致。
3 结论
本文基于SERS技术建立了养殖水样中4种硝基呋喃类抗生素的快速检测方法。养殖水中4种硝基呋喃类抗生素呋喃妥因、呋喃西林、呋喃唑酮、呋喃它酮的检测限分别为1、0.1、5、0.1 μg/mL。所建立的快检方法灵敏度、特异性≥95%、假阴性率和假阳性率≤5%,结果均符合食品快速检测方法评价技术规范。本方法可用于定性分析养殖水中硝基呋喃类抗生素,不需复杂的前处理,单个样品检测时间在3 min内,为养殖水中硝基呋喃类抗生素的检测提供了确实可行的方法。
