蝉花孢梗束多糖的抗氧化及对环磷酰胺致肝损伤小鼠的保护作用
2019-02-18,2,*
,2,*
(1.徐州工程学院食品(生物)工程学院,江苏徐州 221018; 2.江苏省食品资源开发与质量安全重点建设实验室,江苏徐州 221018)
蝉花(Cordycepscicadae)是麦角菌科真菌大蝉草的分生孢子阶段,即蝉棒束孢菌及其寄主山蝉幼虫的干燥体,为我国传统的中药材。现代药理研究表明,蝉花具有调节免疫[1]、抗肿瘤[2]、肾保护[3-4]、神经保护[5-6]、抗菌[7]、肝保护[8]、降血糖[9]等功能。
多糖为蝉花的主要活性成分之一。人工蝉花孢梗束粗多糖能明显延长雌雄果蝇的寿命,显著提高雌雄果蝇的SOD活性,降低雄性果蝇体内MDA含量[10-11]。谢飞等[12]研究表明野生蝉花多糖对体外培养的Hela细胞具有抑制作用,并能有效抑制S180荷瘤小鼠肿瘤的生长。宋佳敏等[13]发现金蝉花多糖具有较好的体外清除自由基能力。上述报道大多是利用蝉花粗多糖开展相关生物活性研究,而对纯化后的蝉花多糖进行活性评价的报道甚少。
环磷酰胺为广谱烷化剂类抗肿瘤药物,对白血病和实体瘤均有疗效,也是目前应用最多的免疫抑制剂之一。环磷酰胺在肝脏中经细胞色素P450酶系水解为磷酰胺氮芥和丙烯醛,前者发挥其药理作用,后者毒副作用较大,可引起骨髓抑制以及生殖系统、消化系统、肝脏等损伤[14]。环磷酰胺可引起肝细胞坏死,肝小叶中心充血,并伴随氨基转移酶升高[15-16]。环磷酰胺致肝损伤模型已被广泛应于评价受试物的肝保护作用[17-19]。但有关蝉花孢梗束多糖对环磷酰胺致肝损伤小鼠的保护作用的研究未见报道。
本研究采用DE-52离子交换纤维素及葡聚糖G-100凝胶柱层析纯化蝉花孢梗束多糖。以清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基能力、还原力、清除羟基自由基能力和螯合铁离子能力为指标,评价了蝉花孢梗束多糖纯化组分的抗氧化活性。采用环磷酰胺致肝损伤小鼠模型评价了蝉花孢梗束多糖纯化组分的保肝作用,旨在为蝉花孢梗束多糖的开发利用提供依据。
1 材料与方法
1.1 材料与仪器
蝉花 徐州工程学院食品(生物)工程学院人工栽培;DE-52离子交换纤维素、葡聚糖G-100 General Electric公司;丙氨酸氨基转移酶(Alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(Aspartate aminotransferase,AST)、超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、丙二醛(Malondialdehyde,MDA)测试盒 南京建成生物工程研究所;昆明小鼠 许可证号:SCXK鲁20140007,(20±2) g,济南朋悦实验动物繁育有限公司;水飞蓟宾 天津天士力圣特制药有限公司;其他试剂 均为国产分析纯。
723C型可见分光光度计 上海精密科学仪器有限公司;LGJ-18A 冷冻干燥机 北京四环科学仪器厂;HL-2恒流泵 上海嘉鹏科技有限公司;TGL-16台式高速冷冻离心机 长沙湘仪有限公司;Synergy2多功能酶标仪 BioTek公司;2.6 cm×30 cm、2.6 cm×60 cm层析柱 上海厦美生化科技发展有限公司。
1.2 实验方法
1.2.1 蝉花孢梗束粗多糖的制备 采用Zheng等[20]报道的方法。蝉花子实体清洗后切成薄片,置于50 ℃烘箱中烘干至恒重。粉碎后过60目筛,取100 g样品粉末,加20倍体积蒸馏水,90 ℃提取2 h,过滤,浓缩至原体积的1/20,4 ℃醇沉(乙醇终浓度80%)12 h脱脂。3000 r/min离心10 min,收集沉淀,环己烷、无水乙醇各洗涤2次,挥干乙醇,得粗多糖。Sevag试剂(氯仿∶正丁醇=4∶1)脱蛋白,重复5次。透析48 h(截留相对分子质量:8000~14000 Da),浓缩后冷冻干燥。
1.2.2 蝉花孢梗束粗多糖的纯化 粗多糖的纯化采用Zheng等[20]的方法。称取200 mg粗多糖加入5 mL去离子水,缓慢上样至已平衡的DE-52离子交换纤维素层析柱(2.6 cm×30 cm)。采用去离子水、0.1、0.3和0.5 mol/L NaCl溶液梯度洗脱,流速3.0 mL/min,分级收集,每种洗脱液各收集20管,10 mL/管。苯酚硫酸法[21]测收集管吸光度,收集不同洗脱梯度相应的组分,得初步纯化产品。
称取50 mg初步纯化样品加入2 mL去离子水,再用葡聚糖G-100凝胶色谱柱(2.6 cm×60 cm)进一步纯化,去离子水洗脱,流速0.5 mL/min,分部收集,10 mL/管,硫酸苯酚法检测各管吸光度,分别收集不同的组分,浓缩后-50 ℃冷冻干燥,得纯化产品。
1.2.3 抗氧化活性检测
1.2.3.1 DPPH自由基清除能力测定 DPPH自由基清除率测定采取Wu等[22]的方法。分别取不同质量浓度(0.1~4 g/L)的蝉花孢梗束多糖溶液1.5 mL,加入1.5 mL DPPH溶液(0.2 mmol/L,溶于95%乙醇),混匀,在室温下避光静置0.5 h,测定517 nm处吸光度。抗坏血酸(0.05~4 g/L)做阳性对照。
清除率(%)=[1-(Am-An)/A0]×100
式(1)
式中:A0为对照组吸光度,1.5 mL蒸馏水加1.5 mL含0.2 mmol/L DPPH的95%乙醇;Am为样品组吸光度,1.5 mL样品液加1.5 mL含0.2 mmol/L DPPH的95%乙醇;An为空白组吸光度,1.5 mL样品液加1.5 mL 95%乙醇。
1.2.3.2 还原力测定 采用Oyaizu[23]报道的铁氰化钾法。分别取不同质量浓度(0.05~4 g/L)样液2 mL,加入2 mL磷酸缓冲液(0.2 mol/L,pH6.6),1%铁氰化钾溶液2 mL,混匀,50 ℃水浴20 min,再加入10%三氯乙酸溶液2 mL,摇匀,3000 r/min离心10 min。离心后取2 mL上清液,依次加入去离子水2 mL,0.1%三氯化铁0.4 mL,混匀,50 ℃水浴10 min,测定700 nm处吸光度。空白组采用去离子水取代样品,抗坏血酸(0.01~1 g/L)做阳性对照。
1.2.3.3 羟基自由基清除能力测定 采用邻二氮菲比色法[24],样液质量浓度为0.1~6 g/L,抗坏血酸(0.1~6 g/L)做阳性对照,测定536 nm处吸光度。
损伤管:取0.5 mL邻二氮菲无水乙醇溶液(0.75 mmol/L),加入1 mL磷酸盐缓冲液(0.15 mmol/L,pH7.4)和0.5 mL去离子水,混匀后加入0.5 mL 0.75 mmol/L FeSO4,0.5 mL 0.01% H2O2,37 ℃水浴1 h,测吸光度记为A损。
未损伤管:以0.5 mL去离子水代替0.01% H2O2,测吸光度记为A未损。
样品管:在0.5 mL邻二氮菲无水乙醇溶液(0.75 mmol/L)中加入1 mL磷酸盐缓冲液(0.15 mmol/L,pH7.4)和0.5 mL样液混匀,再加0.5 mL硫酸亚铁(0.75 mmol/L),混匀后加0.5 mL 0.01% H2O2,37 ℃水浴1 h,测吸光度记为A样。
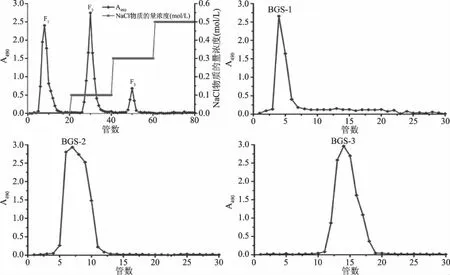
图1 蝉花孢梗束粗多糖在DE-52纤维素层析柱与葡聚糖 G-100层析柱上的洗脱曲线Fig.1 Elution curve of crude polysaccharides from synnemata of Cordyceps cicadae by DE-52 cellulose chromatography and Sephadex G-100 column
样品参比:1 mL磷酸盐缓冲液(0.15 mol/L,pH7.4)与0.5 mL样液混合,再加1.5 mL去离子水,测吸光度,记为A参。
空白参比:1 mL磷酸盐缓冲液(0.15 mmol/L,pH7.4)与2 mL去离子水混合,作为空白调零,记为A空。
清除率(%)=[(A样-A参)-(A损-A空)]/(A未损-A损)×100
式(2)
式中:A样、A参、A损、A空和A未损分别为样品组、样品参比、损伤组、空白对照组和未损伤组吸光度。
1.2.3.4 铁离子螯合能力铁离子鳌合能力测定 采用Decker等[25]的方法,并稍加修改。在1 mL不同质量浓度(0.01~10 g/L)的样液中分别加入3.7 mL 55%乙醇,0.1 mL氯化亚铁(2 mmol/L)和0.2 mL菲啰嗪(5 mmol/L),混匀,静置 20 min,测定562 nm处吸光度。空白对照组使用55%乙醇。阳性对照组为EDTA(0.01~10 g/L)。铁离子螯合率计算公式如下:
铁离子螯合率(%)=[(Ai-Aj)/Ai]×100
式(3)
式中:Ai和Aj分别为空白组、样品(或阳性对照)的吸光度。
1.2.4 小鼠分组与处理 小鼠饲养温度20~23 ℃;相对湿度为44%~54%。经一周预饲养后,随机分为正常组、模型组、阳性组和蝉花孢梗束多糖低、中、高剂量组。每组10只,雌雄各半。除正常组外,其余组腹腔注射80 mg/kg环磷酰胺,连续3 d。造模后,阳性组灌胃150 mg/kg水飞蓟宾,蝉花孢梗束多糖低、中、高剂量组分别灌胃25、50和100 mg/kg的蝉花孢梗束多糖BGS-2,每天一次,连续14 d。空白组、模型组每日灌胃等量生理盐水。
1.2.5 生化指标检测 末次灌胃24 h后,小鼠眼眶采血,3000 r/min离心10 min,收集血清,按照试剂盒说明书测定血清中ALT和AST酶活。颈椎脱臼处死小鼠,取肝脏,加生理盐水,制成10%肝组织匀浆,按照试剂盒说明书测定肝组织中SOD、CAT、GSH-Px活性和MDA含量。
1.3 数据处理
实验数据采用SPSS 22.0软件进行分析,结果使用平均值±标准差表示,显著性分析采用Dunnett-t检验法。
2 结果与分析
2.1 蝉花孢梗束多糖的分离纯化结果
蝉花孢梗束粗多糖在DE-52纤维素柱上的洗脱曲线如图1所示。其中0.5 mol/L NaCl洗脱液没有洗脱得到多糖组分。F1、F2和F3分别为去离子水、0.1和0.3 mol/L NaCl溶液的洗脱组分。上述洗脱组分再用葡聚糖G-100凝胶色谱柱进一步纯化,所得三个纯化组分分别命名为BGS-1、BGS-2和BGS-3,根据葡萄糖标准曲线y=0.0101x+0.0039(R2=0.9975),计算得到多糖质量分数分别为96.34%、98.65%和90.43%。
2.2 蝉花孢梗束多糖体外抗氧化活性分析
2.2.1 清除DPPH自由基能力的测定结果 DPPH自由基清除试验是一种常用的评价抗氧化能力方法[26]。由图2可知,在测定的质量浓度范围(0.1~1 g/L)之内,各组分的DPPH自由基清除率与质量浓度成正相关。在质量浓度为2 g/L时,BGS-1、BGS-2和BGS-3对DPPH自由基的清除率分别为87.86%、90.25%、78.13%,BGS-2的清除率为最高。半数有效浓度(half maximal effective concentration,EC50)可作为评价抗氧化能力的重要参数,如某种物质的EC50值低于10 g/L,则表明其具有很好的抗氧化活性。BGS-1、BGS-2和BGS-3清除DPPH自由基的EC50值分别为0.53、0.45、0.64 g/L。由此可以看出,蝉花孢梗束多糖三个纯化组分均具有较强的清除DPPH自由基能力,强弱顺序为BGS-2>BGS-1>BGS-3。抗坏血酸清除DPPH自由基的EC50值为0.12 g/L,表明蝉花孢梗束多糖清除DPPH自由基能力低于抗坏血酸。
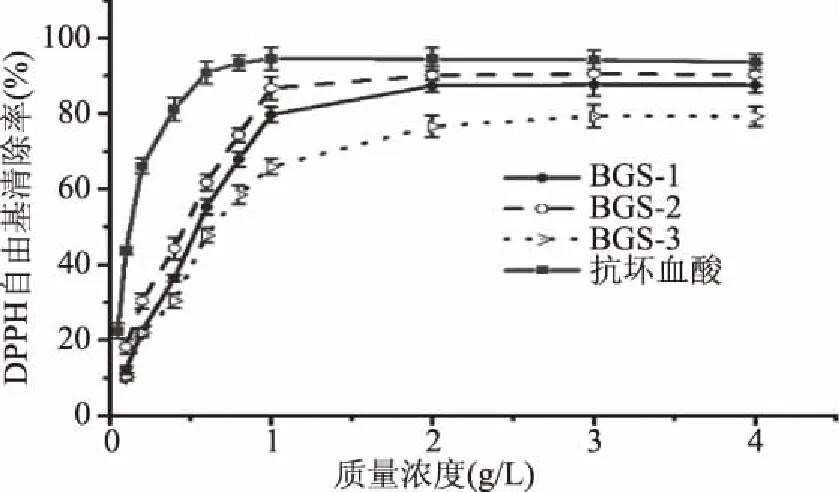
图2 蝉花孢梗束多糖对DPPH自由基的清除能力Fig.2 DPPH free radicals scavenging ability of polysaccharides from synnemata of Cordyceps cicadae
2.2.2 还原力的测定结果 抗氧化物质的抗氧化活性与其自身的还原力有直接的关系[27]。由图3可知,随着样品质量浓度的增加,蝉花孢梗束多糖各组分的还原力也相应增大。在质量浓度为0.1 g/L时,BGS-1、BGS-2和BGS-3的吸光度分别为0.193、0.247和0.125,抗坏血酸的吸光度为0.532。在质量浓度为4 g/L时,三个组分的吸光度分别为1.045、1.147和0.945。由图3可知,蝉花孢梗束多糖表现出较强的还原力,三个多糖组分还原力的强弱顺序为BGS-2>BGS-1>BGS-3。
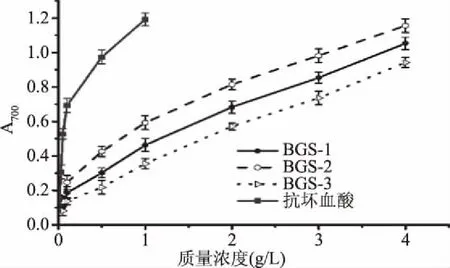
图3 蝉花孢梗束多糖的还原力Fig.3 Reducing power of polysaccharides from synnemata of Cordyceps cicadae
2.2.3 清除羟基自由基能力的测定结果 由图4可知,在0.1~6 g/L的质量浓度测定范围之内,蝉花孢梗束多糖的羟基自由基清除率随着质量浓度的升高而增大,蝉花孢梗束多糖的清除能力略高于抗坏血酸。在质量浓度为0.1 g/L时,BGS-1、BGS-2和BGS-3的清除率分别是19.34%、25.67%和15.12%。在质量浓度达到6 g/L时,蝉花孢梗束多糖与抗坏血酸的羟基自由基清除率趋于平缓,其中BGS-1、BGS-2和BGS-3的清除率分别为89.03%、89.67%、85.17%,抗坏血酸的清除率为73.56%。BGS-1、BGS-2和BGS-3清除羟基自由基的EC50值分别为0.97、0.73和1.29 g/L,抗坏血酸的EC50值为1.62 g/L,可以看出,蝉花孢梗束多糖较抗坏血酸表现出更高的羟基自由基清除能力,BGS-2清除羟基自由基能力最强。
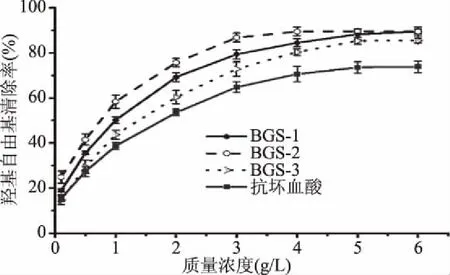
图4 蝉花孢梗束多糖对羟基自由基的清除能力Fig.4 Hydroxyl free radicals scavenging ability of polysaccharides from synnemata of Cordyceps cicadae
2.2.4 铁离子螯合能力的测定结果 铁离子在生物体内能通过Fenton反应发生脂质过氧化,并导致羟基自由基的产生,因此铁离子鳌合能力也是评价抗氧化活性的常用指标[28]。由图5可以发现,随着样品质量浓度的增加,各组分的铁离子鳌合率也相应增加,在质量浓度为3 g/L时,EDTA的铁离子螯合率已达到98.27%,而BGS-1、BGS-2和BGS-3的螯合率为53.21%、69.77%和45.33%。BGS-1、BGS-2和BGS-3螯合铁离子的EC50值分别为2.68、2.06和3.29 g/L,强弱顺序为BGS-2>BGS-1>BGS-3。各组分的EC50值均高于EDTA(0.14 g/L),但都低于10 g/L,表明各个组分具有较高的铁离子螯合能力。
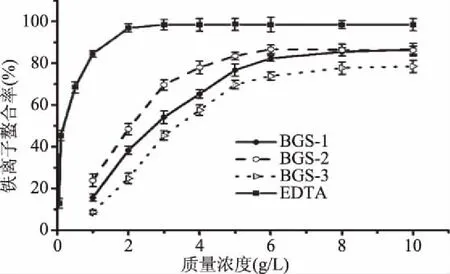
图5 蝉花孢梗束多糖的铁离子螯合能力Fig.5 Ferrous ions chelating ability of polysaccharides fractions from synnemata of Cordyceps cicadae

表1 蝉花孢梗束多糖BGS-2对环磷酰胺致肝损伤小鼠肝脏SOD、CAT、GSH-Px活性和MDA含量的影响Table 1 Effects of polysaccharide fraction(BGS-2)from synnemata of Cordyceps cicadae on liver SOD, CAT,GSH-Px activities and MDA levels in cyclophosphamide-induced mice
综上所述,蝉花孢梗束多糖各组分均具有较好的清除DPPH自由基能力、还原力、清除羟基自由基能力和铁离子螯合能力,其中BGS-2的抗氧化活性最强,因此选择BGS-2进一步开展体内生物活性研究。
2.3 BGS-2对环磷酰胺致肝损伤小鼠的保护作用
2.3.1 BGS-2对血清ALT和AST活性的影响 如图6所示,模型组小鼠血清ALT和AST活性均极显著高于正常组(P<0.01),表明环磷酰胺摄入造成了小鼠肝细胞的损伤。低、中、高剂量BGS-2小鼠血清ALT和AST活性均极显著低于模型组(P<0.01)。BGS-2剂量越高,两种转氨酶活性下降的程度亦越高。阳性对照组小鼠血清ALT和AST活性亦极显著低于模型组(P<0.01)。
环磷酰胺代谢过程中产生的活性氧及代谢产物可损害生物膜,导致血清ALT和AST活性升高[29]。低、中和高剂量BGS-2均能极显著降低环磷酰胺诱导的小鼠血清ALT和AST活性,表明BGS-2对环磷酰胺致小鼠肝损伤具有较好保护作用。
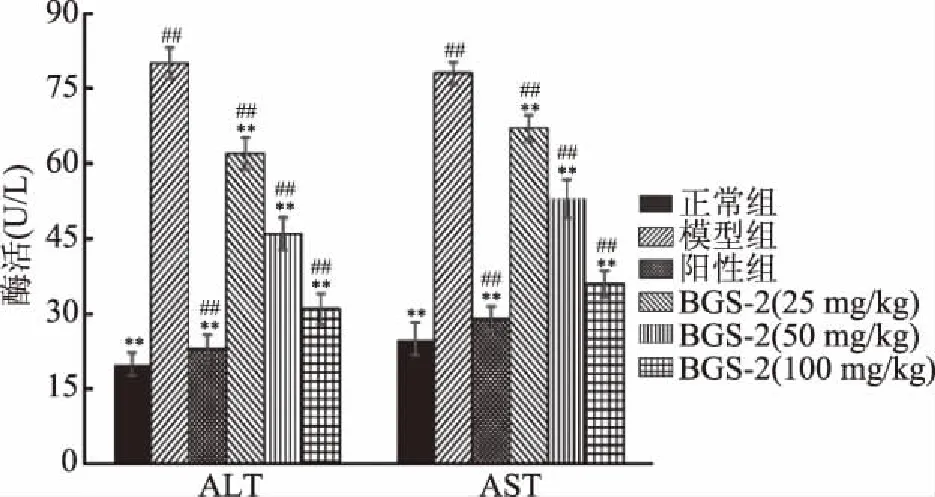
图6 蝉花孢梗束多糖BGS-2对环磷酰胺 致肝损伤小鼠血清ALT和AST含量的影响Fig.6 Effects of polysaccharide fraction(BGS-2)from synnemata of Cordyceps cicadae on serum ALT and AST levels in cyclophosphamide-induced mice注:结果以平均值±标准差表示(n=10); **与模型组相比,差异极显著(P<0.01); ##与正常组相比,差异极显著(P<0.01);表1同。
2.3.2 BGS-2对肝组织中抗氧化酶和MDA含量的影响 如表1所示,模型组小鼠肝脏SOD、CAT和GSH-Px活性均极显著低于正常组(P<0.01),脂质过氧化产物MDA含量极显著高于正常组(P<0.01),表明环磷酰胺的摄入造成了小鼠肝脏抗氧化防御系统的损伤,亦进一步说明环磷酰胺诱导肝损伤小鼠造模成功。BGS-2低剂量组小鼠肝脏中SOD、CAT和GSH-Px活性均极显著高于模型组(P<0.01),MDA含量极显著低于模型组(P<0.01)。BGS-2剂量越高,抗氧化酶上升与MDA下降的程度亦越高。150 mg/kg水飞蓟宾(阳性对照组)亦能极显著提高抗氧化酶活性(P<0.01),降低MDA含量(P<0.01)。
环磷酰胺的代谢产物丙烯醛可刺激机体产生大量的活性氧,过量的活性氧使SOD、CAT和GSH-Px等抗氧化酶耗竭或活性下降;此外,丙烯醛可攻击细胞内的生物大分子,引起脂质氧化损伤,MDA含量可反映脂质过氧化的程度[30-32]。BGS-2能极显著提高环磷酰胺诱导的小鼠肝脏SOD、CAT和GSH-Px活性,降低MDA含量,表明蝉花孢梗束多糖可提高机体抗氧化能力,减少脂质过氧化的发生。结合蝉花孢梗束多糖的体外抗氧化活性,可初步认为BGS-2可能是通过提高体内抗氧化酶活性、直接清除自由基和螯合金属离子等途径发挥其对环磷酰胺诱导肝损伤的保护作用。
3 结论
蝉花孢梗束多糖组分BGS-1、BGS-2和BGS-3均表现出较好的体外抗氧化活性,且随着质量浓度的增加而增大。BGS-2的体外抗氧化能力最高,清除DPPH自由基、清除羟基自由基、螯合铁离子的EC50值分别为0.45、0.73和2.06 g/L。BSG-2能极显著降低环磷酰胺致肝损伤小鼠血清ALT和AST活性(P<0.01),极显著提高小鼠肝脏SOD、CAT和GSH-Px活性,降低MDA含量(P<0.01),表明蝉花孢梗束多糖具有缓解环磷酰胺致小鼠肝损伤作用。BGS-2可能通过提高体内抗氧化酶活性、直接清除自由基和螯合金属离子等途径发挥其对环磷酰胺致小鼠肝损伤的保护作用。有关蝉花孢梗束多糖BGS-2的抗氧化、肝保护作用机制及其构效关系需进一步研究。
