长裙竹荪多肽抗氧化及免疫调节作用
2019-02-18,*
,*
(1.四川省农业科学院生物技术核技术研究所,四川成都 610061; 2.阿坝州林业科学技术研究所,四川汶川 623000; 3.四川师范大学生命科学学院,四川成都 610068)
竹荪(Dictyophoraindusiata),隶属于担子菌亚门(Basidiomycotina)、腹菌纲(Gasteromycetes)、鬼笔目(Phallales)、鬼笔科(Phallaceae)、竹荪属(Dictyophora),其营养丰富、味道鲜美,是享誉世界的美味食用菌。竹荪具有滋补强壮、益气补脑、宁神健脑的功效[1]。现代医学研究发现,竹荪浸提液含有天然抑菌物质,能够有效抑制食源性致病菌增殖[2];竹荪富含的多酚能有效清除活性氧自由基,具有优良的抗氧化活性[3];竹荪多糖则具有抗氧化[4]、强化免疫、抑制肿瘤的作用[5],能够有效诱导小鼠腹水瘤S180细胞凋亡[6],抑制肺癌A549细胞与宫颈癌Hela细胞的增殖[7]。
免疫调节肽是指具有增强免疫功能的一类生物活性肽,其作用对象多为巨噬细胞,通过增强体内巨噬细胞吞噬功能,调节细胞因子的分泌以及促进淋巴细胞的增殖来起作用[8]。免疫调节肽能够显著增强机体抵抗外界病毒感染的能力,以此降低机体发病几率,保持机体的健康状态[9]。近年来,相关学者陆续报道了一些生物源的免疫调节肽,海参肽[10]、鳙鱼肽[11]等都具有优良的免疫调节作用。但目前报道的免疫调节肽多来自于动物与植物,对于高等真菌免疫调节肽的研究较少,在竹荪属中尚未见免疫调节肽的报道。
基于以上分析,本文采用磷酸盐缓冲液直接提取法获得长裙竹荪水溶性蛋白,3500 Da透析袋透析,分子排阻色谱法(GE,Superdex 30 Increase)分离,反相高效液相色谱(RP-HPLC)纯化,获得长裙竹荪多肽(DIP),通过自由基清除能力评估长裙竹荪多肽的抗氧化活性,进一步通过评价巨噬细胞RAW264.7的吞噬能力和细胞因子分泌的促进作用来验证其免疫调节作用,为长裙竹荪的精深加工应用提供实验支撑。
1 材料与方法
1.1 材料与仪器
长裙竹荪子实体 采集自四川省农业科学院食用菌栽培基地,37 ℃烘箱中烘干待用;RAW264.7(小鼠单核巨噬细胞系,ATCC Number:TIP71)细胞 美国ATCC菌种保藏中心;胎牛血清、DMEM培养液 Thermo Scientific公司;青霉素、链霉素 美国Sigma公司;一氧化氮、TNF-α、IL-1β、IL-6细胞因子检测试剂盒 南京建成生物工程研究所;小鼠Toll样受体检测试剂盒 上海沪震生物科技有限公司;其余试剂 均为分析纯级。
Quest 10中高压层析系统 Bio-rad;Flexar FX-15高效液相色谱 Perkin Elmer;Microfuge 20R高速离心机 Beckman;Forma 3111 CO2细胞培养箱 Thermo;SpectraMax L酶标仪 Molecular Devices;Delta 1-24 LCS真空冷冻干燥机 Christ;N-1210BS-WB旋转蒸发仪 Eyela;CKX53倒置显微镜 Olympus。
1.2 实验方法
1.2.1 竹荪多肽提取与纯化
1.2.1.1 竹荪多肽复合物提取 称取长裙竹荪子实体干品20 g,采用中药材粉碎机粉碎,过100目筛网,获得长裙竹荪子实体干品粉末。按照长裙竹荪干品/PBS缓冲液(pH6.8)的料液比1∶20 (g/mL)加样,加样后磁力搅拌器120 r/min搅拌过夜,取上清,6000 r/min离心10 min后获得上清液。选择截留分子量为3500 Da的透析袋透析12 h,流动相选择超纯水,收集透析液,旋转蒸发仪浓缩,获得的浓缩液采用真空冷冻干燥机冷冻干燥12 h,可获得长裙竹荪多肽提取物干粉。竹荪多肽提取物得率(%)=(竹荪多肽提取物干粉质量/竹荪子实体干品质量)×100。
取长裙竹荪多肽提取物干粉5 g,无菌水溶解,配制成50 mg/mL的溶液,上样于Superdex 30 Increase 凝胶过滤柱,无菌水洗脱,部分自动收集器收集洗脱液,215 nm下测定吸光值,收集并冻干单一峰,得到长裙竹荪子实体多肽复合物。竹荪多肽复合物得率(%)=(竹荪多肽复合物干粉质量/竹荪子实体干品质量)×100。
1.2.1.2 竹荪多肽(DIP)分离纯化 取长裙竹荪多肽复合物干粉1 g,无菌水溶解,配制成10 mg/mL的溶液,反相高效液相色谱法(RP-HPLC)纯化,收集单一峰,获得纯化的长裙竹荪多肽(DIP)。竹荪多肽得率(%)=(竹荪多肽干粉质量/竹荪子实体干品质量)×100。
色谱条件:PE C18柱(150 mm×4.6 mm),A相:纯净水,B相:含0.1%三氟乙酸的乙腈;流速:1.0 mL/min;进样量:30 μL;检测波长:215 nm;柱温:(25±5) ℃;柱压:3000 psi;洗脱条件设定为,A相:0~8 min,99%~97%;8~12 min,97%~96%;12~16 min,96%~80%;16~20 min,80%~99%。收集DIP,纯水溶解,配制成浓度为5 mg/mL溶液,进行190~600 nm条件下全波段扫描。
1.2.1.3 竹荪多肽的基本成分测定 进一步完成并比较长裙竹荪子实体和提取到的多肽DIP的基本组分。水分按照GB/T 5009.3-2010测定;灰分按照GB/T 5009.4-2010测定;蛋白质根据GB/T 5009.5-2010凯氏定氮法测定;多糖含量测定采用苯酚硫酸法。
1.2.2 DIP自由基清除能力测定 依据Oktay等[12]的方法完成DPPH自由基、羟自由基及超氧阴离子自由基的清除能力测定。取DIP 50 mg,无菌水溶解,配制成5 mg/mL母液,进一步将母液稀释成浓度为5、2.5、1.25、0.63和0.32 mg/mL的待测液。采用浓度为1 mg/mL的VC作为阳性对照,同一测定重复3次。
1.2.3 DIP对细胞存活率的影响 DMEM培养基培养RAW264.7细胞,取对数期细胞接种于96孔板,细胞密度1×105个/mL,每孔100 μL,5% CO2培养箱37 ℃培养。待细胞贴壁后,将细胞分为8组,每组8个复孔,分别为对照组,100 μL含血清DMEM培养基;7个DIP组,含有DIP的培养基,DIP的最终浓度依次为3.13、6.25、12.5、25、50、100、200 μg/mL,空白孔不接种细胞,加入100 μL含血清DMEM培养基,CO2培养箱培养24 h。采用MTT法测定细胞存活率。
1.2.4 中性红吞噬作用评价 取对数期RAW264.7细胞以浓度2×104个/mL铺96孔板,每孔100 μL。实验设定终浓度为10 μg/mL的LPS作为阳性对照,空白组(CK)设定为:100 μL DMEM细胞培养液+100 μL细胞悬液;20 mL DIP+100 μL细胞悬液+80 μL DMEM细胞培养液作为处理组,最终保证DIP的终浓度分别为0、3.13、6.25、12.5、25和50 μg/mL,每组均设立8个复孔。5% CO2、37 ℃条件下培养24 h。之后用PBS洗涤3次,加入中性红溶液100 μL,使中性红的终浓度为1 μg/mL,继续培养30 min。清洗3次后加入裂解液(冰醋酸∶无水乙醇=1∶1)200 μL,静置过夜,待细胞裂解完全后,在540 nm波长下测定吸光度值。
1.2.5 对细胞信号物质NO分泌的影响 通过Griess试剂法验证DIP对RAW264.7细胞分泌NO的促进作用。取对数期RAW264.7细胞以浓度2×105个/mL铺24孔板。实验处理同上,培养细胞64 h,每隔8 h测定一次NO含量。按照试剂盒说明书进行操作,横坐标为标准品浓度,对应540 nm下OD值为纵坐标,绘制出标准品线性回归曲线,拟合得出回归方程,按曲线方程计算各样品中NO的浓度值。
1.2.6 促细胞因子分泌活性评价 实验处理同上,细胞培养结束后,取上清液,使用小鼠肿瘤坏死因子-α(TNF-α),白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)的ELISA试剂盒测定其中的TNF-α,IL-1β和IL-6细胞因子的浓度,按照试剂盒说明书操作。用酶标仪在450 nm波长下测定吸光度(OD值)。以标准品浓度为横坐标,对应OD值为纵坐标,绘制出标准品拟合线性回归曲线,得出回归方程,按曲线方程计算各样品中细胞因子的浓度值。
1.2.7 Toll样受体表达的影响 RAW264.7细胞(1×105)接种到24孔板中进行培养,实验设置同上。培养结束后,消化并收集细胞,采用反复冻融的方法裂解细胞,6000 r/min获得细胞裂解液,按照试剂盒说明书要求进行膜表面蛋白Toll样受体TLR4、TLR9的含量检测。
1.3 数据处理
各组实验数据以平均值±标准差(X±S)表示,应用统计软件SPSS 19.0进行分析,多组均数比较采用ANOVA检验,P<0.05视为显著性差异。
2 结果与分析
2.1 DIP分离纯化及基本成分测定
2.1.1 DIP提取分离得率 通过3次重复试验,探索DIP的得率。首先,借助磷酸盐缓冲液提取,20 g长裙竹荪子实体粉末得到长裙竹荪多肽提取物干粉6.42 g,得率为32.10%。5 g长裙竹荪多肽提取物干粉经过分子排阻色谱得到长裙竹荪子实体多肽复合物干粉0.51 g,得率为2.55%。0.51 g多肽复合物干粉通过制备型RP-HPLC纯化出DIP 0.118 g,得率为0.59%。
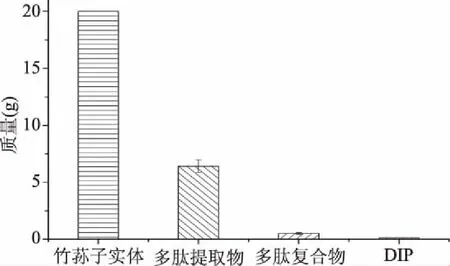
图1 长裙竹荪多肽分离纯化质量Fig.1 Isolation and purification yield of DIP
2.1.2 DIP纯化及鉴定 分子排阻色谱结果显示,透析后的溶液经过Superdex 30 Increase柱凝胶过滤后,依次分离出4个组分(图2A),分子量由大到小编号为A1-4,通过自由基清除活性初筛,收集A3组分作为长裙竹荪多肽复合物进行下一步纯化。A3上样RP-HPLC后,共分离出4个组分(图2B),为B1-4,最终收集B3作为DIP进行下一步实验。将收集到的B3组分(DIP)配置成浓度为1 mg/mL的溶液进行全波段扫描,获得DIP扫描图谱如图2C所示,DIP在216 nm处出现最大吸收峰,证明DIP是纯度较高的多肽。
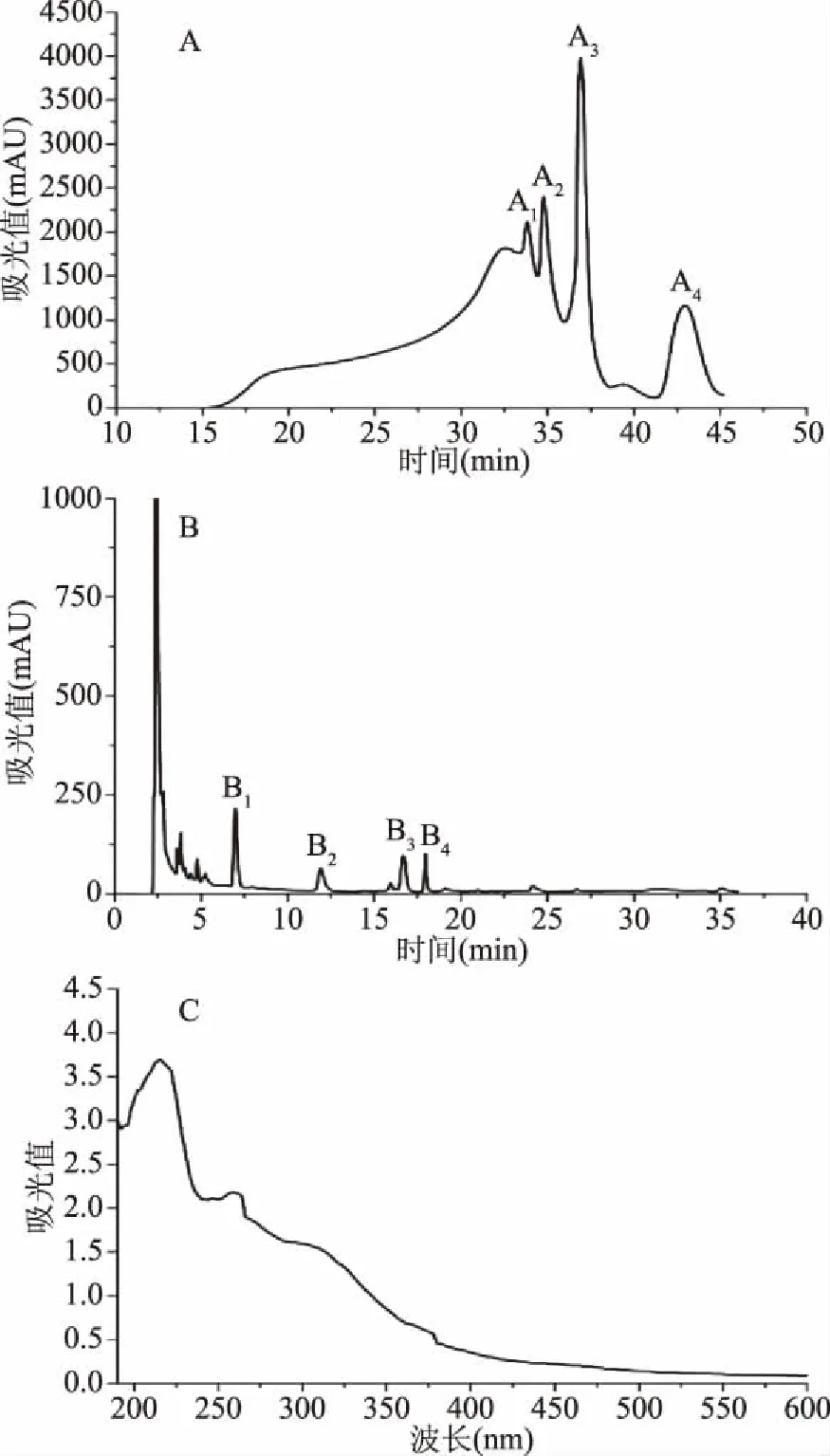
图2 长裙竹荪多肽分离纯化Fig.2 Isolation and purification of DIP注:A:分子排阻图谱;B:RP-HPLC图谱; C:UV连续扫描图谱。
2.1.3 DIP基本成分测定 长裙竹荪子实体中粗蛋白的含量为21.36%,粗多糖含量为28.85%,现有报道认为长裙竹荪是一种高蛋白、低脂肪,并且具有保健活性的健康食品[1]。通过分子排阻色谱和反相高效液相色谱的分离纯化,获得的DIP中的粗蛋白含量显著提升,达到了70.35%,是子实体中粗蛋白含量的3倍,确认DIP是一种纯度较高的小分子多肽。
2.2 DIP自由基清除活性
DIP对几种常见的活性氧自由基清除率如图3所示。DIP对DPPH自由基表现出极强的清除活性,IC50为0.15 mg/mL,与VC相近。DIP对羟自由基具有较好的清除活性,IC50值约为1.18 mg/mL,同样与阳性对照VC(1.05 mg/mL)相近。DIP对超氧阴离子IC50值约为2.64 mg/mL。

表1 长裙竹荪子实体和提取多肽(DIP)的基本营养成分Table 1 The nutritional components of the fruiting bodies of Dictyophora indusiata and DIP(g/100 g)
注:*代表同一组分内子实体和DIP的显著性差异,P<0.05。
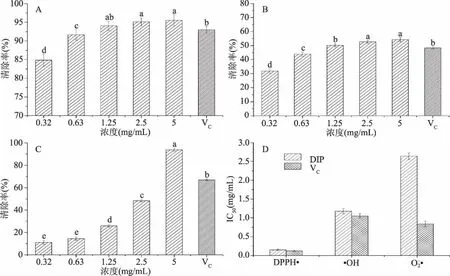
图3 DIP自由基清除活性Fig.3 Free radical scavenging activity of DIP注:A为DPPH自由基;B为羟自由基;C为超氧阴离子自由基;D为IC50。不同字母表示差异显著(P<0.05),图4同。
大量研究证实,人体众多生理活动都受到氧化压力的影响。氧化压力会介导诸如炎症、衰老、动脉粥样硬化、神经退行性疾病及肿瘤等多种疾病[13-14]。许多学者致力于寻找天然抗氧化剂。真菌源抗氧化剂研究较为深入,白肉灵芝(Ganodermaleucocontextum)水提物对H2O2诱导的PC12细胞凋亡具有一定的缓解作用[15],鲍姆木层孔菌(桑黄,Phellinusbaumii)脂溶性提取物具有良好的还原力,可以有效延缓叠氮钠引起PC12细胞衰老[16]。就具体活性成分而言,真菌多糖、多酚、黄酮类物质是主要抗氧化剂。松茸(Tricholomamatsutake)多糖TMP-A能够清除DPPH自由基,IC50为2.20 mg/mL[17],印度块菌(Tuberindicum)多糖TIP-1清除DPPH自由基的IC50值为1.72 mg/mL[18]。DIP对DPPH自由基的清除效果极好,作用浓度为0.32 mg/mL时,清除率接近85%。同样是抗氧化活性多肽,DIP的DPPH自由基的清除优于牡蛎蛋白酶解多肽(IC50值为1.16 mg/mL)[19]。因此,在研究较为深入的真菌多糖、动物源多肽外,真菌抗氧化活性多肽也可以作为一种天然抗氧化物质,拓宽真菌抗氧化剂的提取范围。
2.3 DIP的细胞毒性评价
DIP处理RAW264.7细胞24 h,经MTT测试发现,较低浓度DIP(3.13~50 μg/mL)对细胞未见明显毒性,细胞存活率没有出现显著下降(图4)。然而,继续提高DIP的浓度,则会表现出一定的细胞毒性。高浓度(100、200 μg/mL)的DIP则会抑制RAW264.7细胞的增殖。基于以上分析,本文选用较低浓度的DIP(3.13、6.25、12.5、25、50 μg/mL)完成后续实验。
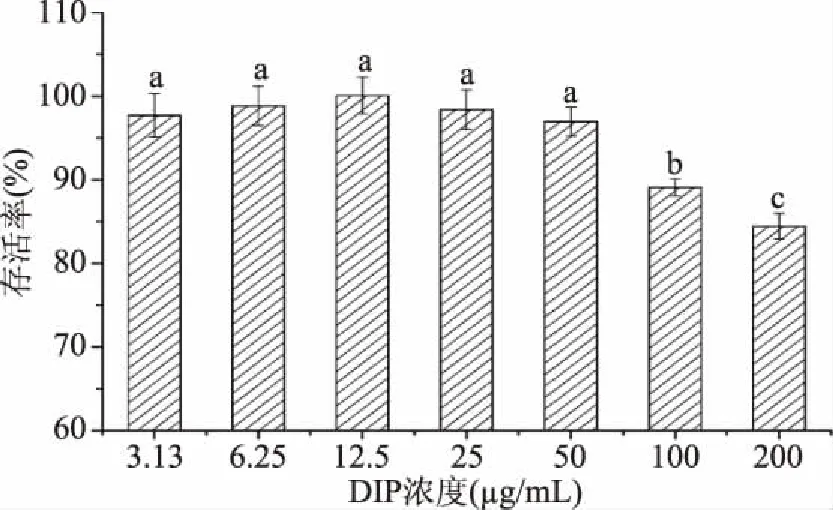
图4 DIP的细胞毒性Fig.4 Cytotoxicity of DIP
2.4 DIP的免疫强化作用
2.4.1 中性红吞噬活性 通过测定RAW264.7细胞对中性红吞噬能力的改变来验证DIP能否强化细胞吞噬能力,结果如图5所示,DIP能够显著促进RAW 264.7细胞的中性红吞噬能力。实验选择的最低浓度的DIP(3.13 μg/mL)处理后就能显著提高RAW264.7细胞的吞噬效果,较空白对照吞噬活性提高了近1倍。当DIP浓度达到12.5 μg/mL,吞噬效果与空白对照呈现出极显著的差异,已经超过阳性对照LPS。进一步提高DIP浓度,吞噬效果呈现高位稳定。
吞噬作用是巨噬细胞最具有代表性的免疫活动之一。通过中性红吞噬实验,我们发现DIP能够较强的促进细胞的吞噬能力,说明DIP能够提高先天免疫反应。
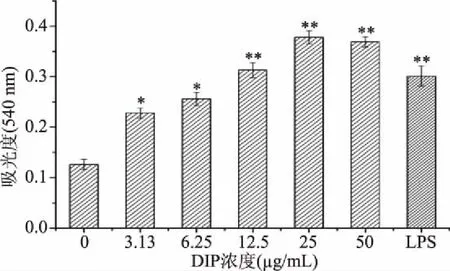
图5 DIP促进RAW264.7细胞吞噬中性红Fig.5 Enhanced phagocytosis of neutral red of RAW264.7 cells by DIP注:与空白对照组比较,*表示差异显著P<0.05, **表示差异极显著P<0.01,图6、图7同。
2.4.2 DIP对信息递质NO分泌的影响 按照Griess试剂法的NO测定试剂盒的要求操作,建立回归方程如下:Y=0.0322X+0.0968,R2=0.9962(X为所测标准品浓度,Y为所测吸光值),该回归方程适用的吸光度范围:0~3.3。
如图6A所示,DIP处理后,NO浓度极显著的上升。3.13 μg/mL的DIP使得NO浓度提高了近2.5倍。12.5 μg/mL DIP作用效果与阳性对照LPS相当。进一步提高DIP浓度,NO浓度未出现明显变化,在高位保持稳定。DIP对RAW 264.7细胞分泌NO的作用十分迅速,32 h可达峰值,随后急剧下降,阳性对照LPS作用较慢,48 h达到峰值。
NO是最具有代表性的生物活性信息递质之一,能介导机体免疫、炎症等多种生理和病理过程。现代研究表明,人体获得性免疫、自身免疫疾病等都与NO的分泌密切相关[20]。就巨噬细胞而言,一方面,NO可以作为一种细胞毒性成分释放,直接杀伤侵入有机体的微生物;另一方面,通过多种信号传导,NO能够启动级联免疫反应,阻止肿瘤细胞繁殖与扩散。实验中,DIP对NO分泌作用十分迅速,但是有效作用时间较短。DIP作为一种分子量小于3500 Da的多肽,较小的分子量使得其吸收相对迅速。作用时间较短,说明DIP的结构可能不大稳定,因此,如何提高真菌小分子活性多肽的稳定性是今后研究的重点。
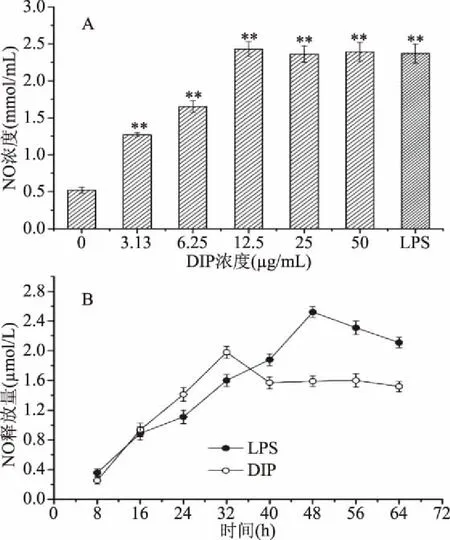
图6 DIP促进RAW264.7细胞产生NO作用(A) 和RAW264.7细胞产生NO时间点(B)Fig.6 NO production(A)and its point in time(B)of stimulated RAW264.7 cells by DIP
2.4.3 DIP对RAW264.7细胞细胞因子分泌的影响 按照ELISA试剂盒的要求,绘制出3种细胞因子的标准曲线,依次建立回归方程如下:TNF-α:Y=0.0024X+0.1284,R2=0.9923(X为所测标准品浓度,Y为所测吸光值,下同);IL-1β:Y=0.0151X+0.0846,R2=0.9981;IL-6:Y=0.0139X+0.0756,R2=0.9982。
如图7,DIP对RAW264.7细胞3种细胞因子分泌的促进作用与其浓度直接相关,低浓度作用较弱,中浓度明显增强,高浓度高位稳定的趋势。12.5 μg/mL的DIP其促进作用与阳性对照相当,继续增高DIP浓度,促进作用未见明显增强。DIP对TNF-α及IL-6分泌促进作用较强。3.13 μg/mL的DIP就能使得TNF-α的分泌呈现出极显著的差异(P<0.01)。
巨噬细胞通过分泌诸如细胞因子等生物活性物质,以此来调控局部微环境,保护机体免受外界不良因素的侵害[21]。作为一种小分子多肽,DIP对于多肽类的细胞因子分泌的促进作用效果十分明显,12.5 μg/mL的DIP能够将TNF-α的含量提高一倍(图7),已有学者报道400 μg/mL的灵芝孢子粉多糖对腹腔巨噬细胞产生TNF-α的促进率为50%[22],显然,小分子多肽的促进效率更高,因此,如何分离提纯小分子多肽值得进一步研究。
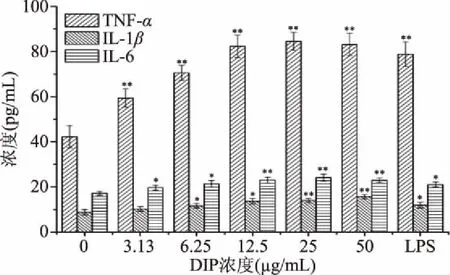
图7 DIP促进RAW264.7细胞产生细胞因子作用Fig.7 Effects of DIP stimulated cytokines secretion in RAW264.7 cells
2.4.4 DIP对RAW264.7细胞Toll样受体表达的影响 不同浓度DIP溶液作用于RAW264.7细胞后,细胞膜蛋白Toll样受体TLR2和TLR4表达量的变化情况如图8。从图8中可以看出,DIP处理后,RAW264.7细胞在TLR4和TLR9的表达量显著升高,均呈现逐渐上升的变化趋势,表现出一定的剂量依赖关系。DIP作用浓度后,TLR4的表达量峰值为17.09 ng/mL,TLR9的表达量峰值为15.98 ng/mL。
Toll样受体(Toll like receptors,TLRs)是巨噬细胞、树突状细胞等抗原呈递细胞表面识别多种病原体及内源性物质的跨膜蛋白,能够高效识别来源于微生物的具有保守结构的分子。巨噬细胞激活后,通过TLRs介导一系列免疫反应,如激活核转录因子NF-κB,促进NF-κB的核膜转位,激活下游的抗凋亡基因(Bcl-2等)、抗肿瘤(TNF-α等)相关蛋白的表达[23]。
通过上述一系列实验,发现DIP能够促进Toll样受体的表达,活化巨噬细胞,增强其吞噬作用并促进其分泌细胞因子,对整个免疫过程都起到一定的强化作用。相关研究证实,激活巨噬细胞是先天和适应性免疫一个关键事件,因此,后续实验应该集中于介导巨噬细胞激活的一系列信号转导途径,以探索DIP精细的作用通路。
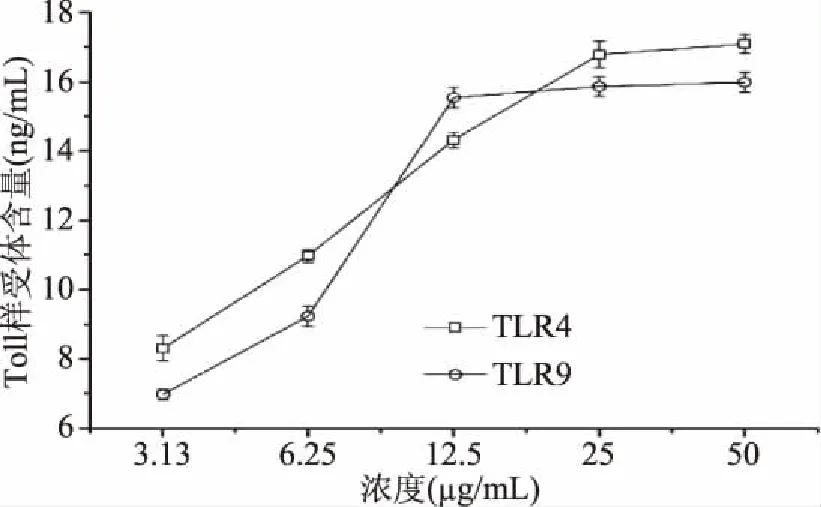
图8 DIP对Toll样受体表达的影响Fig.8 Effect of various concentrations of DIP on Toll like receptor expression
3 结论
本实验分离获得长裙竹荪子实体多肽(DIP)并验证其抗氧化和免疫调节活性。通过透析,分子排阻色谱和反相高效液相色谱分离可获得纯度较高的多肽DIP,DIP的得率为0.59%,粗蛋白含量70.35%。自由基清除实验确认DIP具有优良的自由基清除活性,对DPPH自由基表现出极强的清除活性,IC50为0.15 mg/mL。对羟自由基和超氧阴离子自由基也具有良好的清除活性。进一步的功效实验发现,DIP能够强化巨噬细胞的吞噬活性,12.5 μg/mL的DIP能够提高RAW264.7细胞的吞噬活性近200%。DIP能够促进细胞因子的释放,12.5 μg/mL的DIP能够将TNF-α的含量提高1倍。进一步确定DIP可以提高Toll样受体的活性,通过Toll受体的表达,活化巨噬细胞,在先天和适应性免疫中都能发挥作用。因此,DIP能够增强机体免疫,可作为一种免疫活性肽加以开发利用,在保健品、药品开发中具有一定的应用前景。
