维生素K2高产菌株的筛选与发酵条件优化
2019-02-18,*
,*
(1.石河子大学生命科学学院,新疆石河子 832003; 2.新疆阜丰生物科技有限公司,新疆乌鲁木齐 830001)
自然界中已发现的维生素K有两种,即维生素K1(叶绿醌)和维生素K2(甲萘醌),所有维生素K都具有2-甲基-1,4-萘醌母环,区别仅在于3位的侧链不同(图1所示)[1]。维生素K2结构是由一个甲基萘醌母环和一条位于母环C3位置上的异戊二烯侧链组成,根据侧链上异戊二烯单元个数差异,维生素K2共分为l4种,以MK-n表示,MK-7即侧链上含有7个异戊二烯单元[2]。维生素K的生理功能一直以来被认为与凝血有关,近年来发现维生素K2可以激活骨钙素,促使血液中的钙质沉积到骨骼,对于预防和治疗骨质疏松有重要作用;同时,维生素K2可以活化血管中的蛋白质钙化抑制蛋白基质γ-羧基谷氨酸蛋白,因而会阻碍钙质沉淀于动脉血管,防止动脉硬化,降低心血管疾病的发病率[3]。

图1 维生素K1(a)和K2(b)的分子结构Fig.1 Molecular structure of vitamin K1(a)and K2(b)
维生素K2可以由芽孢杆菌、乳酸菌、黄杆菌等多种细菌合成[4],在细菌的氧化磷酸化过程中作为电子传递链的组分[5-6],国内外研究中,用于合成维生素K2的主要微生物是芽孢杆菌属微生物和黄杆菌。黄杆菌合成的维生素K2主要以MK-4和MK-6两种形式存在,芽孢杆菌发酵生成的维生素K2主要是MK-7。在维生素K2的十四个同系物中,MK-7的生理活性好,且半衰期比其他同系物都长,因此所需的服用剂量小,是最佳的维生素K2补充物[3]。2006年,维生素K2(MK-7)已经被FDA和欧洲食品安全管理局批准使用,日本也有维生素K2药品上市。维生素K2已经成为国际上新兴的功能性保健食品。国家卫计委2016年发布公告批准发酵型维生素K2作为食品营养强化剂新品种,并拟将发酵法生产的维生素K2作为营养强化剂加入调制乳粉、固体饮料、风味发酵乳和含乳饮料中。
维生素K2作为新兴功能性保健食品,正越来越受到关注。但利用微生物发酵方法生产维生素K2还处于起步阶段,最大制约是菌株的产量较低。土壤中芽孢杆菌资源丰富,本研究从土壤中筛选能够高产维生素K2的菌株,对该菌株进行鉴定,并对其提取方法和菌株的发酵特性进行初步研究,为工业化生产提供参考。
1 材料与方法
1.1 材料与仪器
土壤样品 取自新疆石河子市郊区;维生素K1、K2(MK-7)标准品 日本和光纯药工业株式会社(Wako Pure Chemical Industries,Ltd.);二氯甲烷、正己烷、异丙醇、甲醇 美国赛默飞世尔公司(Thermo Fisher Scientific Inc.);酵母粉 英国Oxoid公司;大豆蛋白胨 北京奥博星生物技术有限公司;其他试剂均为分析纯 国药集团化学试剂有限公司;种子培养基(g/L) 牛肉膏5,蛋白胨10,葡萄糖10,NaCl 5;发酵培养基(g/L) 甘油50,大豆蛋白胨100,酵母粉0.6,K2HPO40.3,CaCl2·2H2O 0.1,MgSO4·7H2O 0.3;菌种传代保藏培养基(g/L) 蛋白胨10,酵母提取物5,氯化钠10,琼脂粉15。
1200型高效液相色谱仪(配有可变波长紫外检测器及色谱工作站) 美国安捷伦公司。
1.2 实验方法
1.2.1 菌种筛选方法 将采集的土壤样品用无菌水稀释后在95 ℃水浴30 min,然后在种子培养基上划线分离纯化获得单菌落。挑取单菌落连续划线分离三次后进行初筛。初筛时将单菌落进行斜面培养后接入发酵培养基中进行摇瓶发酵,发酵结束检测其MK-7的含量。将含量较高的菌株斜面保存于4 ℃冰箱,再次传斜面活化后进行复筛。复筛时首先将斜面菌种接入种子培养基培养,种子培养成熟后接入发酵培养基培养,发酵结束检测其MK-7的含量,保留产量稳定的菌株制备甘油冷冻管(菌液添加20%甘油)保存于-80 ℃冰箱。
1.2.2 培养方法 平板与斜面培养:将筛选获得的菌种在种子培养基斜面上划线并放在恒温箱中37 ℃条件下培养8~12 h。
种子培养:取30 mL种子培养基置于250 mL锥形瓶,将斜面培养后的菌种接种到种子培养基中,放置在摇床中37 ℃下200 r/min培养16~18 h。
发酵培养:取30 mL发酵培养基置于250 mL锥形瓶,按10%的接种量,用移液管将培养好的种子接种到发酵培养基中,放置在摇床中37 ℃下200 r/min培养4 d。
1.2.3 菌种鉴定方法 对筛选获得的菌株分别采用16S rRNA基因和gyrB基因序列进行分子生物学鉴定。将菌株采用CTAB法提取基因组DNA,以其为模板,设计正向引物和反向引物,进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,扩增产物经1%的琼脂糖凝胶电泳检测后由上海生工生物工程完成测序。将测得的基因序列在GenBank中进行搜索Blast比对,寻找与其同源性最高且已知分类地位的菌种,并采用MEGA6.0软件以邻接(Neighbor Joining)法构建系统发育树[7]。PCR扩增引物采用Prime premier 6软件设计。扩增16S rRNA基因所用引物为细菌通用引物,引物序列为:27F:AGAG TTTGATCCTGGCTCAG,1492R:GGTTACCTTGTTA CGACTT。扩增gyrB基因所用引物为:F:CCCAA GCTTAACTGCACTGGGAAATYGTHGAYAAYAG,R:CGGAATTCGGATCC ACRTCGGCRTCBGTCATRAT。扩增条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min;34个循环;72 ℃延伸10 min。将PCR扩增片段回收后送上海生工生物工程有限公司测序。将测序结果与NCBI数据库对比,绘制系统发育树。
1.2.4 发酵样品中MK-7提取方法 按1.2.2发酵培养方法进行发酵,采用有机溶剂液液萃取方式从发酵液中提取MK-7,选取正己烷与异丙醇(体积比为2∶1)作为萃取液,通过改变水相(发酵液)与有机相(萃取液)的比例,按水相:有机相体积比为1∶1、1∶2、1∶3、1∶4进行提取,确定最佳比例,后续提取均采用最佳比例进行。萃取时将混合物置于涡旋振荡仪上振荡5 min,再将混合物3000 r/min离心10 min,吸取上层液体进行浓缩。利用旋转蒸发仪对有机相进行浓缩5 min,用锡箔纸包裹蒸发瓶进行操作,浓缩后得到黄色油状液体,加2 mL异丙醇溶解,放于1.5 mL离心管中,用锡箔纸包裹进行避光保存,用于HPLC分析[8]。
1.2.5 样品中MK-7的分析方法 采用高效液相色谱(HPLC)法对MK-7含量进行测定。色谱柱为安捷伦ZORBAX Eclipse XDB-C18;流动相为甲醇∶二氯甲烷(9∶1);流速:1.0 mL/min;柱温:40 ℃;进样量:20 μL;紫外检测波长:248 nm。将按照上所述提取方法得到的提取液经微孔滤过膜(0.45 nm)过滤后进样。所有操作避光进行[9]。
标准品的配制:准确称取10 mg MK7标准品于50 mL棕色容量瓶中,加入30 mL异丙醇充分溶解定容,并在恒温水浴锅振荡1 h。然后按梯度稀释成浓度分别为1、4、8、16和32 μg/mL的标准液,用0.45 μm微孔滤膜过滤,液相色谱测定,以峰面积和标准品浓度制作标准曲线。
发酵液中的MK-7用1.2.4方法提取后用液相色谱测定,发酵液的MK-7浓度用标准曲线计算获得。

图2 基于16S rRNA和gyrB基因的菌株ND系统发育树Fig.2 16S rRNA and gyrB gene sequence based phylogenetic tree for strain ND
1.2.6 发酵条件优化方法 对高产菌种的碳源、氮源和无机盐进行单因素优化。发酵培养基中分别添加不同种类的碳源甘油5%、蔗糖5%、葡萄糖5%和可溶性淀粉(5%),根据最终发酵液中MK-7的浓度确定最佳碳源种类,并对最佳碳源的使用浓度进行考察,添加量设为5%、10%、15%、20%进行发酵,确定最佳碳源浓度。
发酵培养基中分别添加8%、10%、12%、14%、16%大豆蛋白胨,根据发酵后MK-7的产量确定最佳氮源。
在添加最优浓度的碳源和氮源条件下,对发酵培养基中的K2HPO4、CaCl2·2H2O、MgSO4·7H2O三种无机盐的浓度进行优化。K2HPO4的浓度梯度设置为0.1、0.3、0.5、0.7和1.0 g/L,CaCl2·2H2O的浓度设置为0、0.1、0.2、0.3和0.4 g/L,MgSO4·7H2O的浓度设置为0.1、0.3、0.5和0.7 g/L。
1.3 数据处理
每个实验重复三次,取三次实验的平均值,采用Excel(Microsoft office 2010)软件计算标准误并作图。
2 结果与分析
2.1 产维生素K2菌株的筛选与鉴定
由于合成MK-7的主要菌种为芽孢杆菌属微生物,本研究以芽孢杆菌属微生物为筛选目标[10-11],经过初筛和复筛,获得产量较高的5株菌(表1)。后续实验选定产量最高的菌株ND,并对其进行分子生物学方法进行鉴定。

表1 筛选出的菌株及其MK-7产量Table 1 Selected strains and its MK-7 yield
因为16S rRNA的高度保守性,对相似率极高的近缘种无法做进一步区分,而gyrB基因相对于16S rRNA基因具有较高的碱基替换率,因此比较适合亲缘关系较近的菌种的区别和鉴定[12]。本研究采用两种基因序列比对进行菌种的鉴定。通过PCR扩增分别获得两个基因序列,测序后与NCBI数据库的序列进行Blast比对,并构建系统进化树。以16S rRNA序列构建的进化树结果如图2。从这两种鉴定方法所获得的结果来看,本实验所获得的菌株ND属于芽孢杆菌属的一个分支,且与解淀粉芽孢杆菌(Bacillusamyloliquefaciens)的菌株同属于一个类群。
2.2 样品中MK-7的定性与定量测定
采用高效液相色谱对发酵液的提取物进行定性和定量。取菌株ND的发酵液,按1.2.4所描述的方法对发酵液进行提取,并利用高效液相色谱检测提取物中的MK-7,结果见图3,图中发酵产物特征峰保留时间在14.1 min,与MK-7标准品的液相色谱图对比,两峰保留时间相同,发酵产物特征峰为目标产物MK-7。

图3 发酵提取物和MK-7标准品的液相色谱图Fig.3 HPLC chromatograms of fermented extracts and MK-7 standard
按1.2.5的方法对MK-7进行液相色谱测定,以MK-7标准品浓度为横坐标,色谱峰面积为纵坐标制作标准曲线,结果见图4。MK-7与峰面积具有良好的线性关系,其线性回归方程为y=34.051x+8.7149,R2为0.9994。该线性方程可用来计算样品中的MK-7浓度。

图4 MK-7标准曲线Fig.4 Standard calibration curve of MK-7
2.3 萃取液比例对MK-7提取的影响
MK-7是一种脂溶性维生素,所以提取MK-7主要通过使用有机溶剂液-液萃取的方式。常用的有机溶剂为异丙醇与正己烷的混合液[13-14]。为了确定萃取时最佳的萃取液与发酵液的比例,测定了不同比例下萃取效果,结果如图5所示。在1∶1~1∶2时,随着有机相体积比例增加,MK-7在有机相中的萃取效果逐渐提高,水相与有机相比例为1∶2时MK-7萃取效果最好,在水相∶有机相=1∶4时萃取效果最差,增大有机溶剂体积并不能提高MK-7的萃取效果。萃取时需要对反应液进行强烈涡旋震荡,而添加过多的有机溶剂可能不利于震荡时与发酵液及菌体充分混合和接触,后续实验选择萃取比例为水相与有机相比例为1∶2。

图5 萃取过程中不同的水相 和有机相比例对MK-7提取的影响Fig.5 Effects of different proportion of water and organic on extraction of MK-7 phase
2.4 MK-7在菌体胞内和胞外的分布
将发酵液离心分离菌体,将菌体和上清液分别进行萃取和测定MK-7含量,确定MK-7在菌体胞内外的分布,结果见图6。MK-7大部分存在于细胞外,少量存在于细胞内。将发酵液直接萃取获得的MK-7产量比将菌体和发酵上清液分别萃取略低。上述结果提示大部分MK-7合成后分泌到细胞外。Sato等[15]在枯草芽孢杆菌中发现40%~65%的MK-7分泌到了细胞外,周子民等[16]也在纳豆芽孢杆菌中发现有MK-7在发酵过程中有68%的分泌率,本研究的结果与其报道一致。
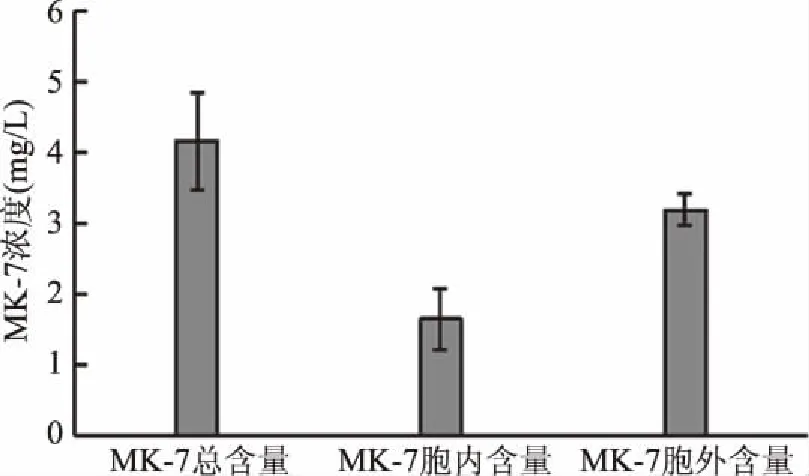
图6 菌体胞内和胞外MK-7的含量Fig.6 Concentration of MK-7 in intracellular and extracellular
2.5 发酵条件的优化
2.5.1 碳源对解淀粉芽孢杆菌ND合成MK-7的影响 比较了5%添加量的甘油、蔗糖、葡萄糖和可溶性淀粉几种解淀粉芽孢杆菌的常用碳源对MK-7产量的影响,比较结果见图7。使用甘油作为碳源其效果最为理想。部分文献报道甘油是合成MK-7的最佳碳源,本论文结果与文献报道一致[14-16]。根据对解淀粉芽孢杆菌和MK-7的代谢途径分析推测,甘油分解后产生的3-磷酸甘油醛可以与丙酮酸通过DXP途径合成MK-7的异戊二烯侧链部分[17-18],因此推测甘油除了供微生物生长之外,还为MK-7的合成提供前体,促进菌体合成MK-7,故选择甘油作为最佳碳源。

图7 不同碳源对菌株ND合成MK-7的影响Fig.7 Effects of different carbon source on the yield of MK-7 production by ND
对甘油的使用浓度进行了考察,从图8可以看出,当甘油浓度为5%时,MK-7产量最高,因此选择5%浓度的甘油作为发酵碳源。甘油浓度较高并不利于MK-7合成,可能高浓度甘油对细菌的生长有一定的抑制作用,在其他种类微生物中已有报道[19-20],碳源最终选择浓度为浓度为5%。

图8 碳源浓度对菌株ND合成MK-7的影响Fig.8 Effects of carbon source concentration on the yield of MK-7 production by ND
2.5.2 氮源浓度对解淀粉芽孢杆菌ND合成MK-7的影响 一些MK-7含量较丰富的发酵食品,例如日本传统发酵食品纳豆[21-22],通常以大豆作为原料进行固态发酵,而在大多数文献中,大豆蛋白胨是合成 MK-7的最佳氮源[13-16],因此选用大豆蛋白胨作为氮源,研究了不同的大豆蛋白胨浓度对菌体合成MK-7产量的影响,结果见图9。12%的大豆蛋白胨作为氮源,MK-7产量最高,达到了63 mg/L。大豆蛋白胨中含有丰富的蛋白质、氨基酸、生长因子,作为氮源能促进微生物生长,但氮源浓度过高,导致碳氮比失衡菌体过度生长,其他养分被过早耗尽,菌体衰老而不利于产物的合成[23],因此MK-7产量随之下降。
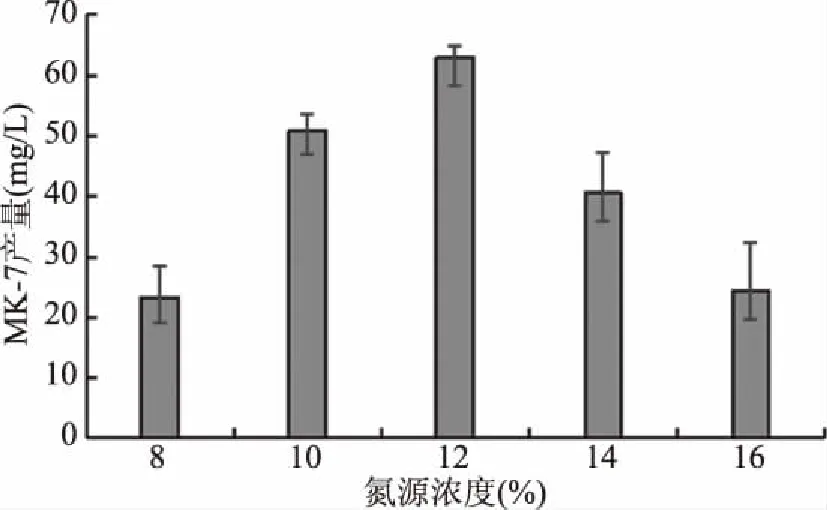
图9 氮源浓度对菌株ND合成MK-7的影响Fig.9 Effects of carbon source concentration on the yield of MK-7 production by ND
2.5.3 无机盐浓度对解淀粉芽孢杆菌ND合成MK-7的影响 在获得最佳碳源和氮源的基础上,进一步考察了无机盐对维生素K2合成的影响,结果见图10~图12。结果表明三种无机盐均对MK-7的合成具有一定的影响,最佳的添加浓度分别是K2HPO4浓度为0.7 g/L,CaCl2·2H2O浓度为0.2 g/L,MgSO4·7H2O浓度为0.5 g/L。适当浓度的钙离子和镁离子都对MK-7合成具有一定的促进作用。添加0.2 g/L CaCl2·2H2O,菌株ND合成MK-7的产量达到70 mg/L以上,高于多数被报道过的芽孢杆菌属微生物[24-25]。磷酸盐是菌体生长的主要营养成分之一,适量的磷酸盐在发酵过程中可以促进菌体生长,也能够直接或间接影响代谢物的合成。金属离子一般通过影响某些酶的活性而影响产物的合成[23]。有不少文献报道了金属离子对微生物发酵的影响,无机盐一般在低浓度是对微生物生长有促进作用,在高浓度时有抑制作用,不同微生物对无机盐的需求范围不同[26-27]。

图10 K2HPO4浓度对MK-7产量的影响Fig.10 Effects of K2HPO4 concentration on the yield of MK-7

图11 CaCl2·2H2O浓度对MK-7产量的影响Fig.11 Effects of CaCl2·2H2O concentration on the yield of MK-7

图12 MgSO4·7H2O浓度对MK-7产量的影响Fig.12 Effects of MgSO4·7H2O concentration on the yield of MK-7
3 结论
本研究通过筛选获得一株高产MK-7的微生物,将该菌的gyrB基因和16S rRNA与其他微生物的基因进行比对,确定该菌株属于芽孢杆菌属,且与解淀粉芽孢杆菌(Bacillusamyloliquefaciens)的菌株同属于一个类群。对该MK-7高产菌株的产物提取进行优化,最优提取溶剂比例为有机相(正己烷∶异丙醇=2∶1):水相(发酵液)=2∶1。将发酵液的菌体和上清液分别进行萃取和测定MK-7含量,确定MK-7大部分分泌到胞外。对培养基中的几个重要组分(碳源、氮源和无机盐)及使用浓度进行单因素优化,甘油是MK-7合成的最佳碳源,添加的最适浓度为5%;大豆蛋白胨最适浓度为12%。适当浓度的磷酸盐和金属离子Ca2+、Mg2+对MK-7合成有促进作用,添加的最适浓度分别是K2HPO40.7 g/L,CaCl2·2H2O 0.2 g/L,MgSO4·7H2O 0.5 g/L。利用优化后的培养基进行发酵培养,最终该菌株合成MK-7的最高产量达到70 mg/L以上。
