Mg/Al比对CH4-CO2重整制合成气Mg(Ni,Al)O复合氧化物催化剂性能的影响
2019-02-18黄艳丽李晓东
黄艳丽,李晓东,黄 伟*
(1.太原理工大学,煤科学与技术教育部和山西省重点实验室,山西 太原 030024;2.晋中学院,化学化工学院,山西 晋中 030619)
大气中的主要温室气体(CH4、CO2)浓度不断上升,造成了日益严重的全球变暖问题,并引起了世界各国的广泛关注。甲烷二氧化碳重整(CRM)不仅有效利用了CH4和CO2两种温室气体,同时可得到具有工业价值的合成气(n(CO)/n(H2)≈1),该合成气可作为下游费托合成等的原料[1,2]。Ni基催化剂由于成本较低、活性好而被认为是用于该反应最有工业化前景的催化剂,然而其易因烧结和积炭而失活[3,4],应用受到一定限制。
类水滑石化合物由于其独特的物理化学性质而被广泛用作催化剂或催化剂载体。此外,它们焙烧后获得的混合金属氧化物具有高的比表面积、小晶粒尺寸和高分散性[5]。本课题组前期的研究中由Ni-Mg-Al类水滑石为前驱体制备的Ni基催化剂在CRM反应中表现出较高的催化活性和稳定性,这与许多研究结果一致。然而许多对催化剂的研究都是在固定的Mg/Al比下进行的,许多研究者发现Mg/Al比对催化性能有很大的影响。在我们前期的工作中研究了M2+/M3+对催化剂碱度的影响进行了研究[6]。本文通过共沉淀法制备一系列不同Mg/Al比的Ni-Mg-Al类水滑石前驱体,并将焙烧后的Mg(Ni,Al)O混合氧化物催化剂催化剂用于甲烷二氧化碳重整反应中,考查了Mg/Al比对催化剂活性的影响。
1 实验部分
1.1 催化剂制备
将一定量的Na2CO3溶于120mL去离子水中,并将其转移到三口烧瓶中,然后将三口烧瓶置于60℃的水浴锅中。强力搅下,同步将150mL Ni,Mg,Al的硝酸盐混合溶液和100mL NaOH溶液逐滴加入装有Na2CO3溶液的三口烧瓶中,控制滴加速度使溶液的pH值维持在9.15,滴加完成后,持续搅拌1h后,将悬浮液转入晶化釜中,在恒温烘箱中80℃晶化24h;晶化完成后,将悬浊液进行冷却、抽滤、洗涤至pH=7。将滤饼在80℃下干燥12h,干燥后的滤饼在马弗炉中以5℃/min的升温速率从室温升至800℃,并恒温焙烧6h,造粒待用。此外,焙烧后NiO的质量分数分别控制在10%。根据其Mg/Al的摩尔比,催化剂分别命名为0.5MgAl,1MgAl,2MgAl,3MgAl。
1.2 催化剂表征
1.2.1 X射线衍射(XRD)
催化剂的体相组成和结构在DX-2700 X-ray型衍射仪上用连续扫描法测定,扫描范围2θ=5°~85°,扫描速率为8°/min,步长0.01°。
1.2.2 程序升温氧化(O2-TPO-MS)
1.2.3 H2程序升温还原(H2-TPR)
H2-TPR在TP-5000(天津先权)型程序升温吸附仪上进行。将50mg焙烧后的催化剂装入石英微型反应器。使用纯氦气(He)在150℃下吹扫30min,降温至50℃将后切换为H2+N2混合气(5%H2、95%N2)并维持30min,待基线稳定后,然后以10℃/min的升温速率、20mL/min还原气流速从50℃升至900℃,热导检测耗氢量,以Ag2O作为标准计算其耗氢量。
1.2.4程序升温脱附(CO2-TPD-MS)
催化剂的碱性位点是在与O2-TPO-MS相同的设备上进行的。将100mg还原后催化剂装入石英管微型反应器,用纯He气在280℃下恒温吹扫30min,降温至50℃用CO2气体脉冲吸附至饱和,待吸附饱和后,将气体切换为He气吹扫30min,然后从50℃升至900℃进行程序升温氧化反应(升温速率10℃/min)。尾气使用HIDEN(QIC-20)型质谱检测,绘制CO2或NH3脱附量与温度的关系曲线,以此来判断碱性位的种类。根据公式(1)计算催化剂的碱性位点数。
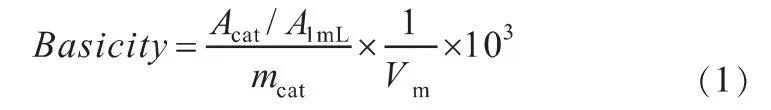
式中:Basicity—碱量,mmol/g;Acat—TPD图谱中测定的催化剂的CO2信号的积分峰面积;A1mL—1mL CO2的校准脉冲面积;mcat—催化剂质量,g;Vm—CO2摩尔体积,mL/mol。
1.2.5 N2物理吸脱附
N2物理吸脱附实验在Micromeritics ASAP 2020系列吸附仪上进行,采用BJH和BET公式计算催化剂的平均孔径和比表面积。
③Antonio Capobianco and Hans Christiansen,Competitive Neutrality and State-Owned Enterprises:Challenges and Policy Option,p.11,OECD Publishing,2011.
1.3 催化剂评价
CH4-CO2重整催化剂的活性和稳定性评价在常压固定床反应器上进行。将300mg催化剂(40~60目)与1.5g石英砂(40~60目)混合均匀后放入石英管内,并将石英管反应器固定于加热炉内。在CH4-CO2重整反应前使用程序升温控制仪控制温度,在N2(20mL/min)-H2(20mL/min)气氛下程序升温还原。第一段,室温~450℃,升温速率5℃/min,耗时150min;第二段,450~900℃,升温速率为1℃/min至900℃,耗时450min;第三段,在900℃恒温还原120min。之后切换为V(CH4)/V(CO2)=1的原料气,GHSV=60000mL/(g h)于900℃下反应。使用上海海欣气相色谱仪(GC-950)检测(Ar为载气,柱子为TDX-01填充柱),产物的选择性和反应物的转化率采用外标法计算。反应物的转化率按下式计算:

式中:Fin为进口的气体流量,mL;Fout为出口的气体流量,mL;S为选择性。
产物分析采用GC-950(型号)气相色谱仪,色谱操作条件为:柱温130℃;热导池温度100℃;汽化室温度150℃;电流40A;进样量为1mL。
2 结果与讨论
2.1 催化剂活性测试
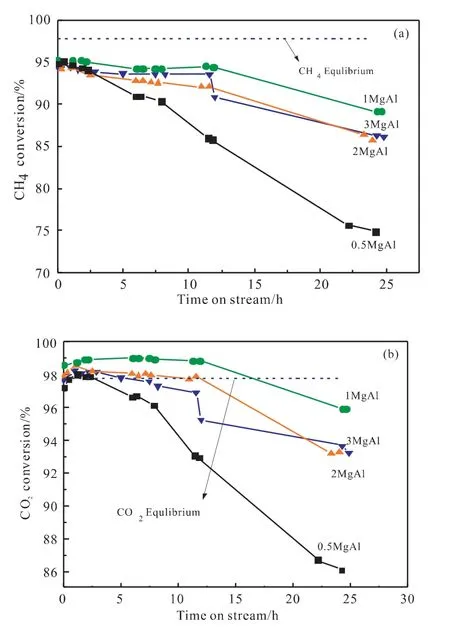
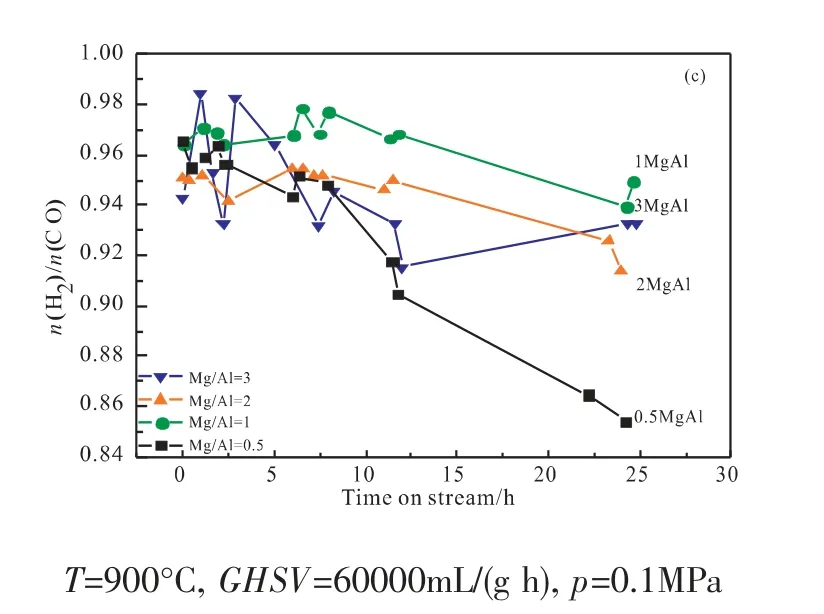
图1 不同镁铝比催化剂的反应性能:(a)甲烷转化率;(b)二氧化碳转化率;(c)H2/CO比Fig.1 Performances of catalysts with different Mg-Al ratios:(a)conversions of CH 4;(b)conversions of CO2;(c)H 2/CO molar ratio
图1为不同Mg/Al比催化剂的催化活性的评价结果。所有催化剂都呈现出较为接近的最初甲烷转化率,然而催化剂的稳定性是不同的。在24h的反应中,0.5MgAl催化剂的甲烷转化率从最初的95.0%降至74.8%,失活度为21.3%;继续增加Mg/Al比,1MgAl催化剂的从最初的95.3%降至89.8%,失活度仅为5.3%,2MgAl(94.6%→84.6%)和3MgAl(94.4%→86.0%)催化剂的失活度分别为10.6%和8.9%。对比图1(a)和(b)可知CO2转化率较CH4高,且最初CH4转化率低于其平衡值而CO2的转化率却高于其平衡值。这可能是逆水煤气反应存在造成的,这也导致图1(c)中n(H2)/n(CO)小于1[7]。
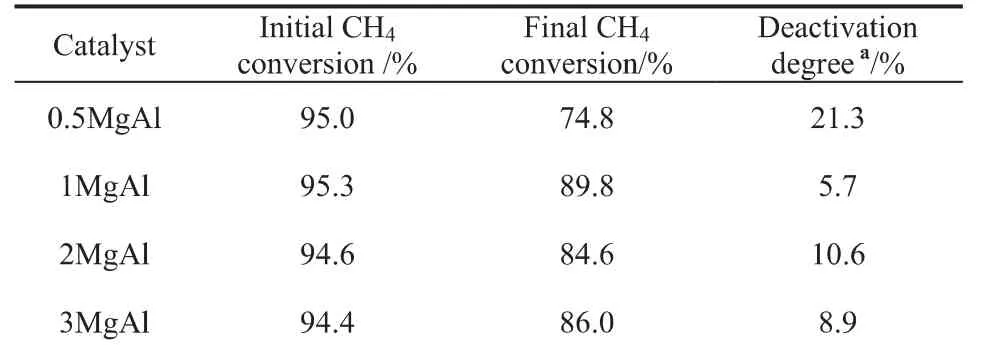
表1 最初、最终甲烷转化率和失活度Table1 Initial,final CH 4 conversion and deactivation degree
2.2 催化剂表征
2.2.1 X射线衍射(XRD)
图2(a)为未焙烧催化剂的XRD图谱。图中2θ=11.5°、23.1°、34.5°、39°、42.1°、60.7°和62°为水滑石的特征衍射峰,2θ=18.3°、20.5°为Al(OH)3的衍射峰。图2(a)中所有催化剂均出现了水滑石化合物的特征衍射峰,2MgAl和3MgAl催化剂的XRD谱图中为单一的类水滑石化合物晶相。1MgAl和0.5MgAl催化剂谱图中出现了Al(OH)3的衍射峰,这可能0.5MgAl,1MgAl催化剂中较低的Al3+/(Ni2++Mg2+)的比值有关。此外,从图中可以观察到的另一个现象是水滑石的衍射峰的强度随着Mg/Al比的增大而变强,说明合成的水滑石的结晶度逐渐变好。表2列出了使用Scherrer公式计算的晶格参数a[a=2d(110)]和c[c=3d(003)]。a值代表了板层结构中金属阳离子的平均半直径,c值与板层结构板层的距离、电荷密度、阴离子大小和水分子数量密切相关[8]。从表2可以看出随着Mg/Al比的增加,a和c值逐渐增加,这是由于不同金属阳离子具有不同的离子半径(Al3+(0.054nm),Mg2+(0.072nm),Ni2+(0.069nm))和电负性(Al(1.61),Mg(1.31),Ni(1.91))造成的。随着催化剂中的Mg2+(较大离子半径和较小电负性)的含量的增加使得a值和c值都增大。
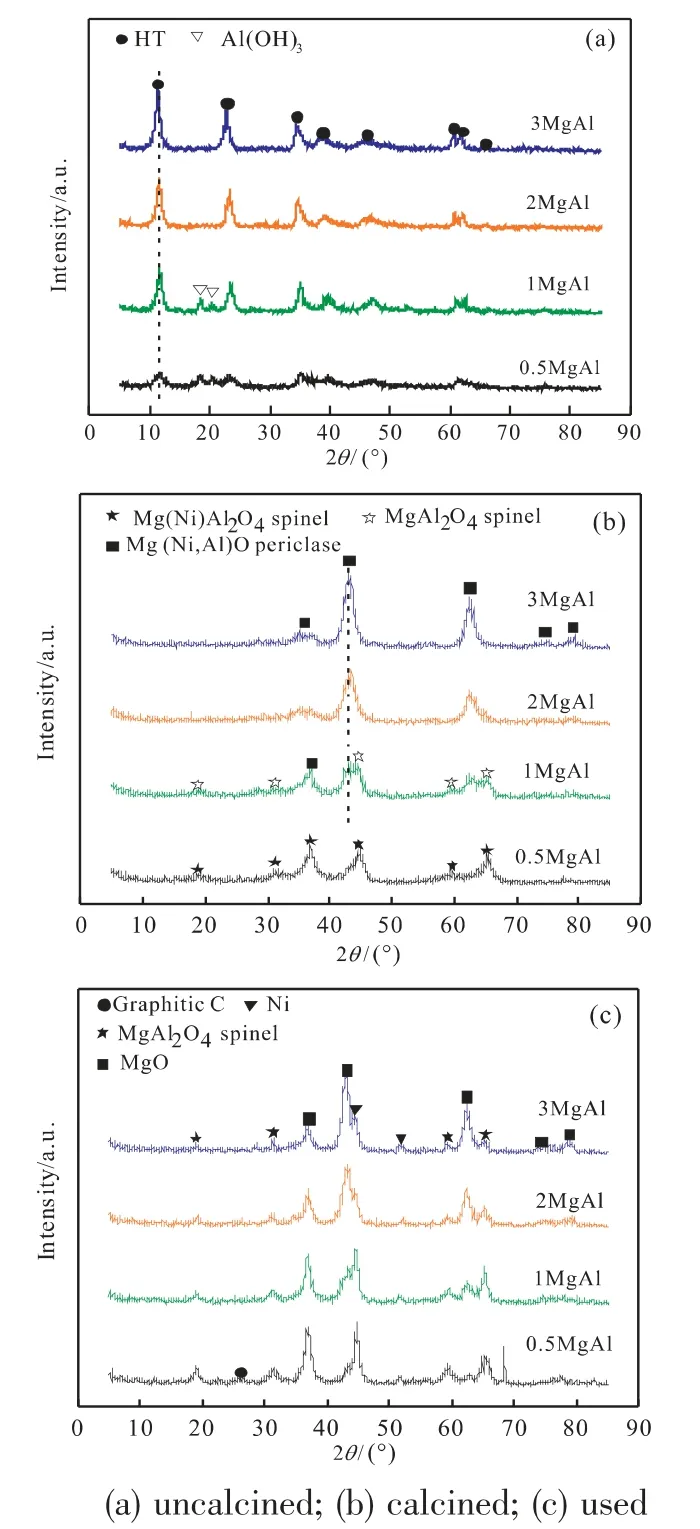
图2 催化剂的XRD图谱Fig.2 XRD patterns of catalysts
图2(b)为焙烧后催化剂的XRD图谱。Penkova等[9]的研究结果表明最终混合物氧化中的晶向组成与MgO的含量有关:当wMgO低于28%,则MgAl2O4和NiAl2O4尖晶石共存是可能的,相反,如果MgO的含量高于该值,则仅形成MgAl2O4尖晶石,并且Mg,Ni以过量形式存在MgO-NiO固溶体。根据实验过程中,对于0.5MgAl催化剂其wMgO低于28%,而其他催化剂wMgO均高于28%。因此,0.5MgAl催化剂中,2θ=19.0°、31.3°、36.8°、44.7°、59.7°和65.2°为Ni(Mg)Al2O4尖晶石的特征衍射峰。随着催化剂中Mg含量的增加(wMgO>28%),1MgAl的催化剂中出现了MgO-NiO固溶体与MgAl2O4的特征衍射峰。由于催化剂中Al含量的降低,导致2MgAl和3MgAl的两种催化剂均只出现了Mg(Ni,Al)O固溶体的特征衍射峰(2θ=35.3°、43.0°、62.6°、78.9°)此外,从图中可以看出Mg(Ni,Al)O固溶体的衍射峰强度随着Mg/Al比的增加逐渐增强。表2总结了焙烧后催化剂的详细织构性质,所有催化剂的比表面积都在170~206m2/g范围内,为水滑石来源的材料的典型的特征。
图2(c)为反应后催化剂的XRD谱图。这些样品的衍射图中出现了MgAl2O4尖晶石的特征衍射峰、MgO特征衍射峰和Ni的衍射峰(2θ=44.5°、51.9°、76.5°)。而且反应后的所有催化剂的XRD谱图中都出现了MgAl2O4尖晶石的特征衍射峰这说明在反应过程中催化剂的晶向由Mg(Ni,Al)O向MgAl2O4尖晶石转变。此外,反应后的0.5MgAl的催化剂图谱中出现在2θ=26.5°出现了石墨碳的衍射峰,表明其积炭较其他催化剂更为严重,这与O2-TPO表征结果一致。
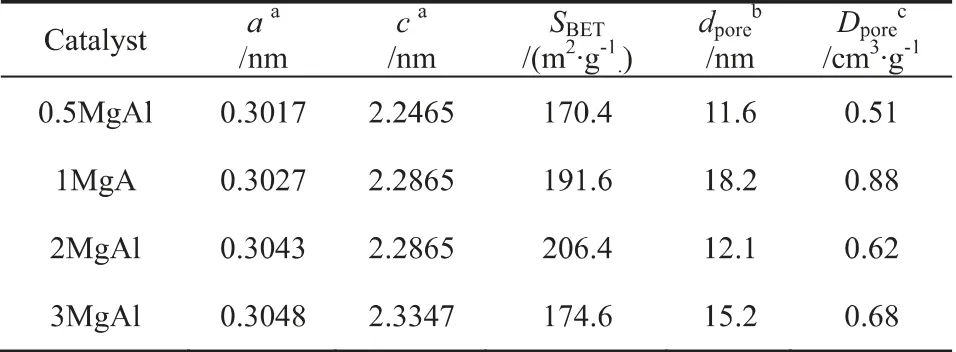
表2 焙烧后催化剂的N2吸附分析Table 2 N2-adsorption measurements of calcined catalysts
2.2.2 程序升温还原(H2-TPR)
图3是焙烧后催化剂的H2-TPR图,所有催化剂在600~900℃之间出现1个还原峰,结合焙烧后催化剂的XRD谱图(图2(b)),对于0.5MgAl催化剂,还原峰位归属于与NiAl2O4尖晶石的还原[10]。当nMg/nAl>1时该峰为该峰归属为Mg(Ni,Al)O固溶体中Ni2+的还原。高温还原峰的温度还原顺序为:3MgAl>2MgAl>1MgAl>0.5MgAl。因此,可以看出,焙烧后的催化剂,随着nMg/nAl的增加其还原峰逐渐向高温移动,相应的其还原程度(表3)逐渐降低。结合焙烧后催化剂的XRD结果,对于nMg/nAl为0.5的催化剂其Ni的主要存在形式为NiAl2O4。随着nMg/nAl增加至1时,焙烧后催化剂中出现了逐渐变为Mg(Ni,Al)O固溶体,这可能是由于较高的nMg/nAl使得Mg(Ni,Al)O固溶体的结晶程度逐渐变好,使得NiO与固溶体间的作用力逐渐变强,其还原峰向高温移动。
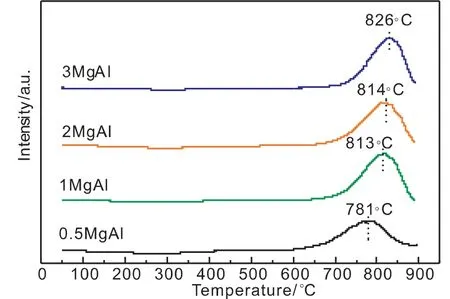
图3焙烧后催化剂H2-TPR图Fig.3 H 2-TPR profiles of calcined catalysts
2.2.3程序升温脱附(CO2-TPD)
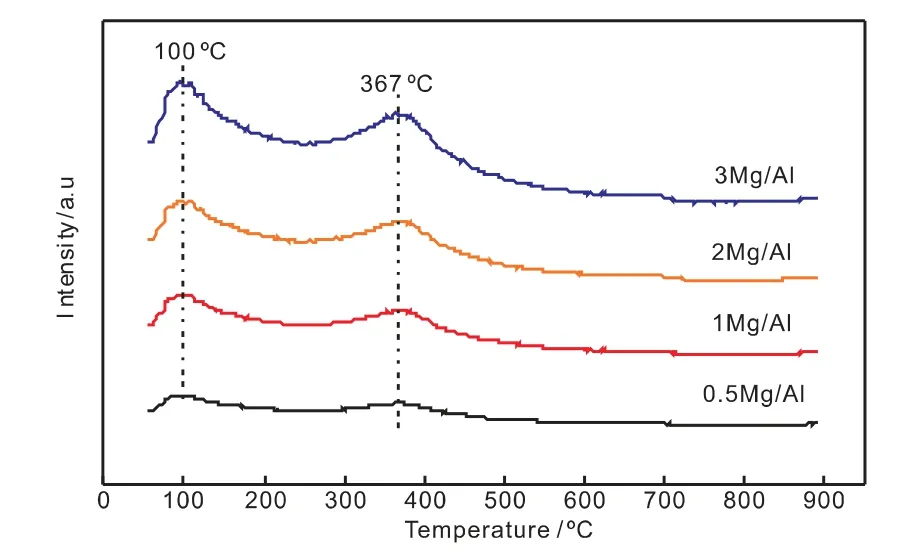
图4 还原后催化剂CO2-TPD谱图Fig.4 CO2-TPD spectra of reduced catalysts
图4是还原后催化剂的CO2-TPD-MS。从图中可以看出Mg/Al比对碱的类型没有显着影响,并且所有样品都显示出两个CO2脱附峰。第一个峰位于100℃左右,第二个峰位于400℃附近,分别归因于表面羟基OH(弱碱性位点)和O2-(中等强度碱性位点)[11]。催化剂的总的碱性位点数根据其峰面积来定量计算,相关结果总结在表3。从表中可以看出随着Mg/Al比的升高,中等强度碱性位点的数量逐渐增加。这说明高的Mg/Al比有利于CO2的吸附。
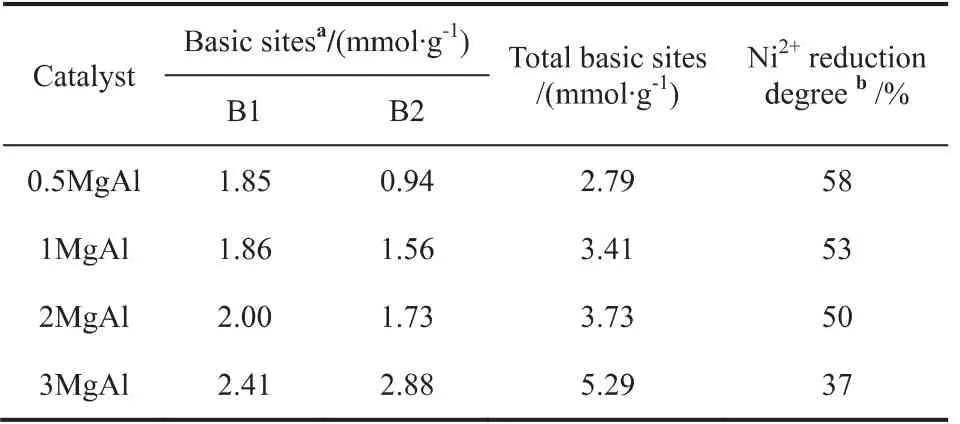
表3 还原后催化剂的碱性位点数和Ni的还原程度Table 3 Basic site distribution and density of reduced catalysts and Ni2+reduction degree
2.2.4程序升温氧化(O2-TPO-MS)
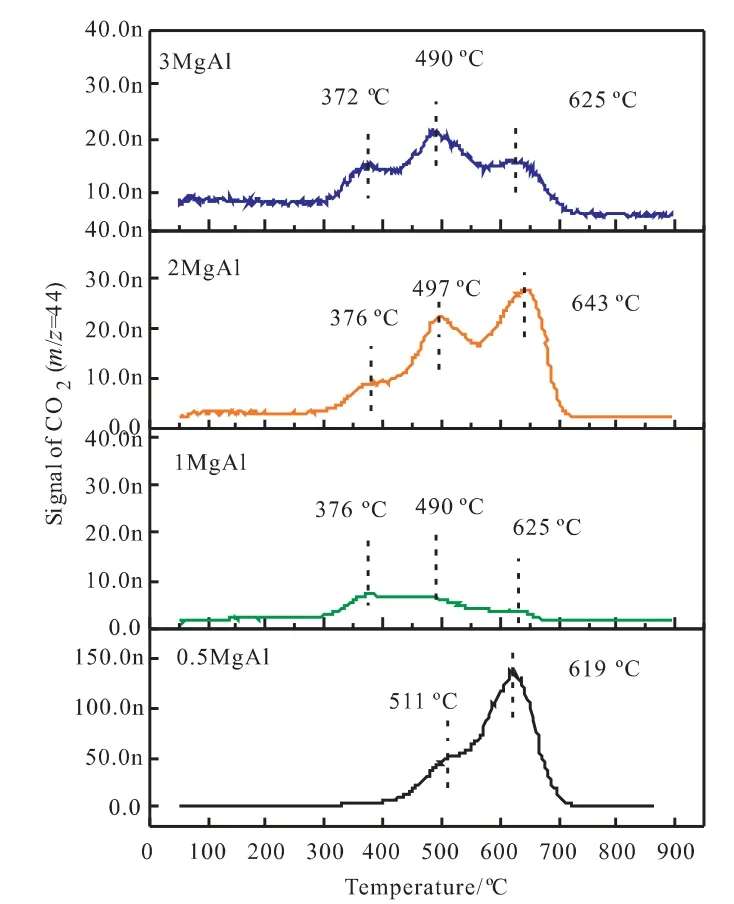
图5不同Mg/Al比催化剂反应后的O2-TPO-MSFig.5 O2-TPO-MS of used catalysts with different Mg/Al molar ratios
根据文献报道[12],积炭的种类有:原子碳(Cα,T<250℃);无定型碳(Cβ,250℃<T<600℃和石墨碳(Cγ,T>600℃)。其中Cα和Cβ属于活性碳物种很容易被氧化转化为合成气。然而,Cγ很难被氧化且是积炭的主要来源。图5是不同Mg/Al比催化剂在反应后的O2-TPO谱图。从图中可以看出所有催化剂都呈现出相似的氧化峰,然而其CO2信号峰的强度却不同。Cγ的峰信号强度为1MgAl<3MgAl<2MgAl<0.5MgAl,因此可以判断0.5MgAl催化剂积炭最为严重。根据CO2信号的峰面积对催化剂的积炭量进行了定量计算相关结果总结在表4中,从表中可以看出催化剂积炭量随着Mg/Al比的增加整体呈现出下降的趋势,且在0.5MgAl时达到最大值。
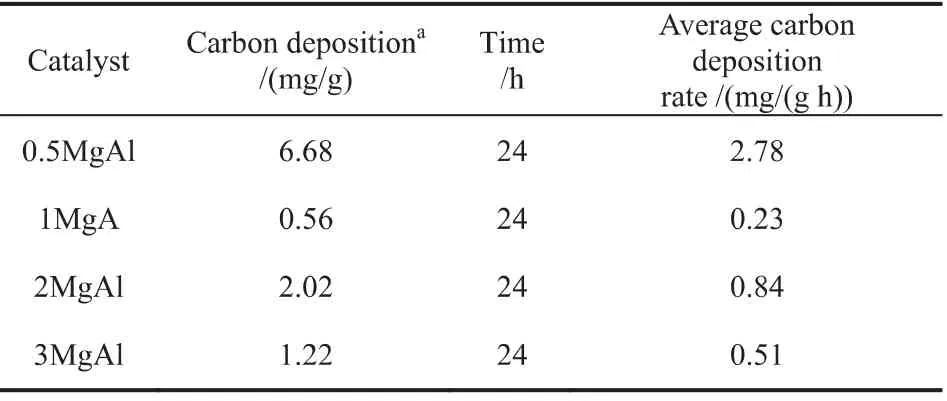
表4 反应后催化剂表面的积炭量以及平均积炭速率Table 4 Coke deposition amount of used catalysts and average coke deposition rates
在本文中,对来自水滑石的nMg/nAl为0.5至3的一系列Ni(Mg,Al)O混合氧化物催化剂进行了表征,并测试了其在CRM反应中的催化性能。2MgAl和3MgAl的前驱体为结晶较好的类水滑石,而在相对富Al的的0.5MgAl和1MgAl催化剂中出现Al(OH)3物象。焙烧后所有前驱体都转化为混合氧化物。焙烧后催化剂的XRD和H2-TPR结果表明在1MgAl,2MgAl和3MgAl催化剂中Ni主要以Ni(Mg,Al)O固溶体的形式存在,而在0.5MgAl中Ni主要以与NiAl2O4尖晶石的形式存在。高的还原温度表明Ni(Mg,Al)O中的Ni较难还原,然而对于富Al的0.5MgAl催化剂中NiAl2O4尖晶石中的Ni物种却较易被还原。而焙烧后催化剂的XRD结果表明对于2MgAl和3MgAl催化剂中其Mg存在的主要形式是Ni(Mg,Al)O固溶体,而0.5MgAl催化剂中Mg存在的主要形式为MgAl2O4尖晶石的形式存在,然而1MgAl催化剂中Mg存在的主要形式为MgAl2O4尖晶石和NiO-MgO固溶体。
将活性结果与催化剂的结构相关联可知,对于2MgAl和3MgAl催化剂,由于Mg存在的主要形式为Ni(Mg,Al)O固溶体,虽然这是因为MgO是碱性氧化物,有助于CO2活化,然而催化剂中较多的易于积炭的Al2O3相的存在使其积炭量仍然相对较高。对于1MgAl催化剂,Mg存在的主要形式为MgAl2O4尖晶石和NiO-MgO两者共存时,催化剂中MgAl2O4尖晶石的生成减少了易于积炭的生成的Al2O3物种,从而阻止了积炭的生成[13],而NiO-MgO固溶体的存在使得催化剂具有合适的金属与载体作用力和适当的CO2吸附能力,最终使得催化剂具有较好的催化活性和抗积炭能力。此外,对于富含Al的0.5MgAl催化剂,Mg存在的主要形式为MgAl2O4尖晶石的形式存在,MgAl2O4由于相对较低的CO2吸附能力,不利于积炭的消除,因此当表现出最低的活性和稳定性。
3 结论
通过共沉淀法制备一系列不同Mg/Al比的NiMgAl类水滑石前驱体,将焙烧后的催化剂用于甲烷二氧化碳重整反应中。活性评价结果表明高Mg/Al比的催化剂表现出较好的催化活性,且当nMg/nAl=1时催化剂的催化性能最佳。表征结果表明,随着Mg/Al比例的增加,催化剂中的晶向从MgAl2O4变为Ni(Mg,Al)O固溶体,这种物象的变化导致催化剂中金属与载体间作用力逐渐增强、催化剂碱性位点数逐渐增多、晶粒尺寸逐渐减小。O2-TPO-MS结果表明高Mg/Al的催化剂表现出高的抗积炭性能,nMg/nAl为1的催化剂表面生成的积炭量最少。MgAl2O4和MgO共存使催化剂具有合适的金属与载体作用力,小的晶粒尺寸,适当的CO2吸附能力,最终使得催化剂具有较好的催化活性和抗积炭能力。
