他莫昔芬对小鼠急性肝衰竭的预防作用的探讨*
2019-02-16罗满生刘丽平彭德林张荣山肖作淼
罗满生,刘丽平,彭德林,张荣山,肖作淼,戴 薇,林 燕△
(1.南昌大学附属赣州医院检验科,江西赣州 341000;2.南昌大学附属赣州医院院内感染控制科,江西赣州 341000;3.江西省吉安市吉州区白塘医院检验科 343009)
急性肝衰竭(acute liver failure,ALF)是由众多因素引发的一种严重临床综合征,病死率高,机制不详,因此,ALF机制及其治疗的研究一直是相关领域的热点。YOSHIKAWA等[1]发现在预防给药模式下他莫昔芬(tamoxofen,TAM)能通过上调肝脏单核巨噬细胞分化相关蛋白-2(monocyte to macrophage differentiation-associated 2,Mmd-2)预防对乙酰氨基酚诱导的ALF。而ZHANG等[2]研究发现,TAM除了对此模型有预防作用外还可有效预防D-氨基半乳糖(D-galactosamine,D-Gal)/脂多糖(lipopolysaccharide,LPS)诱导的小鼠ALF,尽管这两种肝损伤模型机制有所差异[3]。此外,ZHANG等[2]还发现TAM可通过抗炎、抗细胞凋亡作用有效拮抗D-Gal/LPS诱发的ALF。但有文献报道氧化应激产物活性氧(reactive oxygen species,ROS)在D-Gal/LPS诱发的ALF中发挥重要作用,即通过细胞凋亡促进肝损伤。本研究旨在探讨TAM对D-Gal/LPS诱导小鼠ALF的保护作用与肝脏抗氧化应激、Mmd-2表达的关系,深入分析该模型发病机制,为TAM 抗临床ALF研究奠定基础,现报道如下。
1 材料和方法
1.1药品、试剂与仪器 TAM(T5648)、D-Gal(G0500)、LPS(L2630)、向日葵油(S5007,Lot # MKCC1079)、N-乙酰半胱氨酸(NAC,A7250,Lot # WXBC0011V)购自美国Sigma公司;丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)、丙二醛(MDA)检测试剂盒购自南京建成生物工程有限公司;用于免疫组织化学和Western blot的兔源抗鼠Mmd-2单克隆抗体分别购自北京百奥莱博公司、美国Abcam公司,抗β-actin兔源抗鼠一抗及辣根过氧化物酶(HRP)标记山羊抗兔二抗均购自北京中杉金桥生物技术公司。高速低温离心机(艾本德,5804R),酶标仪(Thermo,MULTISCAN GO),凝胶成像仪(FUSION FX,法国),显微镜(奥林巴斯,IX71+DP72),低温冰箱(Thermo 700Series)。
1.2实验动物 20只昆明系小鼠,SPF级,雌雄各半,体质量(20±2)g,购自湖南斯莱克景达实验动物有限公司,许可证SYXK(赣)2012-0001。
1.3方法
1.3.1分组 20只小鼠分4组:正常组、ALF模型组(ALF组)、TAM+ALF组(TAM组)和ALF+NAC组(NAC组),每组5只。其中ALF组、NAC组腹腔注射向日葵油0.2 mL,TAM组注射TAM(2 mg/kg,溶于向日葵油)。所有组每天1次,连续3 d;最后1次注射后,禁食12 h,腹腔注射D-Gal(800 mg/kg)及LPS(1 μg)造模,其中NAC组随后腹腔注射NAC(300 mg/kg)。造模7 h后采集小鼠外周血,迅速分离血清置-20 ℃冻存;同时迅速采集肝脏,分装后-80 ℃冻存备用。
1.3.2指标检测及方法 小鼠ALT、AST及肝组织GSH、MDA检测采用紫外分光光度法,具体操作步骤参照试剂盒(南京建成生物工程有限公司)说明书,测定双复孔。
采用匀浆-RIPA-蛋白酶抑制剂法提取肝组织总蛋白,BCA法定量。蛋白经12% 十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,并转移至聚偏氟乙烯(PVDF)膜(孔径0.45 μm),5%脱脂奶粉封闭液室温封闭1 h、一抗4 ℃孵育过夜、洗涤、孵育二抗,ECL化学发光法自显影,利用FUSION FX凝胶成像仪扫描拍照,β-actin为内参。
另外,采集后的部分肝组织迅速置4%中性甲醛溶液中固定24 h,石蜡包埋、切片(5 μm)。免疫组织化学染色法原位分析Mmd-2表达。切片经间接免疫-过氧化物酶法处理后Meyer苏木素复染0.5~1.0 min。一抗稀释比例为1∶100,二抗为1∶500。与本实验不相关专业人员阅片,每组不少于4只,每张切片观察高倍视野数目不少于5个,计算各组阳性率(%)。

2 结 果
2.1TAM对血清ALT、AST的影响 ALT、AST水平方面,ALF组ALT、AST(222.30、288.90 U/L)水平较TAM组(81.30、77.08 U/L)和NAC组(89.80、87.50 U/L)明显升高,差异有统计学意义(P<0.05);TAM组、NAC组组间比较,差异无统计学意义(P>0.05),见图1。
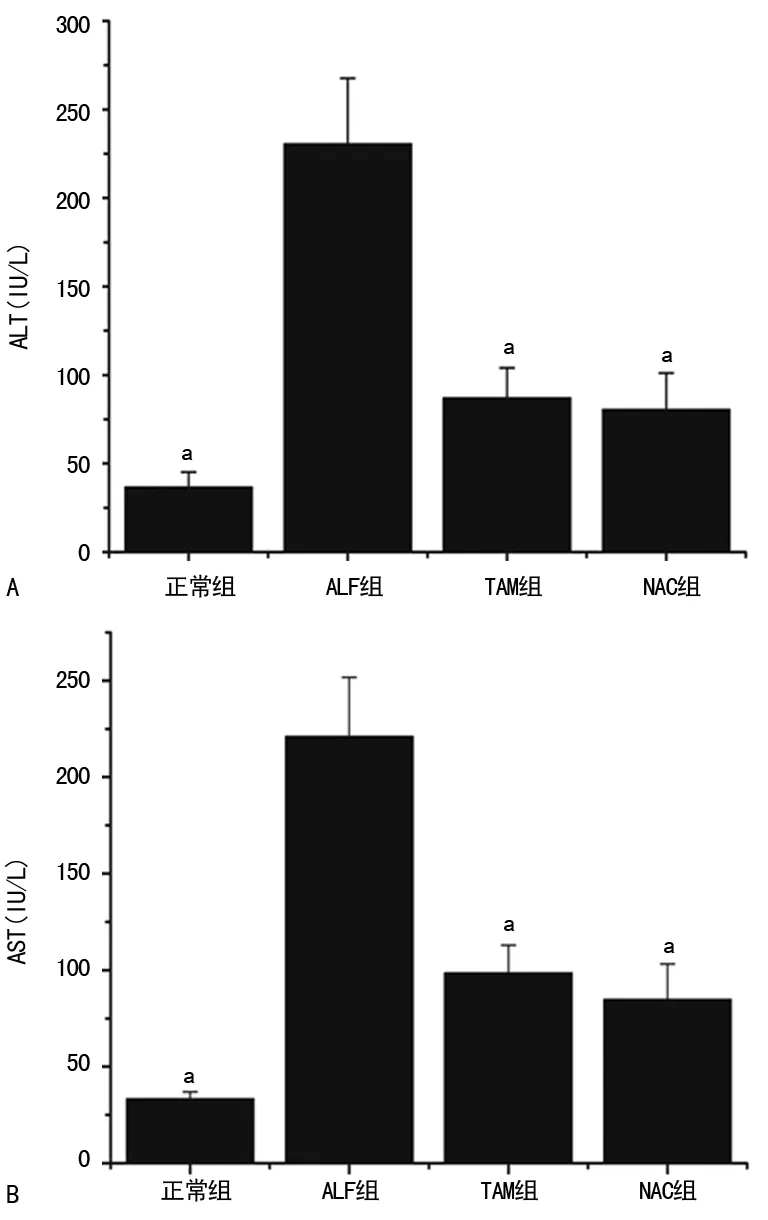
A:ALT;B:AST;a:P<0.05,与ALF组比较
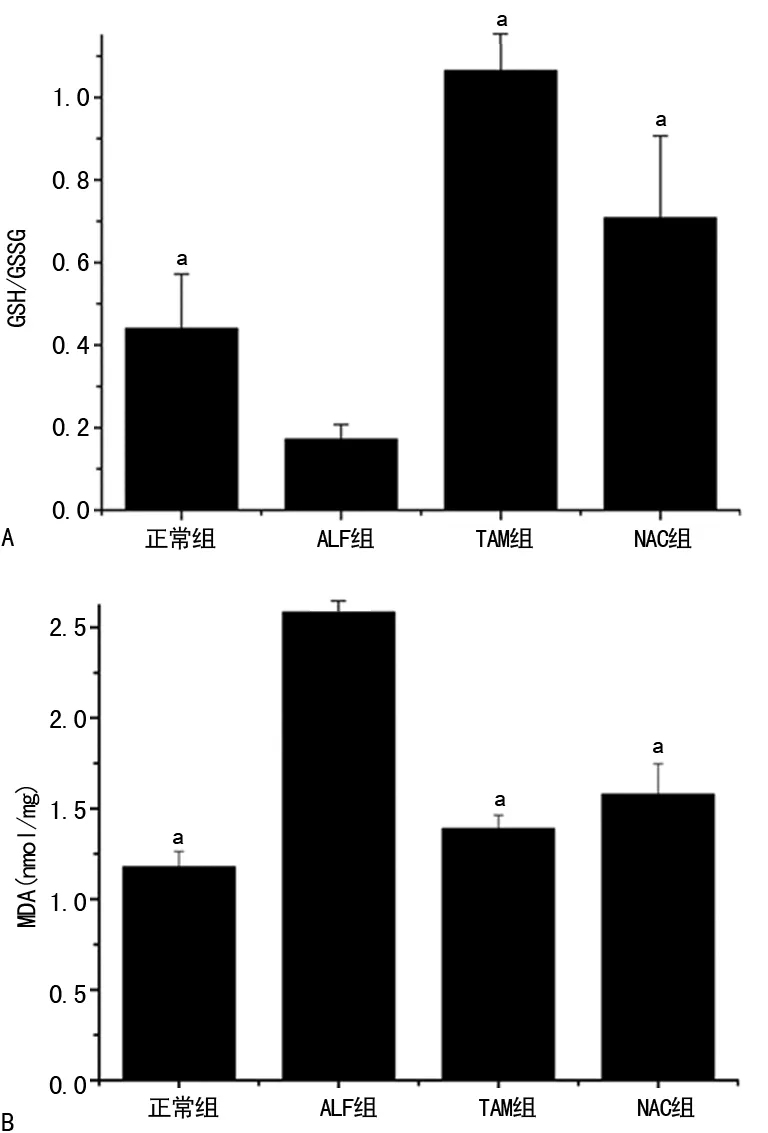
A:GSH/GSSG;B:MDA;a:P<0.05,与ALF组比较
2.2TAM对肝脏GSH/GSSG及MDA水平的影响 TAM组GSH/GSSG(1.067)水平显著高于ALF组(0.173),差异有统计学意义(t=5.337,P<0.05);其他各组之间比较差异无统计学意义(P>0.05)。在MDA水平方面,ALF组(2.584 nmol/mL)较TAM组(1.390 nmol/mL)和NAC组(1.579 nmol/mL)显著升高,差异有统计学意义(t1=6.930,t2=5.830,P<0.05),见图2。
2.3TAM处理对肝脏Mmd-2水平的影响 与正常组比较,ALF组Mmd-2水平下降;与ALT组比较,TAM组Mmd-2水平明显增强,见图3。免疫组织化学结果显示与ALF组比较,TAM组肝脏Mmd-2阳性率显著增强,差异有统计学意义(t=21.32,P<0.05),见图4。

图3 药物处理对肝脏Mmd-2表达情况
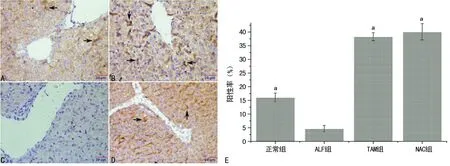
A:正常组;B:ALF组;C:TAM组;D:NAC组;E:各组Mmd-2表达水平;a:P<0.05,与ALF组比较;箭头:TUNEL染色阳性细胞
3 讨 论
ALF是一种临床常见的肝损伤综合征,除保守支持治疗和肝移植外尚无其他有效治疗措施。因此,探索有效防治ALF的药物或策略仍然是ALF研究领域的热点。
由于临床症状和大致病理表现等方面与细菌(尤其革兰阴性菌)感染后引起的ALF相似,近30年来D-Gal/LPS诱导的ALF模型广泛用于ALF机制和相关药物开发研究[4-5]。现已明确,该ALF模型主要是在D-Gal(核酸生物合成抑制剂)作用下肝细胞mRNA合成受阻前提下肝脏巨噬细胞受细菌LPS刺激后分泌大量促炎症因子,如肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、趋化因子等[6]。TNF-α既可通过活化核因子-κB(nuclear factor,NF-κB)促进肝细胞增殖、生存,也可在肝细胞生物合成抑制时引发细胞凋亡,导致ALF[7]。研究表明,TNF-α诱导的肝细胞凋亡在一定程度上依赖氧化应激产物ROS,因为后者是肝细胞凋亡过程中c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)持续活化的重要因素[8]。因此,抗氧化应激已逐渐成为一些抗肝损伤研究的重要策略。
TAM是一种选择性雌激素受体调节剂,其活性发挥具有组织选择性特点,可结合肝细胞雌激素受体α并发挥雌激素样作用[9],而雌激素也是一种典型抗氧化药物。以此推论,TAM也可能具有抗氧化应激功能。YOSHIKAWA等[1]发现在提前给药模式下TAM能有效预防对乙酰氨基酚过量使用所导致的小鼠ALF,而是否与TAM抗氧化应激作用相关尚不知晓。在本研究中,TAM组经连续3次TAM提前给药,小鼠ALF症状及血清转氨酶水平都显著低于ALF组。组织病理学结果也表明,ALF组肝损伤严重(如肝细胞界限不清、肝小叶结构破坏、单个核细胞浸润等),而TAM组及NAC组表现均明显优于ALF组。另外,ALF组肝脏氧化应激加剧,如GSH/GSSG下降而MDA水平升高,与其他文献报道一致[10]。结果不但阐明氧化应激在该ALF模型发生、发展过程中的重要性,而且提示TAM可能通过抗氧化应激预防、拮抗ALF。
此外,结果还提示TAM对该模型的保护作用似乎与肝脏Mmd-2表达上调相关,这一结果也与YOSHIKAWA等[1]报道相似。因此,笔者设想Mmd-2表达下调可能普遍存在于各类ALF,而TAM对该类肝损伤的拮抗性可能与Mmd-2表达上调有关。JIN等[11]研究表明,Mmd-2可促进肝细胞增殖和生存,其机制涉及Ras信号增强及细胞外调节蛋白激酶活性上调。
值得注意的是本研究中NAC组部分指标虽然明显好于ALF组,但却不及TAM组。究其原因考虑可能有:NAC使用剂量不够或NAC给药途径对实验结果有影响。
综上所述,本研究提示TAM可有效减轻D-Gal/LPS诱导的ALF,其机制可能与TAM抗氧化应激及其对Mmd-2的上调作用相关。
