虫草提取物CS-4对他克莫司所致大鼠胰腺和肾脏损伤的保护
2019-02-15张隆业金健金吉哲郑海兰朴尚国姜玉姬李慧瑛金英顺李灿
张隆业 金健 金吉哲 郑海兰 朴尚国 姜玉姬 李慧瑛 金英顺 李灿
(延边大学附属医院肾病学科,吉林 延吉 133000)
作为一种强有力的免疫抑制剂,他克莫司(TAC)已广泛应用于脏器移植、自身免疫性疾病、结缔组织病、难治性肾病综合征的治疗。然而,TAC的使用常被其毒副作用所限,譬如肾毒性和移植术后新发糖尿病(NODAT)〔1,2〕。TAC急性肾毒性被认为是可逆的,而TAC慢性肾毒性可导致不可逆的、进行性的肾衰竭且需透析治疗〔3〕。TAC慢性肾毒性以炎性细胞浸润、肾小管间质纤维化(TIF)为病理特点,其发病机制尚不完全清楚,炎性介质、转化生长因子(TGF)-β1、氧化应激、细胞凋亡与其中扮演重要角色〔4,5〕。NODAT是脏器移植后常见的严重并发症,发病率高达60.2%〔6〕。在诸多发病病因中,TAC所致 NODAT高达36.6%〔7〕。本课题组曾报道TAC可直接损伤胰腺β细胞,而氧化应激起关键作用〔5〕。
冬虫夏草(CS)是一种传统中草药,富含氨基酸、微量元素、核苷酸、多肽等生物活性物质,故具有降糖、免疫调节、抗炎、抗氧化、抗肿瘤等特性〔8~12〕,在环孢素A肾小管损伤〔13〕、2型糖尿病(DM)〔14〕、膜性肾小球肾炎〔15〕、单侧输尿管结扎模型〔16〕中均得到证实。本实验利用TAC诱导的大鼠糖尿病肾病(DN)动物模型,探讨CS是否对胰腺和肾脏具有保护作用。
1 材料和方法
1.1动物分组与药物治疗 体重匹配(体重240~260 g)的雄性Sprague-Dawley(SD)大鼠(Charles River,Technology,韩国),喂饲低盐饲料(0.05% sodium,Teklad Premier,Madison,WI,美国)1 w后,随机分为4组:①正常对照组(VH,n=8):正常大鼠皮下注射橄榄油(1 ml·kg-1·d-1);②VH+CS组(n=8):正常大鼠皮下注射橄榄油,灌胃 CS(5 g·kg-1·d-1,CS原粉(西安济民金水宝制药有限公司提供CS原粉,Cs-4)溶于饮用水中至5 g/ml浓度,CS剂量选择基于以往报道〔17〕);③TAC组(n=8):正常大鼠皮下注射TAC(1.5 mg·kg-1·d-1,Prograf,AstellasPharma,Ibaraki,日本)在橄榄油(Sigma,St Louis,MO,美国)中稀释至1.5 mg-1·ml浓度);④TAC+CS组(TAC+CS,n=8):正常大鼠皮下注射TAC,灌胃CS。治疗4 w后分别处死大鼠,收集血液、尿液、肾组织标本以备进一步检测。该动物实验获得韩国加图立大学动物伦理委员会批准(CUMC-2016-0101-03)。
1.2基本检测 定期测量并记录各组大鼠的体重,定量酶比色法(Stanbio Laboratory,Boerne,TX,美国)测定肾功能〔血肌酐(Scr)、尿素氮(BUN)〕及24 h尿蛋白排泄率(Modular DPP system,Roche,Hamburg,德国),液相色谱-质谱联用法(LC-MS/MS)检测全血TAC 浓度;尾动脉测压法测定大鼠收缩期血压(BP-2000,Visitech system,Apex,NC,美国)。
1.3胰腺功能评估 在实验末期测定糖耐量试验(IPGTT)并计算葡萄糖曲线下面积(AUCg);酶联免疫吸附法(ELISA)测定血浆胰岛素水平(Millipore corpotation,St.Charles,Mo);常规免疫组化法检测胰岛素免疫活性,采用彩色图像自动分析仪(Polygon program,TDI Scope Eye Version3.5 for Windows;Olympus,日本)高倍镜下半定量分析。
体外测定葡萄糖刺激下的胰岛素水平:糖促胰岛素分泌(GSIS),方法简述如下:首先将分离的胰岛用Krebs-ringer 缓冲液(KRB:NaCl 130 mmol/L;KCl 3.6 mmol/L;CaCl21.5 mmol/L;MgSO40.5 mmol/L;KH2PO40.5 mmol/L;NaHCO32.0 mmol/L;HEPES 10 mmol/L)冲洗后,再用含有25 mmol/L葡萄糖的KRB液处理30 min,并收集上层液。最后用酶联免疫吸附实验(ELISA)试剂盒(Millipore Corp.,St.Charles,MO,美国)测量上清液胰岛素浓度。工作流程见图1。
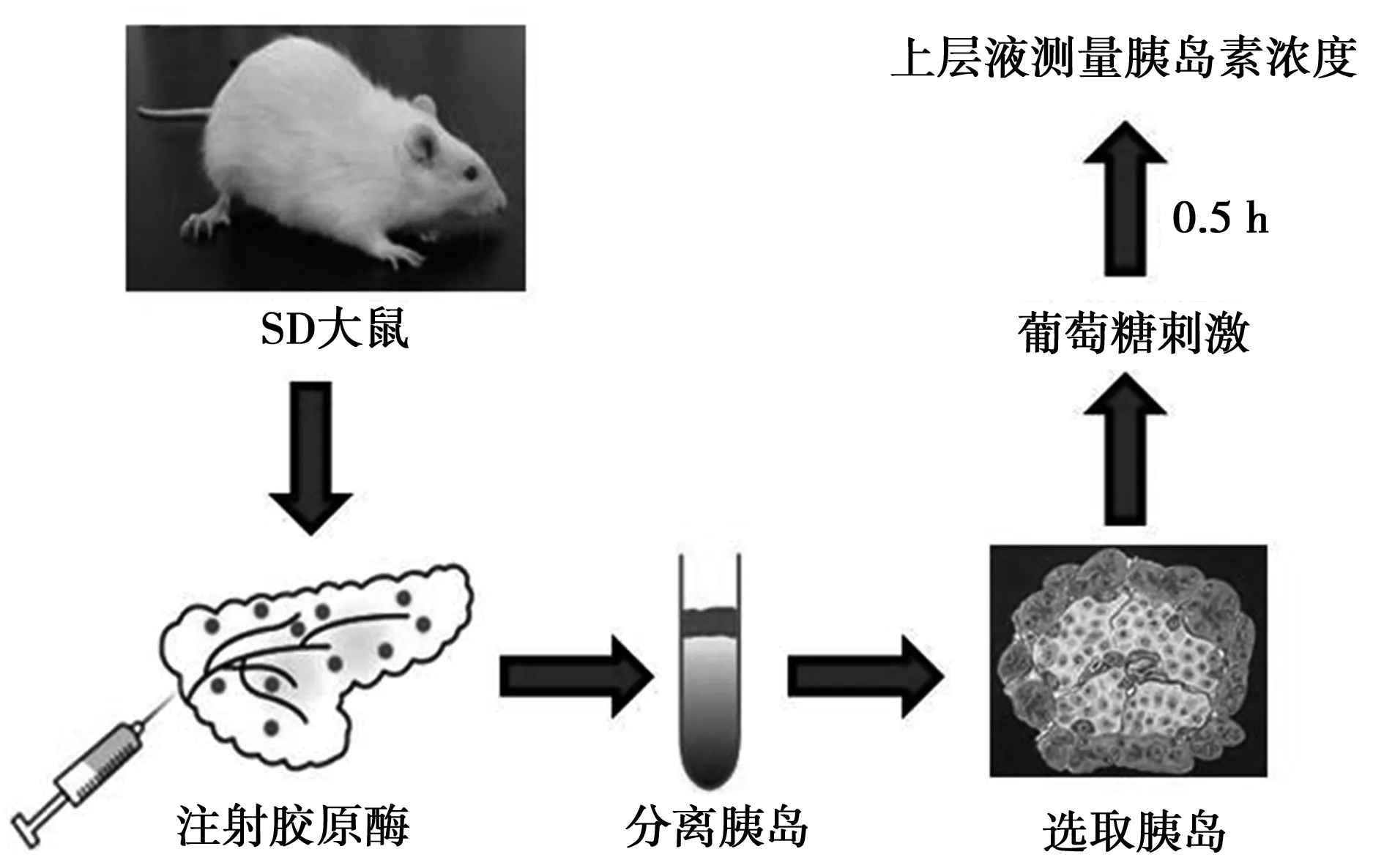
图1 体外动物实验检测胰岛素水平的工作流程图
1.4肾脏病理组织检查 肾组织由过碘酸-赖氨酸-多聚甲醛液(PLP)固定,石蜡包埋后切片,行Masson trichrome三色染色,自动图像分析仪高倍镜下分析TIF程度,每个标本至少观察20个非重叠区域并取平均数。
1.5免疫组化染色 石蜡包埋切片置二甲苯脱蜡,梯度酒精中脱水,37℃、0.3% 过氧化氢/甲醛处理30 min后,磷酸盐缓冲液(PBS)洗3次。置微波炉中加热行微波抗原修复(98℃ 5 min),室温下非免疫性血清封闭液20 min。在4℃下滴加 ED-1 单克隆抗体(Serotec Inc.,英国)孵育12~16 h。PBS洗3次后滴加二抗,室温孵育2 h。以二氨基联苯胺(DAB)为底物显色,呈棕黄色为止。自来水流水洗涤,复染苏木素,常规树脂封片。染色程度用数字化显微镜分析仪(TDI Scope Eye Version 3.0 for Windows,Olympus,日本),Polygon程序算出每0.5 mm2染色面积的百分比。
1.6双重免疫荧光染色 胰岛素和 caspase-3 双重染色步骤如下:一抗孵育洗涤后加入生物素化―抗兔 IgG 孵育,洗涤并滴加 SABC-Cy3 复合物,荧光显微镜下观察特异性荧光,再进行异硫氰酸荧光素(FITC)―抗小鼠 IgG(二抗)孵育,最后封片观察。
1.7血、尿 8-羟脱氧鸟苷(8-OHdG)水平 根据试剂盒操作步骤,用酶联竞争免疫吸附法测定血、尿 8-OHdG DNA 加合物水平(Cell BIOLABS,San Diego,CA,美国)。
1.8免疫印迹法 肾组织用蛋白质裂解液制成匀浆,室温下离心后取上清液测蛋白浓度(Bio-Rad,Hercules),钠-聚丙烯酰胺凝胶电泳;电转膜2 h后,4℃下置〔单核细胞趋化蛋白(MCP)-1,Santa Cruz Biotechnoogy,Inc.,美国〕于非脂牛乳中以1∶1 000浓度孵育12~16 h,室温下PBS洗3次,加辣根过氧化物酶标记的驴抗兔 IgG(Amersham)1 h;室温下PBS洗3次,增强发光(ECL,Amersham)和曝光。以对照组为标准(100%)测定条带的光密度,以 β-actin校正。类似方法测定白细胞介素(IL)-17,Cell signaling Technology,Danvers,MA,美国);转化生长因子-β1(TGF-β1,R&D Systems,Minneapolis,MN,美国);TGF-β 1诱导基因-h3(βig-h3,Proteintech,Chicago,IL,美国);锰超氧化物歧化酶(MnSOD,Abcam);B细胞淋巴瘤-2(Bcl-2,Millipore,Billerica,Mass),活性的含胱氨酸的天冬酸蛋白水解酶-3(Caspase-3,Millipore,Billerica,Mass),Bcl-2相关X蛋白(Bax,Millipore,Billerica,Mass)。
1.9原位缺口末端标记(TUNEL)法 根据 ApopTag in Situ Apoptosis Detection Kit(Millipore)试剂盒操作步骤测定细胞凋亡,200高倍下数字化显微镜分析仪计数TUNEL阳性细胞。

2 结 果
2.1CS 对生化参数的影响 TAC 组大鼠表现为体重下降、肾功能低下(Scr和BUN升高)、24 h尿蛋白排泄率增加,而尿量(UV)和饮水量(WI)却升高。CS 治疗阻滞体重下降、肾功能低下、尿蛋白排泄率增加,然而对UV和WI无明显改善。见表1。
2.2CS 对胰腺功能的影响 给予大鼠 TAC 可诱导 DM,表现为 IPGTT和AUCg较VH组上升(P<0.05);反之,血浆胰岛素和GSIS水平却下降(P<0.05)。CS均使上述指标逆转。胰岛免疫组化(图2)显示,与VH组比较,TAC 抑制胰岛的胰岛素免疫活性〔(6.9±1.4)vs(14.6±0.8)μm2×103,P<0.05〕, CS 治疗显著增加胰岛素的免疫活性〔(12.3±1.1)μm2×103,P<0.05 vs TAC组〕。见表2。

表1 冬虫夏草对生化指标的影响
△BW:体重增加量;UV:尿蛋白;SBP:收缩压;与VH组比较:1)P<0.05;与TAC组比较:2)P<0.05,下表同

表2 各组间血糖和胰岛素水平
2.3CS对肾小管间质炎症反应的影响 肾小管间质炎症反应在TAC慢性肾毒性中起关键作用,因为炎症先于纤维化。TAC治疗4 w导致肾小管间质炎症,表现为炎性介质MCP-1和IL-17的表达增加(P<0.05),继之ED-1阳性细胞在肾小管间质大量浸润〔(23.1±2.5)% vs(0.5 ± 0.06)%,P<0.05,图3A〕。CS治疗不仅下调MCP-1和IL-17的表达(P<0.05,图3B);而且明显减少ED-1阳性细胞数〔(14.8 ± 1.8)%,P<0.05 vs TAC组〕。以上结果表明,CS对TAC慢性肾毒性具有抗炎作用。见表3。
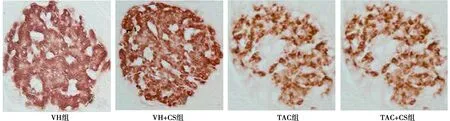
图2 胰腺免疫组化和半定量分析(×400)

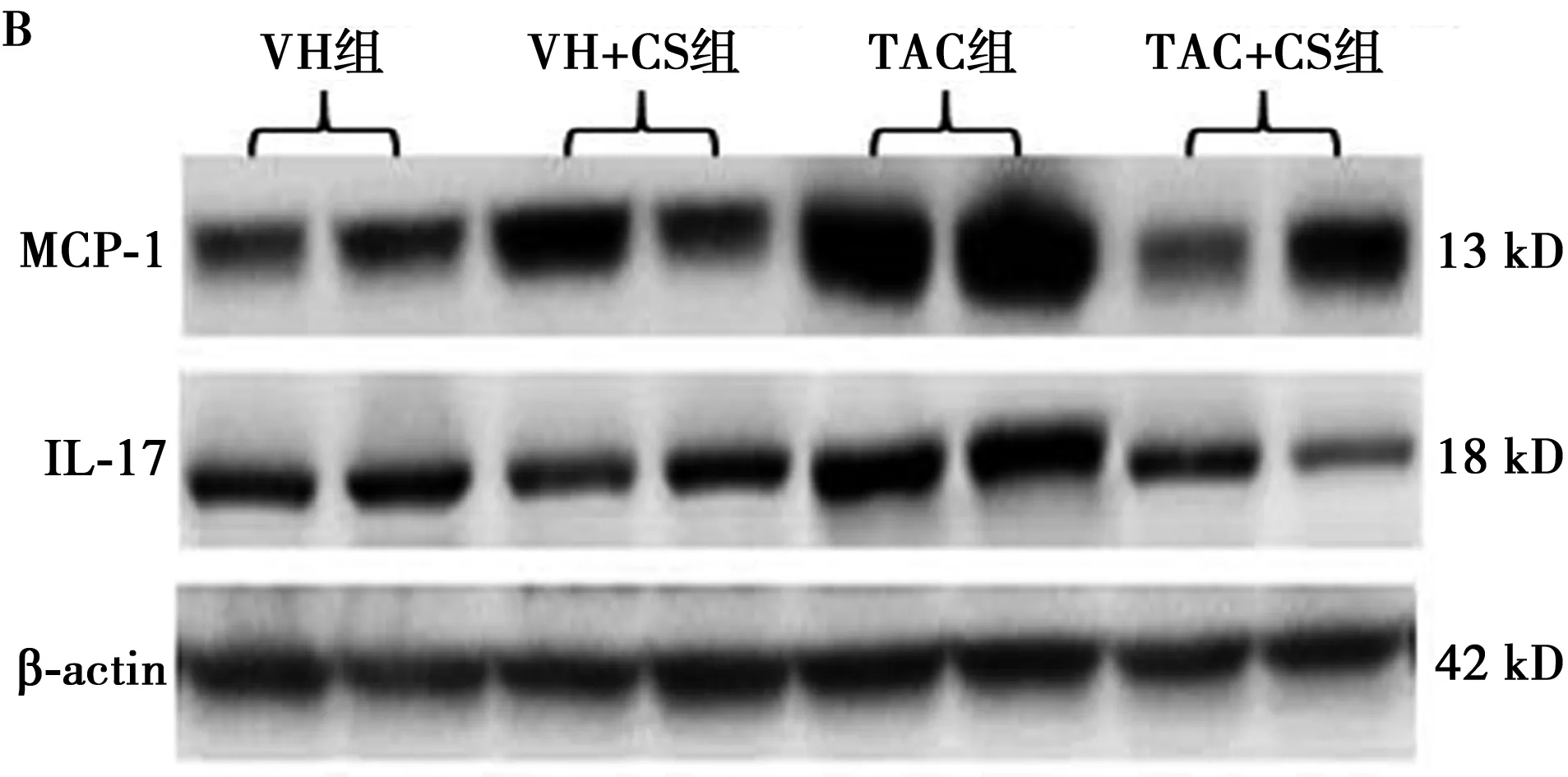
图3 ED-1免疫组化(A,×400)和MCP-1、 IL-17免疫印迹(B)
2.4CS 对肾小管间质纤维化的影响 带状TIF 是TAC慢性肾毒性特征性的病理改变,这种变化在TAC组肾组织中显得尤为突出(P<0.05)。病理上的变化伴随着明显的TGF-β1及其诱导基因 βig-h3较VH组高表达(P<0.05;图4A)。CS治疗显著下调TGF-β1和βig-h3的表达(P<0.05;图4B,表4),改善了TIF程度(P<0.05)。见表3。


图4 Masson's trichrome染色(A,×400)和 TGF-β1、βig-h3免疫印迹(B)
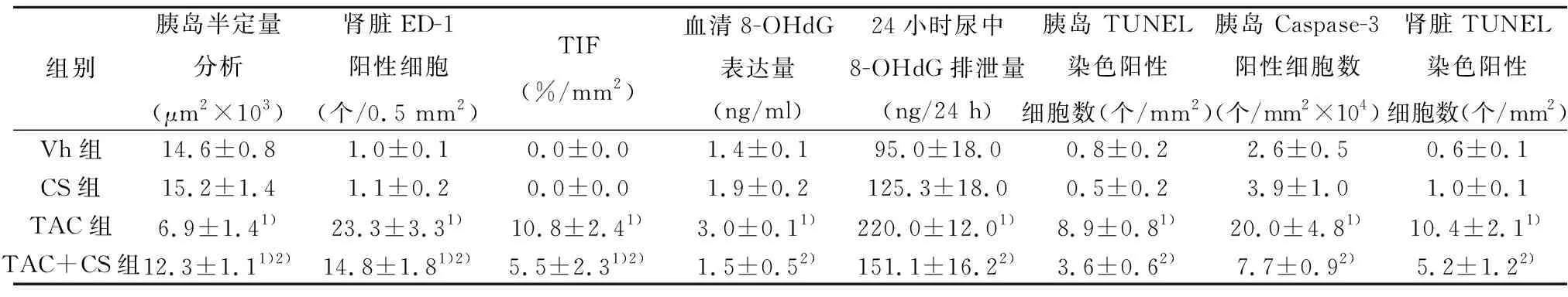
组别胰岛半定量分析(μm2×103)肾脏ED-1阳性细胞(个/0.5 mm2)TIF(%/mm2)血清8-OHdG表达量 (ng/ml)24小时尿中8-OHdG排泄量(ng/24 h)胰岛 TUNEL 染色阳性细胞数(个/mm2)胰岛 Caspase-3阳性细胞数(个/mm2×104)肾脏TUNEL染色阳性细胞数(个/mm2)Vh组14.6±0.81.0±0.10.0±0.01.4±0.195.0±18.00.8±0.22.6±0.50.6±0.1CS组15.2±1.41.1±0.20.0±0.01.9±0.2125.3±18.00.5±0.23.9±1.01.0±0.1TAC组6.9±1.41)23.3±3.31)10.8±2.41)3.0±0.11)220.0±12.01)8.9±0.81)20.0±4.81)10.4±2.11)TAC+CS组12.3±1.11)2)14.8±1.81)2)5.5±2.31)2)1.5±0.52)151.1±16.22)3.6±0.62)7.7±0.92)5.2±1.22)
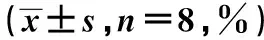
表4 各种免疫印迹检测表达量
2.5CS 对氧化应激的影响 与VH组相比,TAC组血、尿 8-OHdG水平明显增加(P<0.05);相反,抗氧化因子MnSOD蛋白的表达却减少(P<0.05),CS治疗均使上述各项指标逆转。见表3,表4,图5。
2.6CS 对细胞凋亡的影响 TAC增加胰腺和肾组织内的TUNEL阳性细胞数(P<0.05),而CS治疗减少其在胰腺和肾的数量(表3)。在分子水平上,双重免疫荧光染色示胰岛素和Caspase-3仅在TAC组胰岛中融合显影,提示胰岛细胞凋亡与胰岛素减少紧密相关(表3)。在肾组织中,CS调节Bcl-2/Bax比值和下调caspase-3蛋白的表达(P<0.05),以利于细胞存活(表4)。见图6,图7。

图5 血、尿 8-OHdG 水平和MnSOD免疫印迹
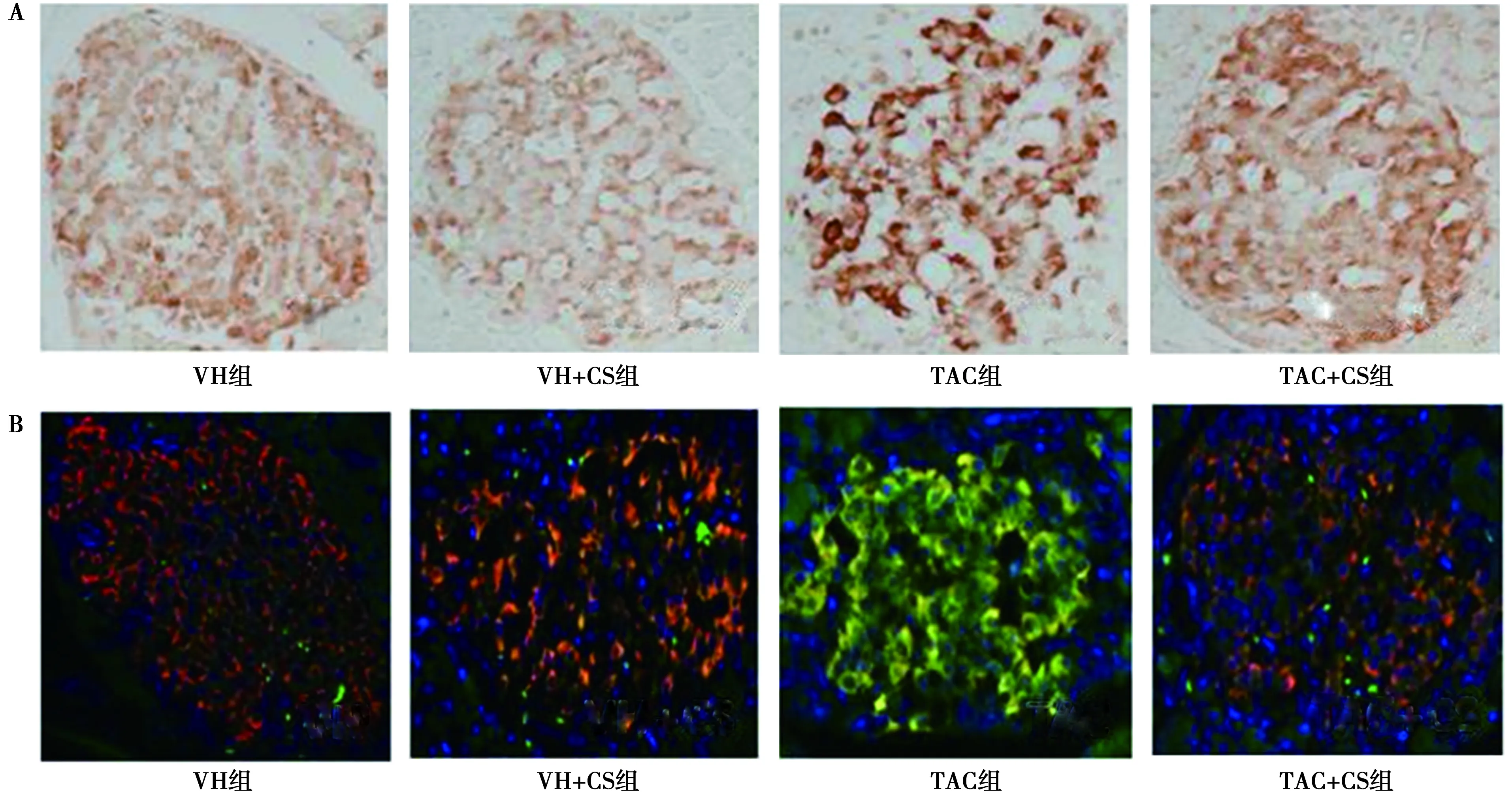
图6 胰腺 TUNEL 染色(A,×400)和胰岛素及caspase-3 双重免疫荧光染色(B,×400)

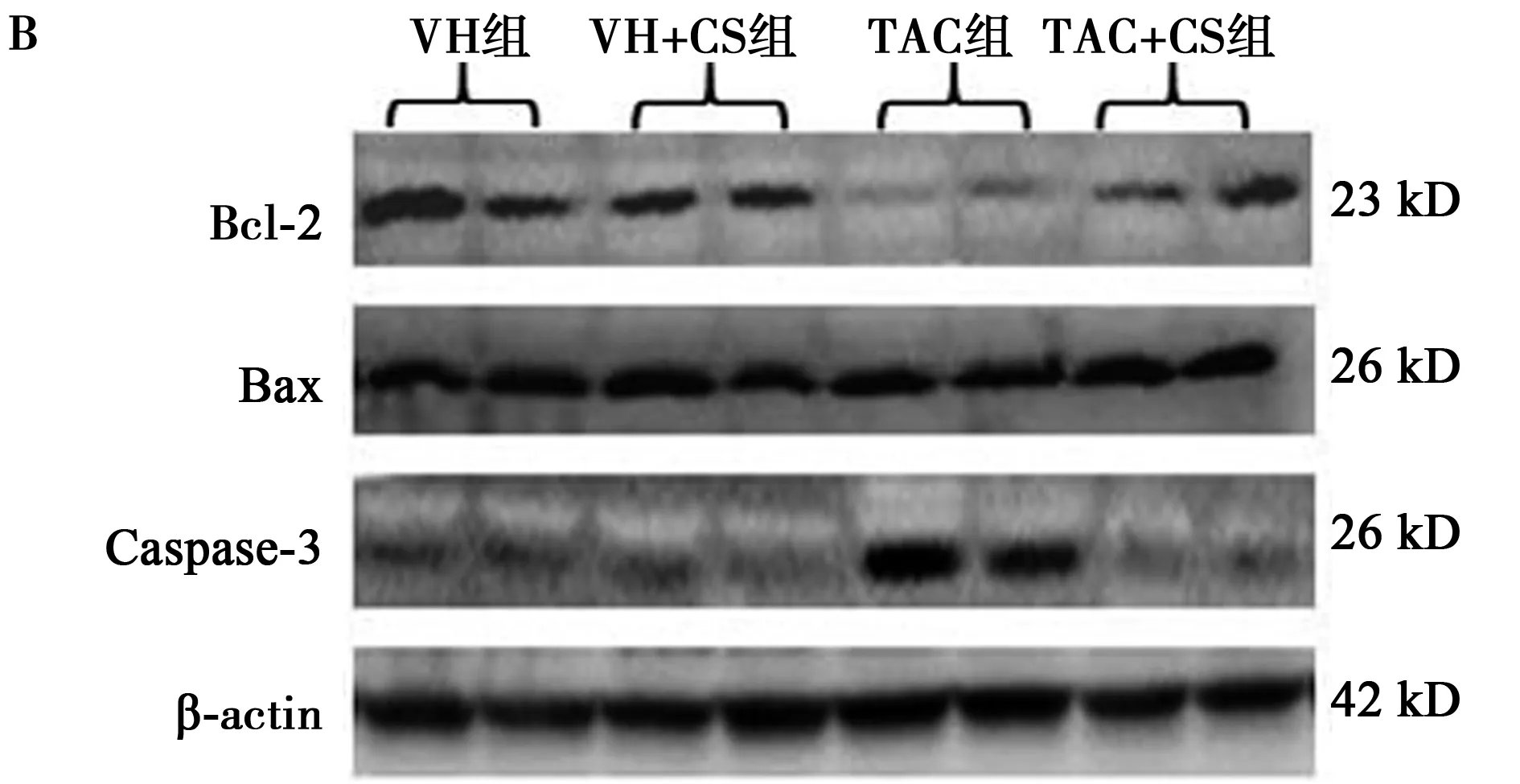
图7 肾脏 TUNEL 染色(A,×400)和 细胞凋亡相关基因免疫印迹(B)
3 讨 论
在链脲佐菌素诱发的DM大鼠模型和高脂饲料诱导的2型DM模型(C57BL/6J 小鼠)中,CS可发挥强有力的降糖作用,其降糖作用机制可能与刺激胰岛素分泌和激活胆碱酯酶有关〔18,19〕,说明在 DM 疾病中,CS 具有降糖作用。本实验结果与上述报道吻合,CS 明显增加胰岛素的分泌和GSIS上升,从而降低 TAC 所致高血糖(包括IPGGT 和 AUCg)。此外,CS 明显减少胰岛细胞凋亡、保持胰岛大小的完整性。因此,不难推断 CS 是通过抑制胰岛细胞凋亡机制发挥降糖作用,对 TAC 所致胰腺损伤具有保护作用。
CS 对膜性肾小球肾炎和2型 DN 具有抑制炎性介质(如MCP-1 和 ICAM-1)的表达,减少巨噬细胞浸润,下调 TGF-β1 表达,防止细胞外基质沉积(Ⅳ型胶原蛋白)等效能〔15,20〕。上述证据表明在肾脏疾病中,CS 具有抗炎、抗纤维化作用。本研究利用 TAC 诱导大鼠 DN 模型,阐明 CS 对其保护的分子作用机制。本文结果表明 CS 明显下调炎性介质 MCP-1、IL-17 的表达,随之减少炎性细胞在肾小管间质的浸润(ED-1 阳性细胞数)。此外,CS 下调致纤因子 TGF-β1 和细胞外基质成分之一βig-h3 的表达。这种分子水平上的变化伴随着24 h尿蛋白排泄率减少、肾功能改善、肾小管间质带状纤维化的减少。此结果与以往报道〔21〕中CS发挥的肾脏保护作用极为相似,表明 CS 在 TAC 诱导的大鼠 DN 模型中,通过抑制 MCP-1、IL-17、TGF-β1 的表达,从而减少肾小管间质炎症反应和纤维化,发挥肾脏保护作用。
本研究结果阐明CS对TAC所致的胰腺和肾脏损伤具有保护作用,但其作用机制可以是多方面的,至少两种可能性参与其中。首先是氧化应激损伤,因为长期使用TAC对胰腺 β 细胞和肾近曲肾小管上皮细胞株(NRK 52E)具有增强氧化应激损伤、减少抗氧化物质的作用〔5,21〕,而CS 通过调控活性氧、超氧化物歧化酶、谷胱甘肽过氧化物酶、丙二醛等水平,改善肾功能〔22〕。其次是细胞凋亡,因为TAC可直接导致胰腺β细胞和肾小管细胞凋亡,而CS 通过抑制细胞凋亡途径缓解高脂饮食或脂多糖所致的胰腺和肾脏损伤〔23〕。在本实验中,CS不仅减少血、尿8-OHdG水平、增加MnSOD的表达,而且调节细胞凋亡调控基因,从而减少胰腺和肾实质细胞凋亡。因此,CS改善TAC相关的DM和肾损伤与其抗氧化应激、抗细胞凋亡能力紧密相关。
在临床实际中,使用非肾毒性的药物有效控制 NODAT 具有深远意义,因为 NODAT 可直接损伤肾移植患者的移植物。除了像胰岛素、二甲双胍这样的一线 DM 药物外,近年来不断涌现出新研发的药物如二肽基肽酶-4和钠-葡萄糖共转运体-2抑制剂。然而,这些新药亦带来不可避免的副作用,譬如低血糖、泌尿系和生殖器感染、胃肠道功能紊乱〔24,25〕。因此,无副作用的传统中草药越来越受到人们青睐。大量证据证实,CS可改善肾移植患者的慢性移植肾病、肝毒性、哮喘症状、心血管疾病等〔26~28〕。以上效能结合本实验结果,我们可以大胆假设,对脏器移植患者早期服用 CS 可获得意想不到的益处。综上所述,在 TAC 诱导的 DN 大鼠模型中,CS可降低血糖,减少蛋白尿,改善肾功能,具有良好的胰腺和肾脏保护作用。这将为临床上使用 CS 防治 DN 提供有力的分子理论基础。
