肠系膜异位胰腺的临床特点和处理
2019-02-14赵健王政郝法涛谢于
赵健,王政,郝法涛,谢于
(1.解放军五三三医院 普外科,云南 昆明 650000;2.火箭军总医院 肝胆外科,北京 100076)
异位胰腺(heterotopic pancreas)又称迷走胰腺、副胰腺、brunner腺瘤、胰上皮错构瘤,是存在于胰腺正常解剖位置以外的,与主体胰腺没有解剖、血管以及导管上的联系,且拥有独立的血供和神经支配的胰腺组织[1]。异位胰腺好发于胃肠道,其临床表现缺乏特异性,诊断与鉴别诊断较为困难,且有明显的部位差异性。发生于肠系膜的异位胰腺更为罕见,难以与间质瘤、淋巴瘤和其他占位性病变相鉴别,且文献报道的治疗方式存在争议。本文回顾性分析了2008年3月至2018年5月间火箭军总医院肝胆外科收治的7例经病理证实为肠系膜异位胰腺的病例临床资料,现报道如下。
1 资料和方法
1.1 一般资料
本组病例共7例,男5例,女2例,年龄30~68岁,中位年龄42岁。病程1~12个月,平均(3.0±8.5)个月。临床表现:4例仅有中上腹不适症状,其中2例伴有反酸、嗳气和便秘。2例有急性轻型胰腺炎症状,包括腹痛(以脐周为主),低热(体温37.2~38.1 ℃),血白细胞(WBC)、C反应蛋白(CRP)和淀粉酶(AMY)轻度升高,其中1例伴有腹泻和呕吐。1例无症状,在体检腹部超声检查时偶然发现。影像学检查:所有病例均行CT平扫+增强检查。2例有胰腺炎症状的病例可见典型的“炎性团块”征象,报告为“异位胰腺待排”;其余5例报告为小肠占位性病变,包括间质瘤、平滑肌瘤或其他。3例行胃十二指肠镜检查,均未见异常。5例行腹部超声,其中2例可见小肠系膜内低回声占位性病变,同时行超声引导下穿刺活检并经病理检查诊断为异位胰腺组织。
1.2 手术方法
2例行腹腔镜下单纯肿物剜除术,5例因肿物与小肠肠管或肠系膜血管关系密切,行腹腔镜下联合部分肠管及系膜切除的肿物切除术。
2 结果
本组均手术成功,手术时间1.5~3 h,平均(1.8±2.4)h。术中探查发现肿块为长叶状,淡黄或灰白色,质地韧,有完整的包膜,长径3.5~8.5 cm,平均(5.0±2.5)cm。肿块位置:位于近端空肠Treitz韧带处3例,远端空肠系膜处2例,回肠系膜处2例。其中位于肠系膜间5例,肠系膜血管根部2例。2例与小肠肠壁部分相连接。所有病例手术切除标本均行术中快速冰冻活检,术后再次行石蜡包埋HE染色,均证实为“异位胰腺组织”。术后均未发生明显并发症并顺康复出院,住院时间7~15 d,平均(8.0±3.2)d。所有患者均通过门诊复查或电话随访,随访时间3~12个月,无复发及死亡。本组例1的CT检查、术中术后情况见图1。
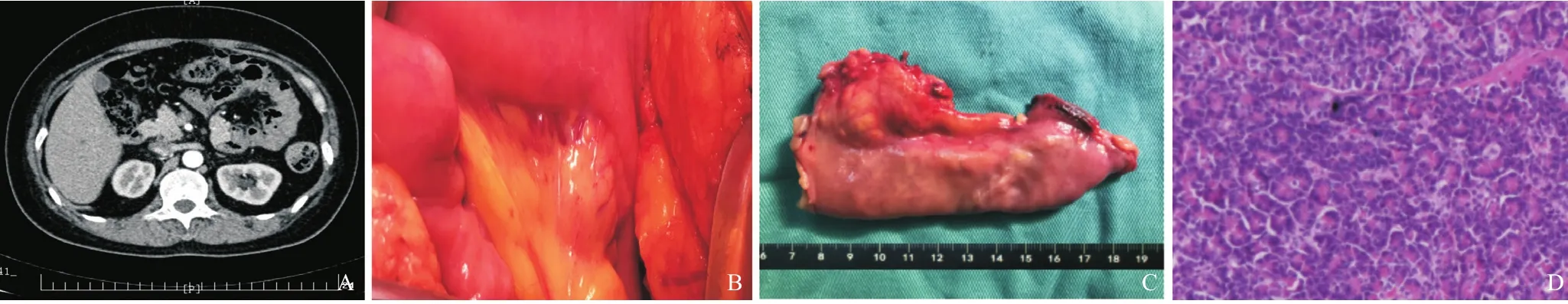
图1 病例1,女性,38岁,因“反复性上腹部疼痛1个月,加重3天”入院
3 讨论
3.1 肠系膜异位胰腺组织胚胎学与流行病学特点
异位胰腺多认为是胰腺的先天性迁移异常。其胚胎学基础尚不清楚,但最广为认同的理论是错位理论[2],即认为在胃肠道系统早期发育过程中发生了胰腺组织的异常“沉积”和“种植”,并不与主体胰腺相连。这一理论能够解释为何在大多数情况下都是在原始前肠的其他衍生物中发现异位性胰腺组织。另外两种关于异位胰腺发病机理的理论是上皮化生理论和全能细胞理论[3]。肠系膜异位胰腺在组织学上有模仿原位胰腺的组织特点和临床病理特征,如细胞成分和导管结构,类似重复畸形,但发生原因不明。
异位胰腺发生率的文献报道有较大差异,国内报道的尸体解剖中发现率为1.0%~14.0%[4]。由于大部分异位胰腺无临床症状,有时仅在其他病变行腹部手术时才偶然发现,因此潜在发生率要远高于报道的数据。异位胰腺可发生于消化道的任何部位,最常见于胃肠道(70%~87%),而肠系膜异位胰腺的发现率更低(3.8%~5.9%)[5]。
3.2 肠系膜异位胰腺的临床表现
异位胰腺的临床表现差异较大,且缺乏特异性,容易受其他部位病变的症状体征的干扰。因此很难从临床症状中判断是否存在异位胰腺和是否因异位胰腺引起病变。根据文献报道,临床上多数的异位胰腺属于隐匿型,通常无临床表现,只有30%~50%的患者有相应症状,其中0.2%~0.9%的病例是在其他腹部手术中发现[6]。异位胰腺的临床表现主要由其自身病变和对所在器官或组织的占位效应引起[7]。异位胰腺本身可发生急慢性胰腺炎、囊性变、坏死、出血,甚至恶变[8-9],少数患者还可发生胰岛细胞增生症从而出现严重低血糖反应等激素分泌异常症状;占位导致的临床表现包括胃或胆道的出口梗阻、肠套叠、肠梗阻、溃疡、出血等[9]。
异位胰腺的临床症状主要和发生的解剖位置、病理结构、病变大小、功能状况、病变发展程度、相邻器官、以其所处的组织层次相关。除了腹痛(77%)为共同特征外[10],肠系膜异位胰腺最常表现为局部压迫、梗阻及炎症,常见症状包括脐周痛(36%)、腹部饱满(30%)、便秘(24%)[11]。值得注意的是该部位病变引起的急慢性异位胰腺炎并不少见,发生率约25%[12],可能是由于此处胰腺组织损伤或导管堵塞引起,常受其他急腹症或腹部病变的干扰而难以明确诊断。严重时可引起局限性甚至弥漫性腹膜炎和腹腔积液,此类积液常见于病变处或游离腹腔,不同于普通胰腺炎常位于胰周和网膜囊内。继此种胰腺炎后可形成假性囊肿和粘连性束带,可引起压迫、局部肠管缺血、肠梗阻和肠套叠(儿童更多见),也不同于普通胰腺炎后并发症。另有少见的个案报道肠系膜异位胰腺炎后继发的肠系膜血管栓塞、穿孔和出血,这些临床表现和症状具有明显的部位差异性和特点。
3.3 肠系膜异位胰腺的诊断
3.3.1 肠系膜异位胰腺诊断困难的原因:(1)此部位的病变缺乏典型的临床表现,容易与其他部位病变特征相混淆。(2)缺乏有效的检查手段。实验室检查方面与普通胰腺炎无明显区别。影像学上检出率与病变部位和大小密切相关,消化道造影的典型表现如“脐样征”和“导管征”难以在该部位有效显示,尤其是病灶小于1.5 cm时无法分辨。内镜、EUS检查及活检术虽可确诊,但因肠道范围较广难以准确定位和操作。(3)由于该部位病变的发病率和检出率低,且文献报道不多,多为个案报道,因此对病变的认识存在不足。(4)该处异位胰腺常合并异位胰腺炎,且多有伴随症状和并发症,如果分析不充分可导致误诊误治。(5)小肠异位胰腺同时合并Meckel憩室的发生率为2.0%~6.5%[13],很难分辨是否由于异位胰腺导致肠壁憩室形成,也很难分辨是否由异位胰腺导致了症状和病理生理改变。(6)对病理诊断要求高,需要充分认识此种假瘤性病变和熟悉异位胰腺的细胞学表现,从而避免误诊为腺癌。
3.3.2 肠系膜异位胰腺诊断要点:根据笔者经验体会,该处异位胰腺的诊断具有以下特点。(1)此部位病变的长径在文献报道中差别较大,从0.5~22 cm不等(中位数8.5 cm)[14],而胃异位胰腺常小于3 cm。(2)病变较大时,有时可触及到病变部位的质硬包块。(3)病变较小时,血尿淀粉酶增高但幅度有限,脂肪酶因含量较少,为轻度升高或升高不明显。(4)CT上对于直径大于3 cm的病变显示较容易,其与正常胰腺密度相似,见于增强良好的与肠管关系密切的细长叶状肿块[14],与胃部病变的卵圆形黏膜下隆起在形态学上有差异。(5)超声下可见病变长短径比约3.0,与胃和近端小肠部位病变的长短径比1.4~1.5差异明显[15]。(6)MR和MRCP有时在分化明显的病变中可见导管系统,与肠腔相通,但因多数情况合并有急性炎症、水肿等会妨碍导管的识别。(7)病变常孤立存在,宽基,可延伸到系膜血管根部或包绕血管,在急性炎症期影像上会增大,表现为“炎性团块”是其特殊征象,但有时难与肠系膜淋巴结炎、小肠憩室炎、阑尾周围脓肿等包裹性炎症鉴别。(8)组织学上可见异位胰腺组织浸润空肠壁,并延伸至肌层和黏膜下层。(9)明确诊断的金标准仍是活组织检查和切除后病理诊断,但术前取材较难,内镜下活检受到限制,且炎症期取材难以取得有价值的标本(多数为坏死组织和脓肿灶)。对于非炎症期的病变采取CT或超声引导下穿刺活检(FNA)可以提高成功率和确诊率。
3.4 肠系膜异位胰腺的治疗
3.4.1 治疗方案的选择:目前对于异位胰腺的治疗方案的选择争议较大,核心问题在于是否需要手术切除。部分学者认为,异位胰腺可引起临床症状和局部组织病变,诱发异位胰腺炎及相关并发症,且有潜在恶变的可能,因此一经确诊,不论患者有无症状均应手术切除。另一方观点则认为,异位胰腺半数以上均较小,可无临床症状或轻微症状,虽有恶变概率但真实发生率极低(1.8%)[16],均为个案报道,且标志着胰腺癌发生发展密切相关的Ki-67、p53、CD133均非常低[16]。因此即使是有临床症状的病例,在不影响生活质量的情况下可以随访观察。笔者认为异位胰腺的处理原则应个性化考量,根据不同人群、不同部位和全身状态综合考虑并选择合适的时机和处理方法。对于无症状的患者和组织病理学确诊的,可以观察;而有症状、有潜在复发炎症或不能排除组织来源恶性的,可以行预防性切除。
3.4.2 手术治疗原则:(1)小儿异位胰腺的好发部位就在小肠及其系膜部,其处理应较成人更为积极。当患儿病情允许,手术切除并不增加患儿并发症发生的情况下应积极采取外科处理,以避免发生潜在的溃疡、出血、肠套叠、消化道梗阻、恶性肿瘤等严重并发症的危险。(2)文献报道直径大于1.5 cm的异位胰腺产生严重并发症的概率明显增加[17],当肿块直径>6 cm且临床症状明显时极易发生癌变[18]。故此处异位胰腺一旦发现大于1.5 cm且合并临床症状或并发症时应做预防性切除;当肿块大于3 cm且是在其他手术中偶尔发现,在不影响原定手术和切除并不困难的情况下,可考虑根据起源层次、大小,选择同时性手术切除;如发现直径大于6 cm,不论有无临床症状均应及时手术切除,预后均较好且复发率低。(3)如合并有Meckel憩室,其发生炎症、穿孔和肠套叠的几率更高[13],应作治愈性手术切除。(4)切除后不增加额外的并发症发生率是手术切除的基本原则,即手术的安全性是第一位。对于异位胰腺炎导致的急腹症,并不主张立即手术切除而是选择保守治疗,待炎症消退后再选择外科手术。而对于急重症病例、恶性肿瘤可能、需要人造材料植入、弥漫性腹膜炎等复杂腹部手术中偶然发现的异位胰腺,并不适合同时行病灶切除。(5)手术切除应包括异位组织承载区域,切缘应距离病变组织2~3 cm为宜[19]。手术术式应包括肠段结节楔形切除,肠憩室切除或肠段切除术。异位胰腺常有导管开口于邻近肠管,因此应慎重选择异位胰腺剜除术。所有手术均应作术中冰冻切片,避免误诊。如有癌变则应扩大切除范围或行根治性手术。(6)胃和十二指肠异位胰腺的治疗多采用内镜下ESD或EMR切除。但在空回肠及肠系膜处的病变难以施行,且较大的病变(>2 cm)和侵及肌层浆膜层的病变内镜手术并不适合。熊英等[20]报道腹腔镜联合手术治疗异位胰腺的安全性和有效性,且有较低的并发症发生率。本组中全部病例均在腹腔镜下实施手术切除,也取得了较好的效果。
综上所述,肠系膜异位胰腺是一类罕见且容易被忽视的先天性疾病。大多数无症状,少部分可出现具有临床意义的病理生理过程,表现为不同的临床症状和并发症,与其发生部位、大小、邻近器官及功能状态密切相关,但缺乏特异性。诊断与鉴别诊断很困难,即便是在有临床症状的病例中也很难在术前明确诊断。通过对其临床表现、诊断、治疗策略和方法的总结,采取多种影像手段综合分析,以活组织病理检查为核心制定个体化的治疗方案和实施微创手术,将提高诊断率并获得更佳的疗效。
