优化经皮穿刺置管引流术在重症急性胰腺炎治疗中的应用
2019-02-14王鹏飞杨世忠刘志伟任为正蔡守旺
王鹏飞,杨世忠,刘志伟,任为正,蔡守旺
(1.解放军总医院 肝胆外科,北京 100853;2.北京清华长庚医院 肝胆外科,北京 102218)
感染性胰腺坏死(infected pancreatic necrosis,IPN)是重症急性胰腺炎(severe acute pancreatitis,SAP)常见的严重并发症,一旦发生,患者病情便迅速恶化,其病死率可高达30%,是造成SAP患者“第二个死亡高峰”的主要原因之一[1-2]。传统治疗IPN的方法是开腹坏死组织清创术附加术后持续灌洗引流,但是该手术创伤较大,给患者带来二次打击,并发症发生率和死亡率均较高[3]。近些年来,多种微创治疗感染性胰腺坏死组织的清除术逐步应用于临床,取得良好疗效,改善了患者预后,因而被国内外急性胰腺炎诊治指南推荐优先应用于治疗IPN[4]。然而常用的微创治疗手段如经皮肾镜、视频辅助小切口、腹腔镜等,都需要前期通过经皮穿刺置管引流术(percutaneous catheter drainage,PCD)为后续手术建立操作通道[5]。PCD是否合理,不仅关系到IPN的引流效果及病情转归,更关乎后续感染性坏死组织清除的效率。笔者从2008年起在国内率先使用经皮肾镜这项微创技术治疗SAP,至今累计成功治愈200余例患者,并积累了一定的经验,体会到优化PCD对治疗SAP患者意义重大[6-7]。
1 临床实践中PCD不足之处
解放军总医院收治的SAP患者多由外院转诊而来,大部分已在当地医院行PCD治疗,但是很多并不理想,其存在问题可以归为下列几类。
1.1 引流不充分
部分转诊病例IPN范围较大,但只有1根PCD,引流量少,病情无明显改善,其背后的原因首先是医护人员错误地认为只要穿刺置管将病灶与外界沟通就能起到引流作用,未评估该操作是否达到充分引流减压的效果;其次有的医师认为PCD应该根据病情变化分次逐步进行。其实不充分的引流非但不能缓解病情,有时甚至可以加大后续坏死组织清除术的难度,笔者碰到数例SAP患者合并大范围的IPN,行单根PCD治疗后,脓腔内压力降低,腔壁塌陷导致原本为一整体的病灶分隔为数个独立小病灶,其中某些病灶因距体表皮肤较远,且被周围脏器和血管阻隔无法行PCD,从而丧失微创手术机会,只能选择传统开腹手术。
1.2 时机把握不当
SAP患者的局部并发症根据是否合并感染应采取不同的治疗策略。一般来说,未合并感染的不应行PCD治疗[8]。我们收治的部分转诊患者,原本病情稳定,行PCD治疗后反而造成逆行感染,引流不畅导致病情加重。也有患者病程超过4周,胰周已形成包裹性坏死(walled-off necrosis,WON)且合并感染还迟迟不行PCD引流,转院后第一时间给予PCD治疗,患者一般情况迅速好转。
1.3 路径选择不合理
一般而言,PCD治疗由介入科或者超声科医生单独完成,他们操作时往往仅考虑取病灶距离皮肤最近处穿刺,满足于“穿到即可”,全然未考虑到该路径是否方便后续外科医生借此通路行微创清除术,造成在手术时才发现通过PCD的路径进入肾镜后“要么看不到,要么看得到却够不到”的尴尬局面。更有甚者,穿刺置管时误穿结肠、胃等空腔脏器,造成了医源性损伤,这对于SAP患者来说无异于雪上加霜。
1.4 引流管选择不合理
留置的引流管直径与引流效果密切相关,IPN既有淤泥样固体成分,也有脓涕样液性成分,如引流管管径太细很容易导致引流不畅。观察转诊患者的PCD所用管路,多为直径8 F的猪尾管,将其更换为14 F或16 F的引流管后引流量往往大量增加,对于稳定病情大有帮助。
2 优化PCD的经验
对于SAP的治疗国内外学者多主张采用进阶梯(step-up approach)策略,即内科治疗-PCD-微创手术-开腹手术,PCD作为其中关键一环,其是否正确合理对于病情转归十分重要[9]。目前IPN的微创清除术主要在肾镜、胃镜、胆道镜下完成,鉴于胃镜和胆道镜下抓钳、网篮等器械清除坏死组织效率较低,而肾镜下使用的无创肠钳清创效率可成倍增加,因此成了主流技术手段。作为一种不可弯曲的硬质镜,术前PCD建立的路径是否合理更显重要,否则会残留视觉盲区和(或)操作盲区。回顾笔者中心微创治疗SAP患者的10年经验,在优化PCD治疗方面有如下体会。
2.1 穿刺时机
SAP患者局部并发症如无证据表明其合并感染,原则上不予有创干预,采用保守治疗策略并观察病情变化。如果合并感染但是病情尚稳定,病程不足4周时可继续严密观察病情变化,若合并脓毒血症或MODS则应及时行PCD治疗;如果病程已满4周,则给予多点PCD治疗,实现充分引流。
2.2 穿刺路径
为实现充分引流,我们提倡在CT引导下行一次性多点穿刺治疗,可用的路径有:(1)左侧腹膜后入路:相当比例的SAP患者,其IPN病灶位于胰体尾及其周围,距离左侧季肋部皮肤较近,可以通过脾下极-肾周间隙穿刺置管引流,如图1A所示。作为最常用的PCD入路,其好处是走行于腹膜后,不会造成腹腔内感染波散,且后续治疗经此路径进行清创操作的安全性较高。(2)右侧腹膜后入路:胰头周围病灶距离右侧季肋部皮肤较近,采取经右侧肾前间隙的腹膜后入路建立通路,有利于便捷地清除胰头周围感染性坏死灶,如图1B所示。(3)双侧低位腹膜后入路:部分SAP患者的感染坏死灶可以沿双侧结肠旁沟从腹膜后一直延伸至盆腔平面,呈“马蹄形”,为实现充分引流,同时避免后续微创清除术时残留操作盲区,应在盆腔平面行腹膜后入路的PCD治疗,如图1C所示。(4)脾胃间隙入路:患者脾门处感染性病灶处理往往较为棘手,如不能建立有效路径,则容易造成感染灶残留。采用经腹-脾胃间隙路径PCD治疗,即可被动引流,也可用作灌洗液入路,经其他PCD引流,形成对冲之势,此外还可留作后续残留病灶清除术的备用通道,如图1D所示。(5)经腹-胃结肠韧带的前入路:该路径适用于位于小网膜囊内感染坏死病灶的引流,也可用做灌洗液入路,与其他PCD配合形成冲洗-引流环路,强化术后持续灌洗引流效果,如图1E所示。需要指出作为经腹路径,如果需要经其清除坏死组织时,需要在2~3周内逐步扩张、培育该窦道,以免感染病灶在腹腔内波散。(6)经背侧入路:适用于腹膜后-脊柱旁感染灶的引流,如图1F所示,感染灶位于脊柱左侧-脾肾间隙内,就近在背侧皮肤处进行PCD治疗后治愈。
作为进阶梯治疗策略中关键一环,在设计PCD治疗路径时不仅要考虑引流效果,更要考虑如何能使后续微创手术最大程度的清除感染坏死灶。每例SAP患者的感染坏死病灶形态不一,应个体化组合使用上述6种PCD路径,以实现充分引流,力争所有病灶可通过微创手段全部清除,避免残留病灶迫不得已开腹手术清创。例如图1G所示病例,IPN病灶较为广泛,我们使用三维可视化技术对病灶进行重建(图1H),并虚拟后续经皮肾镜坏死组织清除术,设计了多点PCD入路:5个腹膜后入路(左侧3个,右侧2个,红色箭头所示)联合1个胃结肠韧带入路(白色管路),充分引流1周后行经皮肾镜胰腺坏死组织清除术,清除了大量感染性坏死组织,配合术后持续灌洗引流,术后29 d痊愈出院。回顾笔者中心微创治疗的SAP病例数据,大多数患者只需一次微创手术即可治愈,明显少于文献报道的其他微创治疗SAP研究,笔者相信这与一次性建立多条通道密切相关。多点PCD的好处还有:(1)最大程度将感染病灶引流,降低病灶压力,尽快控制全身炎症状态;(2)促进病灶脓腔壁的成熟,从而缩短了从PCD到手术的时间,增加了手术安全性,减少手术次数,缩短病程;(3)形成对冲环路,强化术后冲洗引流效果。回顾笔者中心治疗的近200例SAP患者数据,多点PCD术后其APACHE II评分、器官功能不全发生率、CT严重指数和C-反应蛋白水平均明显下降,且并无管路相关并发症发生。
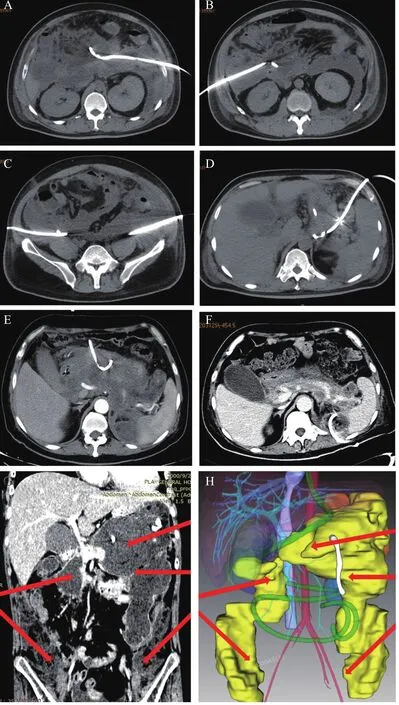
图1 经皮穿刺置管引流术治疗IPN的多种路径
除一次性多点穿刺置管外,优化PCD治疗还应考虑的原则有:(1)优选腹膜后路径,该路径不但降低腹腔内感染波散可能,更可降低后续手术误伤腹腔内脏器风险;(2)沿病灶的最长轴径方向穿刺,以便后续手术时能最大程度清除坏死组织;(3)避免紧贴空腔脏器进行穿刺,防止引流管长时间压迫胃肠道造成消化道漏;(4)穿刺点距离病灶不可过远,该距离如超过腹腔镜穿刺器长度,会为后续微创手术建立操作通道带来困难;(5)对于复杂病例,借助3D重建虚拟技术辅助确定PCD数量和路径;(6)及时、定期行腹部影像学检查,根据病灶形态变化必要时行补充PCD治疗。
3 结论
充分、合理的PCD本身可治愈部分SAP合并IPN病例,即使未能治愈,其一般状况也因此而明显改善,病情获得稳定,更重要的是为后续微创坏死组织清除术起到了“开路架桥”作用,扩大了微创手术的适应证,使得传统开腹清创的比例显著下降,提高了SAP患者的救治效果。因此,优化PCD治疗在SAP治疗中的应用临床意义十分重要。
