脑梗死患者肾小球滤过率预估值、胱抑素C水平与脑微出血的相关性分析
2019-02-13孔令博
张 宇,孔令博,苗 青,张 华,郭 楠
(北京中医药大学东直门医院,北京 100700)
脑梗死是神经内科常见疾病,该病发生突然且发作快,可导致严重神经功能缺损,致残率和病死率居高不下,已成为威胁公众健康的主要疾病[1,2]。脑微出血(CMBs)是指脑微小血管破裂、微量血液渗漏引起的脑部损害,为有出血倾向的微血管病变标志[3]。研究指出,CMBs是脑梗死后继发脑出血的重要危险因素,可导致患者出现认知障碍,共济失调等症状[4]。有效防治CMBs发生,对改善患者预后、减轻其负担具有重要意义。流行病学调查发现,慢性肾脏病与脑梗死发生存在密切关联性[5],评价患者肾功能可反馈脑梗死情况,但目前关于慢性肾脏病与CMBs的关系报道却少见。胱抑素C(CysC)、肾小球滤过率预估值(eGFR)均为肾功能评价指标,本研究分析脑梗死患者eGFR、CysC水平与CMBs的相关性,现报道如下。
1 资料与方法
1.1 一般资料2018年1月至2019年4月我院收治的120例脑梗死患者,均符合2014版《中国急性缺血性脑卒中诊治指南》[6]中的脑梗死诊断标准,年龄≥18岁,排除脑出血、脑肿瘤、有颅内出血史、心源性脑栓塞、病情危重及无法耐受MRI检查、急性感染、凝血功能障碍、急性肾功能不全、因手术或外伤等因素引起的暂时性eGFR下降者。患者均对本研究知情同意,且本研究通过我院伦理委员会审批。120例患者中男64例,女56例,年龄41~80岁[(60.39±8.25)岁],伴高血压63例,伴糖尿病29例,伴高脂血症27例。
1.2 方法MRI平扫及DWI检查:采用美国GE 3.0T HR-MRI扫描仪,8通道头颈联合线圈,均行磁敏感加权成像(SWI)、T1WI、T2WI和DWI扫描,SWI扫描参数:层厚1.2 mm,矩阵350×445,FOV 190 mm×220 mm,偏转角15°。eGFR、CysC水平检测:采集患者静脉血3 ml,离心分离血清,应用免疫比浊法检测血清CysC水平,仪器为日立7600-120全自动生化分析仪,试剂盒由日本极东公司提供,血清CysC正常范围:≤1.0 mg/L。采用日立全自动生化仪酶法测定血清肌酐(Scr)水平,根据Cockcroft-Gault公式计算eGFR:Ccr(ml/min)=[(140-年龄)×体重(kg)×n]/(72×Scr),Scr单位为mg/dl,男性n=1,女性n=0.85。
1.3 诊断和分级标准CMBs的SWI表现:病灶呈类圆形信号减低或信号缺失区,直径2~10 mm,边界清晰,密度均匀,排除海绵状血管瘤、脑动脉远支小血管流空影、钙化造成的苍白球低信号。所获影像学资料由2名经验丰富的神经内科医师(对研究不知情)予以评价,若诊断存在分歧,则由1名副主任及以上级别神经内科医师诊断后确定。根据检查的CMBs数量进行CMBs分级,其中0级表示无CMBs,1级表示1~3个CMBs,2级表示4~10个CMBs,3级表示>10个CMBs。
1.4 统计学方法采用SPSS 20.0软件分析数据。计数资料比较采用卡方检验;计量资料比较采用t检验;混杂因素分析采用多因素Logistic回归模型;相关性分析采用Spearson相关分析。P< 0.05为差异有统计学意义。
2 结果
2.1 脑梗死患者CMBs发生情况120例脑梗死患者中49例发生CMBs,CMBs发生率40.83%,其中1级15例,2级18例,3级16例。
2.2 CMBs组与无CMBs组一般资料比较CMBs组年龄、高血压史、DBP、SBP、hs-CRP、eGFR、CysC水平与无CMBs组比较差异均有统计学意义(P< 0.05),见表1。

表1 CMBs组与无CMBs组一般资料比较
2.3 混杂因素分析将患者eGFR、CysC水平作为自变量,将性别、年龄、吸烟史、高血压史、糖尿病、高脂血症、DBP、SBP、FPG、Hb、TC、LDL-C、hs-CRP、NIHSS作为协变量,将发生CMBs作为固定因子,根据主体间效应检验结果,显示hs-CRP是干扰CysC的协变量,校正模式Ⅲ类平方和为1.415,F=4.196,P< 0.05,校正混杂因子后,CMBs患者eGFR、CysC水平与无CMBs患者差异有统计学意义(P< 0.05),见表2。

表2 混杂因素分析
2.4 不同CMBs分级患者eGFR、CysC水平比较
不同CMBs分级患者的eGFR、CysC水平均存在差异,其中CMBs 3级患者eGFR水平低于2级和1级患者,CMBs 2级患者eGFR水平低于1级患者(P< 0.05);CMBs 3级患者CysC水平高于2级和1级患者,CMBs 2级患者CysC水平高于1级患者(P< 0.05),见表3。
2.5 CMBs分级、eGFR、CysC水平间相关性分析CMBs分级与eGFR水平呈负相关,与CysC水平呈正相关(P< 0.05),eGFR水平与CysC水平呈负相关(P< 0.05),见表4。
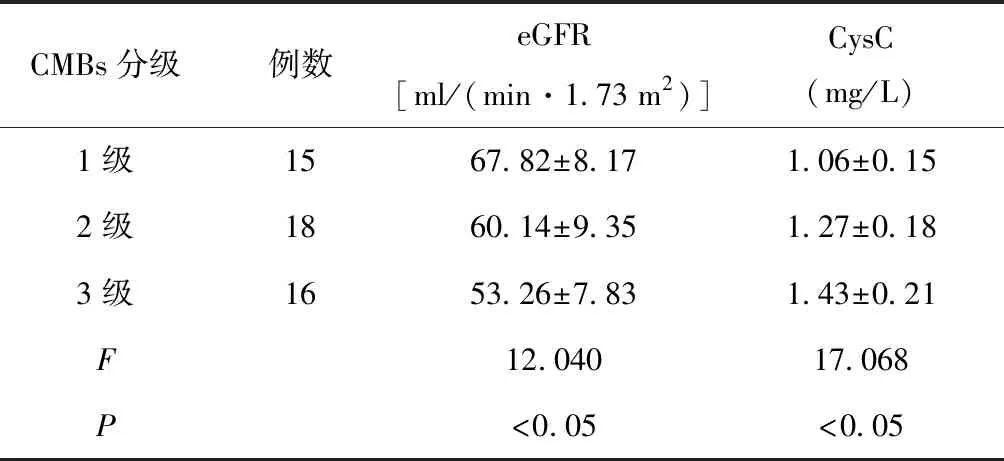
表3 不同CMBs分级患者eGFR、CysC水平比较

表4 CMBs分级、eGFR、CysC水平间相关性分析
3 讨论
CMBs为脑梗死出血转化的危险因素之一,其发生是对溶栓和抗凝治疗的警示,及早诊断CMBs,并给予有效干预措施,对维护患者生命健康具有重要意义。因CMBs多无明显征兆,常规影像学检查较难发现该病变,SWI是当前检测和诊断CMBs的最敏感方法[7],本研究使用SWI检测CMBs,结果显示120例脑梗死患者中CMBs发生率为40.83%,其中1级15例,2级18例,3级16例。朱慧颖等[8]研究显示,131例脑梗死患者中46例发生CMBs,占比35.11%;周先岭等[9]研究显示,74例脑梗死患者中CMBs发生率为48.65%,不同研究报道CMBs发生率不同,这可能与检测方法和调查人群有关,但总体可见脑梗死后CMBs发生率较高,需引起重视。
研究表明,对于脑梗死患者,其显示肾损害的同时多存在CMBs[10],这可能是因为两者之间存在相似病理机制[11~13]:①快速流动低阻力性血流的持续性刺激会使肾脏小髓质旁输入动脉长时间处于紧张性高压状态,而受血液涡流影响,多数呈垂直发出状态的大脑深穿支动脉也处于高压状态,长时间下,二者血管壁均会发生损伤,造成小血管病变,继而引起肾功能损害和CMBs发生;②小血管病变会引起血管内皮细胞功能障碍,使得一氧化氮(NO)水平下降,继而促进平滑肌细胞增殖,血管舒张功能异常,脑血流量调节紊乱,最终造成肾功能损害和CMBs发生。③肾功能损害患者夜间血压水平长期较高,这会引起微小动脉透明变性,脑动脉中层发生退行性改变,造成血液外渗,进而形成CMBs。那么肾功能损害是否可能反映脑小血管损害情况?肾功能损害多通过肾小球率过滤(GFR)评估,但其无法直接测定,需通过对某种标记物的清除率来反映,多采用Scr测定来估算eGFR。CysC为分泌性蛋白质,其产生率稳定,绝大多数通过肾脏排泄,可作为反映GFR的理想标记物[14]。本研究结果显示,CMBs组年龄、高血压史、DBP、SBP、hs-CRP、eGFR、CysC水平与无CMBs组比较差异均有统计学意义,经过混杂因素分析,校正混杂因子后,eGFR、CysC水平与CMBs发生有关,可见eGFR、CysC水平可反映CMBs发生情况。孙海荣等[15]研究显示,缺血性脑卒中患者血清CysC水平与CMBs独立相关。对比不同CMBs分级患者eGFR、CysC水平,发现CMBs 3级eGFR水平<2级<1级,而CMBs 3级CysC水平>2级>1级,提示CMBs级别随着eGFR水平的下降和CysC水平的升高呈增加趋势。相关性分析显示CMBs分级与eGFR水平呈负相关,与CysC水平呈正相关,即eGFR、CysC水平还可在一定程度上反馈CMBs病变程度。且eGFR水平与CysC水平呈负相关,因CysC主要通过肾脏排泄,会受到肾小球滤过率影响,肾小球滤过率下降时CysC水平会升高,可能CysC水平通过肾小球滤过率变化,与CMBs有相关性。
综上所述,对于脑梗死患者而言,其eGFR水平降低和CysC水平升高与CMBs发生存在密切关联性,且随着eGFR水平的降低和CysC水平的升高,CMBs级别也呈上升趋势,提示eGFR、CysC水平可预测CMBs发生风险。
