GPRC5A、SOCS3和STAT3在结直肠癌组织中的表达及相关性分析
2019-02-12元建华张曙波李建旺毛山山崔荣花张罡
元建华 张曙波 李建旺 毛山山 崔荣花张罡
结直肠癌在我国发病率和死亡率均位居全部恶性肿瘤第5位,且近年来有上升趋势[1]。G蛋白偶联受体C 家族 5A(G protein-coupled receptor,family C,group 5,member A,GPRC5A)是一个全反式维甲酸所诱导的基因。GPRC5A在结直肠癌、肺癌、头颈鳞状细胞癌、胃癌、乳腺癌等肿瘤中均存在异常表达[2-6]。信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)是细胞中一种重要的酪氨酸磷酸化信号通路蛋白,其信号通路是连接炎症与肿瘤的桥梁,参与了结直肠癌、头颈鳞状细胞癌和乳腺癌等肿瘤的发生发展[7-9]。细胞因子信号转导抑制因子 3(suppressor of cytokine signaling 3,SOCS3)为SOCS家族的重要分子,参与调节多种信号转导通路,在肿瘤发生发展中发挥重要作用。研究报道,STAT3通路相关基因被激活后,可激活SOCS3并形成一个经典的负反馈环,从而下调STAT3[10]。有研究发现,GPRC5A在肺腺癌中低表达,且可能通过稳定SOCS3,并抑制STAT3信号通路传导而发挥抑癌作用[11]。但目前三者在结直肠癌发生发展中的作用不明确。本研究检测GPRC5A、SOCS3及STAT3在结直肠癌组织中的表达及其与临床病理特征及三者表达的相关性。
1 资料与方法
1.1 一般资料
收集2015年1月至2017年12月于中南大学湘雅医院附属海口医院手术切除的76例结直肠癌患者的癌组织及30例相应癌旁正常组织(距癌组织≥5 cm)的石蜡标本;同时收集患者临床资料,主要包括性别、年龄、TNM分期(AJCC第八版分期标准)、肿瘤大小、部位、分化程度、浸润深度及有无淋巴结转移等。纳入标准:⑴所有患者均经病理组织学检查确诊;⑵经评估患者生存期>3个月;⑶术前未进行新辅助化疗或放疗。排除标准:⑴结直肠癌复发者;⑵合并其他恶性肿瘤者;⑶存在严重器质性疾病者;⑷临床资料不全者。本研究共纳入76例结直肠癌患者,其中男43例,女33例;年龄32~84岁,中位年龄57岁。本研究经中南大学湘雅医院附属海口医院伦理委员会批准,患者及其家属知情同意。
1.2 主要试剂
兔抗GPRC5A多克隆抗体购自美国Proteintech生物公司,鼠抗人多克隆抗体SOCS3、鼠抗人STAT3及显色试剂盒均购自武汉谷歌生物科技有限公司。
1.3 免疫组织化学法检测GPRC5A、SOCS3和STAT3蛋白表达情况
组织经切片、烘片、常规脱蜡、水化、PBS冲洗后,采用柠檬酸修复液修复。根据Envision法阻断内源性过氧化物酶,血清封闭30 min,滴加一抗兔抗GPRC5A(稀释比例为 1∶150)、鼠抗人 SOCS3(稀释比例为 1∶100)和鼠抗人STAT3(稀释比例为 1∶100),室温孵育2 h,滴加EnVisionTM孵育30 min,DAB显色,苏木素复染,0.1%HCl分化,自来水冲洗,蓝化,梯度酒精脱水干燥,二甲苯透明,中性树胶封固,显微镜下观察;PBS替代一抗作阴性对照。
1.4 染色结果判定
GPRC5A的阳性染色于细胞膜,呈棕黄色或棕褐色颗粒,部分表达于细胞质;SOCS3的阳性染色主要定位于细胞质,呈棕黄色或棕褐色颗粒,STAT3表达定位于细胞质,少数细胞核着色,染色阳性信号颗粒呈棕黄色或棕褐色。每张切片随机选取5个高倍镜视野,根据阳性细胞所占百分比和染色强度计算总评分。阳性细胞所占百分比计分:0~5%计为0分,6%~25%计为1分,26%~50%计为2分,51%~75%计为3分,>75%计为4分。染色强度:无着色计为0分,淡黄色计为1分,棕黄色计为2分,棕褐色计为3分。两项得分乘积≤3分为阴性(-),4~8分为弱阳性(+),8~12分为强阳性(++)。
1.5 统计学方法
采用SPSS 22.0统计软件进行数据分析。GPRC5A、SOCS3、STAT3在癌组织和癌旁正常组织的表达差异及其与临床病理特征的关系采用χ2检验;三者相关性采用Spearman相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 GPRC5A、SOCS3和STAT3在结直肠癌组织中的阳性表达情况
GPRC5A阳性表达定位于细胞膜和胞质内,SOCS3阳性表达主要定位于细胞质内,STAT3阳性表达主要在细胞质,少数细胞核染色,见图1。结直肠癌组织中GPRC5A和STAT3的阳性表达率均高于癌旁正常组织(59.2%vs 33.3%,P=0.016;69.7%vs 30.0%,P=0.001),而SOCS3阳性表达率则低于癌旁正常组织(38.2%vs 80.0%,P=0.001)。见表 1。

图1 GPRC5A、SOCS3和STAT3在结直肠癌及癌旁正常组织中的阳性表达情况(×200)Fig.1 Expression of GPRC5A,SOCS3 and STAT3 in colorectal cancer tissues and adjacent normal tissues(×200)

表1 GPRC5A、SOCS3和STAT3在结直肠癌组织及癌旁正常组织中阳性表达情况的比较[n(%)]Tab.1 Comparison of the positive expression of GPRC5A,SOCS3 and STAT3 in colorectal cancer tissues and adjacent normal tissues[n(%)]
2.2 GPRC5A、SOCS3和STAT3的表达与结直肠癌患者临床病理特征的关系
GPRC5A表达与结直肠癌的分化程度、淋巴结转移和TNM分期有关(P<0.05),SOCS3和STAT3表达与结直肠癌的分化程度、肿瘤浸润深度、淋巴结转移和TNM分期有关(P<0.05)。见表2。
2.3 结直肠癌组织中GPRC5A与SOCS3、STAT3表达的相关性
Spearman相关分析显示,结直肠癌组织中GPRC5A与 SOCS3 表达呈负相关(r=-0.340,P=0.003),与STAT3表达呈正相关(r=0.327,P=0.004);而 SOCS3与STAT3表达呈负相关(r=-0.308,P=0.007)。
3 讨论
GPRC5A是GPCR家族成员之一。研究表明,GPRC5A在多种肿瘤中异常表达,但在不同肿瘤类型中的表达水平及在肿瘤发生发展的作用存在明显差异,其中GPRC5A在肺癌[3]和头颈鳞状细胞癌[4]可能作为抑癌基因,而在胃癌[5]和乳腺癌[6]中被认为是促癌基因。SOCS3是SOCS家族重要成员之一,其结构中含有氨基端的激酶抑制区,是JAK强抑制剂。JIANG等[12]研究发现,抑制SOCS3的表达可促进肝癌细胞生长和增殖,体内实验结果亦显示SOCS3表达缺失可促进肝癌生长、侵袭和转移。STATs蛋白家族是一类可被多种细胞因子激活的转录因子家族,STAT3是其成员之一,在细胞生长代谢和肿瘤发生发展中具有重要作用[13]。有研究发现,STAT3在头颈鳞状细胞癌、乳腺癌、胃癌、前列腺癌、肾癌等肿瘤中均被激活,被认为是一种促癌基因,且与预后密切相关[4,8-9]。近年来有研究发现,GPCR5A在结直肠癌组织中的表达较正常结直肠组织和结直肠息肉组织明显升高[2,14],STAT3在结直肠癌组织中的阳性表达率亦高于癌旁正常组织[7],但SOCS3在结直肠癌组织中的阳性表达率低于癌旁组织[15]。本研究检测GPCR5A、SOCS3和STAT3在结直肠癌组织中的表达,结果发现相较于癌旁正常组织,GPCR5A和STAT3在结直肠癌组织中的阳性表达率明显升高,而SOCS3阳性表达率则明显降低,与上述文献报道一致。分析3个指标与结直肠癌患者临床病理特征的关系,发现GPRC5A和STAT3高表达患者及SOCS3低表达患者肿瘤分化程度更差、TNM分期更晚和淋巴结转移的可能性更大,提示GPRC5A、STAT3和SOCS3可能参与结直肠癌发生以及侵袭转移。
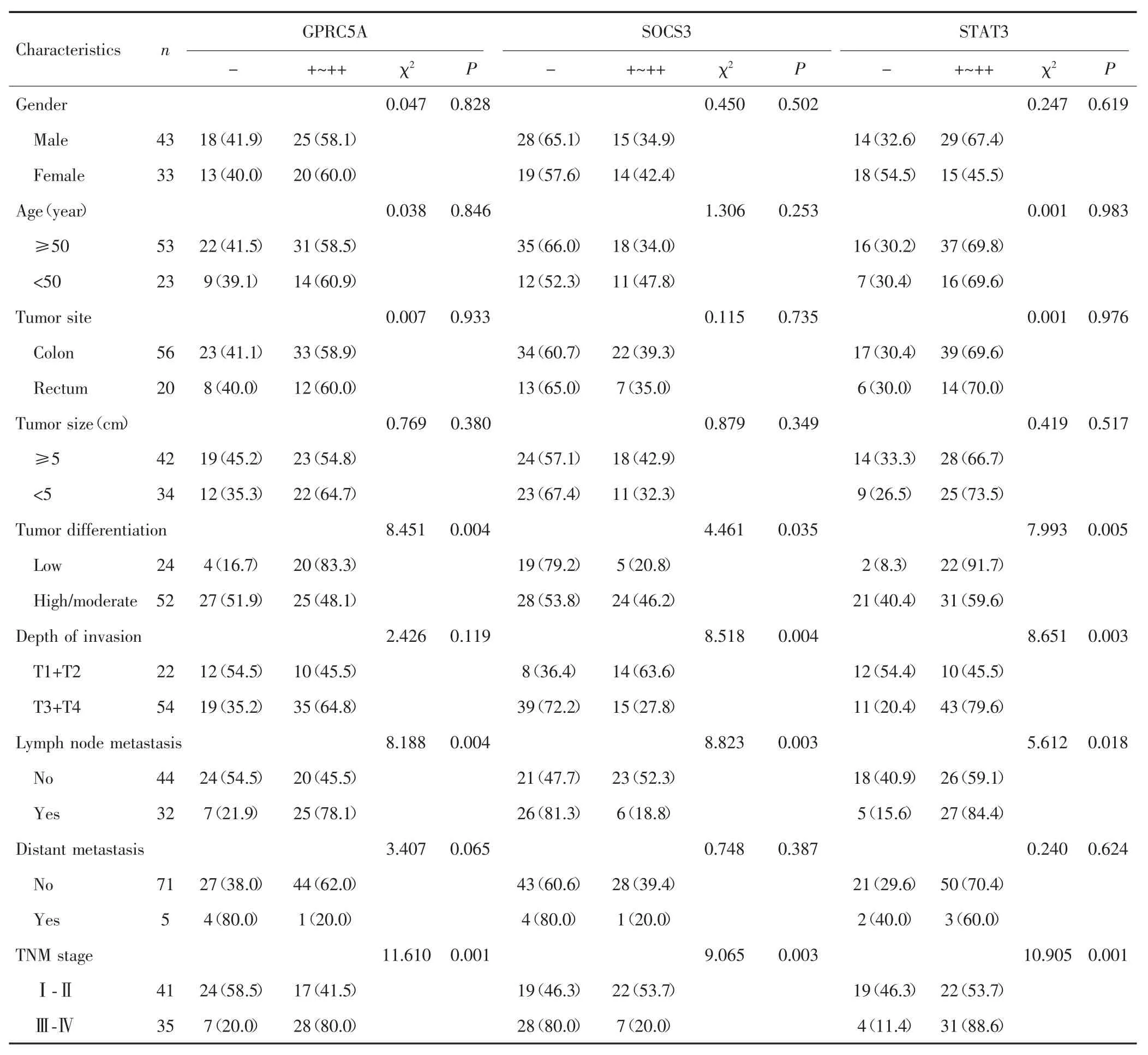
表2 GPRC5A、SOCS3和STAT3的表达与结直肠癌患者临床病理特征的关系[n(%)]Tab.2 Relationship of the expression of GPRC5A,SOCS3 and STAT3 and clinicopathological features of patients with colorectal cancer[n(%)]
有研究发现,SOCS对JAK/STATs信号通路具有负性调控作用,且在维持细胞内环境稳定、诱导细胞凋亡、抑制细胞过度生长等方面发挥至关重要的调控作用[16]。在肺癌研究中,GPRC5A表达被抑制或者敲除后,EGFR、STAT3、NF-κB、cAMP 等多条信号通路被过度激活[3,11],认为 GPRC5A 可能通过稳定 SOCS3,抑制STAT3信号通路传导,发挥其抑癌作用[11]。而庞玲等[17]在非小细胞肺癌的研究中发现GPRC5A与SOCS3呈正相关,SOCS3与STAT3呈负相关。本研究进一步分析结直肠癌组织中三者表达的相关性,发现GPCR5A与STAT3表达呈正相关,与SOCS3表达呈负相关;而STAT3与SOCS3表达亦呈负相关,与庞玲等[17]研究结果一致。
综上所述,GPRC5A和STAT3在结直肠癌组织中高表达,而SOCS3在结直肠癌组织中低表达,三者在结直肠癌组织中的表达具有显著相关性,GPRC5A与STAT3可能协同作用并下调SOCS3表达而促进结直肠癌发生及进展。联合检测 GPRC5A、STAT3和SOCS3可能有助于结直肠癌诊断及评估疾病状况。但本研究样本量较少,三者在结直肠癌中的作用及其相互作用的具体机制仍不清楚,需进一步研究验证。
