甲状腺乳头状癌中央区淋巴结转移评分系统的建立及验证
2019-02-12武元元王军毛爱红范向达张建伟段颖
武元元 王军毛爱红 范向达 张建伟 段颖
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是甲状腺恶性肿瘤最常见的病理类型,约占新发甲状腺癌的80%[1]。PTC易发生颈部淋巴结转移,转移率高达40%~90%[2]。颈部淋巴结阳性的PTC患者行治疗性颈部淋巴结清扫术已成共识,但术前难以准确判断中央区淋巴结转移(central lymph node metastasis,CLNM),因此淋巴结阴性(cN0)患者是否进行预防性中央区淋巴结清扫(prophylactic central neck dissection,PCND)争议较大。本研究分析PTC患者CLNM的影响因素,构建预测CLNM的评分系统,为临床医师选择手术方案提供依据。
1 资料与方法
1.1 研究对象
选取甘肃省肿瘤医院2015年6月—2018年6月收治的237例PTC患者作为建模组,以2018年7月—2019年6月收治的符合相同条件的100例患者作为验证组。所有患者术前均完成甲状腺及双颈部淋巴结彩色多普勒超声检查。纳入标准:⑴初次行甲状腺全切/近全切+单/双侧中央区淋巴结清扫术,术后病理确诊为PTC,中央区淋巴结清扫范围参照中国2012版《甲状腺结节和分化型甲状腺癌诊治指南》定义[3];⑵符合 cN0 期诊期断标准[4];⑶临床病理资料完整。排除合并其他并病理亚型及肿瘤和年龄<18岁的患者。本研究经甘肃省肿瘤医院伦理委员会批准。
1.2 观察指标及评判标准
根据术前甲状腺功能检验结果诊断桥本氏甲状腺炎,钙化、低回声、边界不清、肿瘤直径、肿瘤位置及包膜侵犯依据术前超声图像判定;肿瘤直径以超声图像中测量的长径为准;肿瘤位置分为腺体上极、中极和下极。包膜侵犯定义为肿瘤边缘与相邻甲状腺包膜接触面积>25%[5]。单/双侧癌和多灶癌依据术中快速病理检查结果确定,多灶癌取最大癌灶直径。超声图像的判读由2位超声科医师独立完成,结果不一致协商判定。
1.3 统计学方法
采用SPSS 17.0软件进行数据分析。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验;计数资料以n(%)描述,组间比较采用χ2检验;多因素分析采用Logistic回归,依据标准化回归系数对各独立危险因素评分,构建“10分制”评分系统。通过ROC曲线确定最佳截点值,计算评分系统的敏感性、特异性、阳性预测值、阴性预测值及诊断准确率,并验证其工作效能。以P<0.05为差异有统计学意义。
2 结果
2.1 基线资料比较
建模组237例患者中男性59例,女性178例;平均年龄为(45.8±10.3)岁;CLNM 94例(39.7%)。验证组100例患者中男性23例,女性77例;平均年龄为(47.3±8.6)岁;CLNM 42例(42.0%)。两组患者性别、年龄、肿瘤直径、肿瘤位置及CLNM等资料差异均无统计学意义(P>0.05),见表 1。
2.2 建模组中影响PTC患者CLNM的单因素分析
在建模组中进行单因素分析,结果显示性别、肿瘤直径大小、多发癌灶、肿瘤位置、包膜侵犯和边界不清是PTC患者CLNM的影响因素(P<0.05),见表2。
2.3 建模组中影响PTC患者CLNM的多因素分析
在建模组中进行多因素分析,结果显示男性、肿瘤直径>1 cm、多发癌灶、肿瘤位于腺体下极和包膜侵犯是PTC患者CLNM的独立危险因素。根据标准回归系数对各独立危险因素进行赋值评分,结果多发癌灶评1.5分,男性、肿瘤直径>1 cm、肿瘤位于腺体下极评2分,包膜侵犯评2.5分,总分为10分。见表3。
2.4 PTC患者CLNM评分系统的预测效能
依据评分系统对建模组患者进行评分,CLNM阳性组和阴性组的平均分值为(6.27±1.31)分和(4.93±1.64)分,差异有统计学意义(t=6.648,P<0.001)。绘制建模组患者CLNM评分系统的ROC曲线,曲线下面积为 0.857(95%CI:0.806~0.907),见图 1A,对应的最佳诊断截点值为5.75分,结合本评分系统的分值特点,选取6分作为最佳诊断界值,其对应敏感性、特异性、阳性预测值、阴性预测值分别为81.9%、85.3%、78.6%和87.8%;验证组分别为69.8%、78.9%、71.4%和 77.6%,曲线下面积为 0.823(95%CI:0.741~0.904),见图1B。与单一预测因素相比,基于独立危险因素的评分系统预测CLNM的准确性更优,见表4。
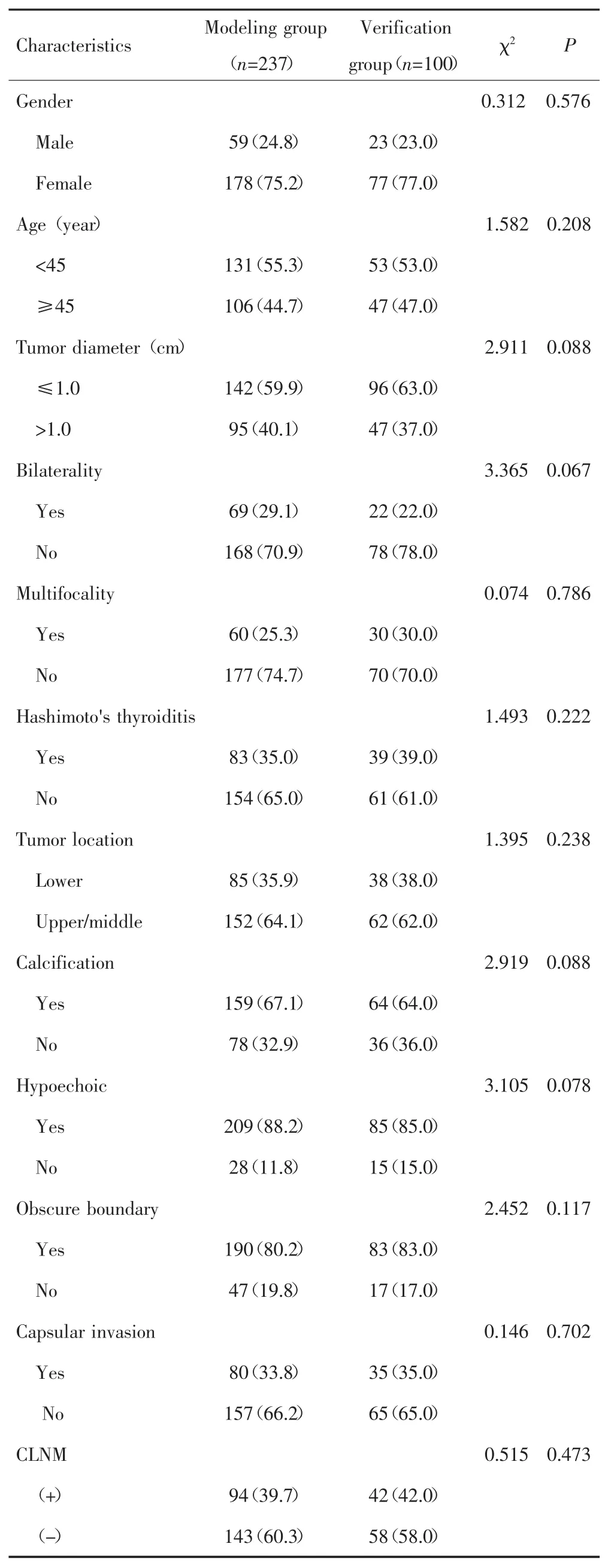
表1 建模组和验证组患者基线资料比较[n(%)]Tab.1 Comparison of baseline data of patiens between the modeling group and the verification group[n(%)]
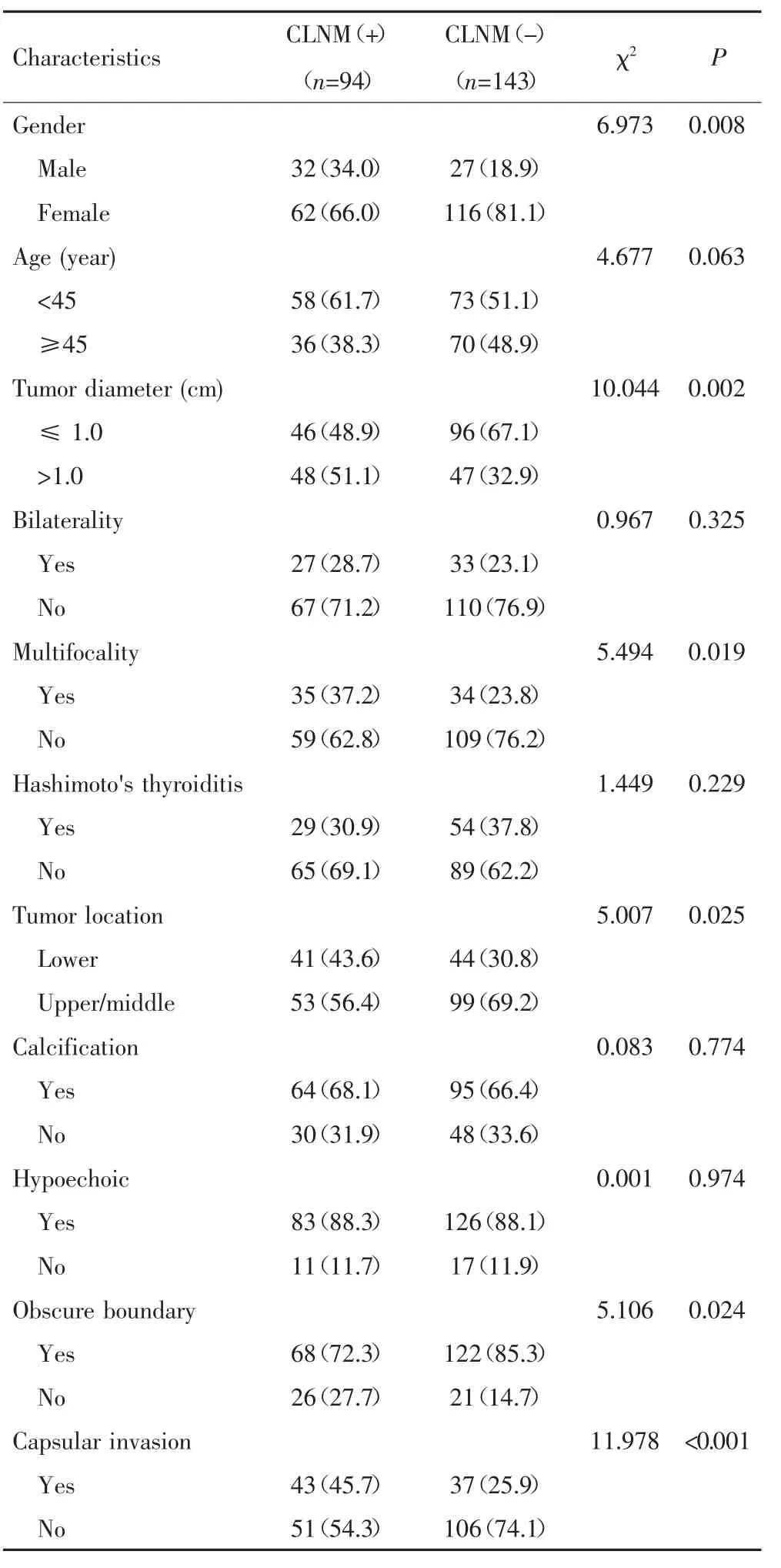
表2 建模组中影响PTC患者CLNM的单因素分析[n(%)]Tab.2 Univariate analyses of CLNM in patients with PTC in the modeling group[n(%)]
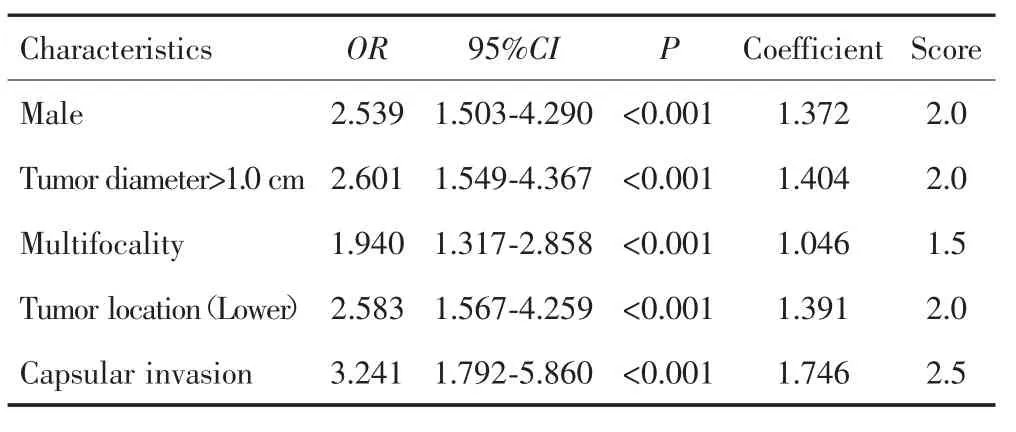
表3 建模组中影响PTC患者CLNM的多因素分析及评分系统Tab.3 Multivariate analysis and scoring system for CLNM in PTC patients in the modeling group
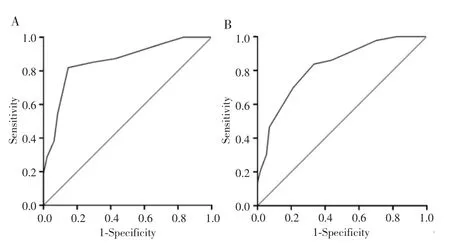
图1 PTC患者CLNM评分系统的ROC曲线Fig.1 ROC curve of scoring system CLNM in PTC patients
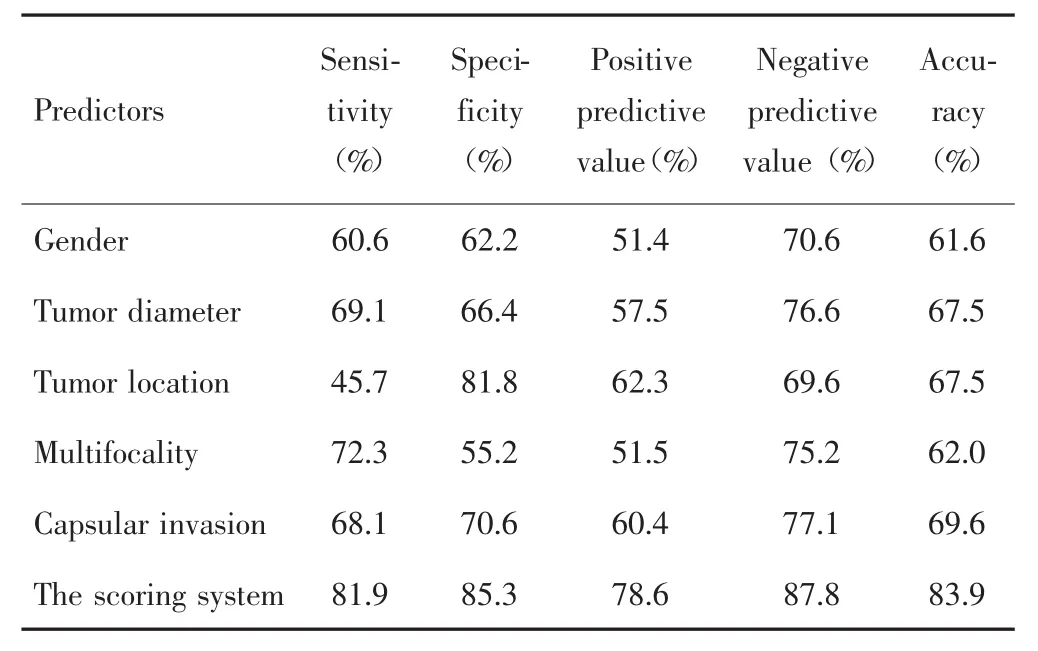
表4 基于独立危险因素的评分系统对PTC患者CLNM的预测效能Tab.4 Predictive efficacy of CLNM based on independent risk factor scoring system
3 讨论
颈部淋巴结转移是PTC最主要的转移途径,而中央区淋巴结通常是转移的第一站[6]。PTC患者CLNM的发生率为20%~80%[7],cN0期 PTC患者 CLNM发生率亦高达11.7%~63.8%[8]。本研究中cN0期PTC患者CLNM的发生率为39.7%,与上述文献报道基本一致。
多数研究表明男性PTC患者CLNM发生率明显高于女性患者[8-9],本研究结果与之相似。目前普遍认为年龄≤45岁是CLNM的独立危险因素,也有研究认为<50岁是CLNM发生风险最大的因素,而45岁作为年龄截点值可能太小致使CLNM发生率无统计学差异[10]。本研究结果显示年龄<45岁不是CLNM的危险因素,可能与选择的年龄截点值过小有关。随着肿瘤直径增大,PTC的颈部淋巴结转移率也明显增加[11-12]。本研究中肿瘤直径>1 cm的PTC患者CLNM发生率明显高于肿瘤直径≤1 cm的患者,多因素分析结果亦显示肿瘤直径>1 cm是CLNM的独立危险因素。一项荟萃分析结果表明肿瘤位于腺体下极和多发癌灶是PTC患者CLNM的独立预测因素[8],与本研究结果一致。刘文等[13]认为肿瘤位于腺体下极时CLNM发生率更高,但CLNM与肿瘤数目无关。本研究严格纳入cN0期PTC患者,且所有患者均行甲状腺全切/近全切,理论上更能反映多灶性与cN0期PTC患者CLNM的关系。本研究将超声图像中肿瘤边缘与相邻甲状腺包膜接触面积>25%定义为包膜侵犯已在多个研究中报道[5,14-15]。结果显示有包膜侵犯的PTC患者CLNM发生率明显高于无包膜侵犯的患者,多因素分析结果亦表明包膜侵犯是cN0期PTC患者CLNM的独立危险因素。以往研究证实腺外侵犯是CLNM的独立危险因素,但腺外侵犯多为术后经病理确诊,无法在术前及术中有效指导PCND术式的选择。包膜受侵作为腺外侵犯的早期阶段,易通过术前超声评估判断,对术前预测CLNM和指导PCND术式选择具有重要价值。
本研究通过单因素及多因素分析筛选出男性、肿瘤直径>1 cm、多发癌灶、肿瘤位于腺体下极和包膜侵犯等5个变量作为预测CLNM的独立危险因素,构建CLNM的“10分制”评分系统。根据ROC曲线和评分系统的分值特点,确定评分为6分时预测CLNM的效能最优,敏感性、特异性、阳性预测值及阴性预测值分别为81.9%、85.3%、78.6%和87.8%,相对于其他单一预测因素,该评分系统预测CLNM的准确率更高。验证组中该评分系统预测cN0期PTC患者CLNM的ROC曲线下面积为0.823,证实其在实际工作中具有较高的诊断准确性。研究显示BRAF V600E、TERT、NRAS等基因突变可预测PTC颈部淋巴结转移[16],但因技术要求高且费用昂贵,难以在临床工作中普及。而本研究建立的评分系统各项指标主要为患者的临床基线资料及超声图像特征,易于术前及术中获取,可行性较强。
本研究根据Logistic回归模型筛选中央区淋巴结转移的独立危险因素,并成功构建了基于独立危险因素的评分系统,经验证该评分系统具有较好的预测效能,对cN0期PTC患者制定个体化的手术方案有重要的指导意义。当评分≥6分时,患者CLNM风险较高,应积极行预防性中央区清扫。但是肿瘤直径为连续性变量,不同肿瘤大小对PTC颈部CLNM的影响还需深入研究。此外,本研究为单中心回顾性研究,且样本量偏少,该评分系统的效能仍需开展大样本、前瞻性、多中心研究进一步证实。
