糖尿病足患者外周血S100 A12的表达及价值
2019-02-11李开宇
李开宇
(济宁市第一人民医院医学检验科,山东济宁 272000)
糖尿病的发病率随着我国人口老龄化的出现而表现出不断上升的趋势[1],同时,也致使糖尿病足的临床发病率出现显著提升,目前临床上针对糖尿病足的治疗主要依靠药物治疗和血管腔内治疗,然而,一旦上述治疗措施无效,需要对患者实施截肢手术进行治疗,这就会严重影响患者的生活,并造成极大地痛苦[2-3]。鉴于糖尿病足发生、发展机制尚未被完全认知,因此,充分探讨影响糖尿病足的发生、发展机制对于该病的治疗具有至关重要的指导价值[4]。据申昕等人[5]研究发现,糖尿病足的诱发与人体的炎性反应密切相关,而S100A12与糖尿病足的诱发有着密切的联系。该文以
2017年8月—2019年8月为研究段,通过免疫印迹法检测糖尿病足患者血清中的S100A12表达情况,以期给糖尿病足患者的诊疗提供以依据和参考。
1 资料与方法
1.1 一般资料
将在该院进行治疗的60例糖尿病足患者纳为研究组,而将同期治疗的60例非糖尿病足的糖尿病患者纳为糖尿病组,此外,将同期进行健康体检的60名成年人纳为对照组,通过Wagner分级法将60例糖尿病足患者进行分级。纳入标准:(1)入选对象均对该研究享有知情权且能够积极配合检测;(2)入选对象均未见严重心、肝、肾功能障碍及恶性肿瘤;(3)该研究所采用的试验方案获得该院伦理委员会批准。其中,研究组患者:男性32例,女性28例;年龄范围45~79岁,平均年龄(66.23±3.67)岁;糖尿病组:男性34例,女性26例;年龄范围47~77岁,平均年龄(68.34±4.09)岁;对照组患者:男性31名,女性29名;年龄范围48~81岁,平均年龄(69.58±4.38)岁;3组受检对象中的性别、年龄相比,差异无统计学意义(P>0.05)。
1.2 收集血液标本
让入选对象保持空腹,于清晨抽取其10 mL肘静脉血,将其置于肝素抗凝管中,之后进行10 min离心操作(转速:3 000 r/min),将血浆分离出来后,放置在-80℃冰箱中保存待测。
1.3 检测外周血中的S100 A12蛋白
通过westernblot法对3组入选对象血清中的S100 A12蛋白表达情况进行测定,对血浆蛋白进行定量后,在凝胶泳道加入35μg/孔的蛋白,在80 V下,电泳0.5 h,之后再在100 V下电泳1h;转膜后,再采用5%的脱脂牛奶封闭1 h,最后在甘油醛-3-磷酸脱氢酶(GAPDH)和5%牛奶稀释后的S100A12抗体(比例1∶200)中进行孵育过夜(维持4℃),孵育完成后以TBST和5%的牛奶稀释的辣根过氧化物酶标记的兔抗羊二抗进行洗膜,洗膜后,严格按照ECL说明书配置发光工作液,通过凝胶成像仪成像,最后通过ImageJ软件处理和分析。
1.4 检测外周血中IL-6和TNF-α的表达量
通过ELISA试剂盒测定IL-6和TNF-α的表达量,操作步骤遵循试剂盒说明书:测量前,将样本和试剂盒平衡至室温,使用标本稀释液以1∶1的比例稀释待检标本,将50μL稀释后的标本加入至反应孔内,同时,将稀释好的50μL标准品、50μL待测样品也放至反应孔,然后立即加入50μL生物素标记的抗体。将膜板盖上,并轻轻振荡混匀,在37℃下温育1 h。将孔内液体甩去后加满洗涤液,振荡1 min,再次甩去洗涤液,用吸水纸拍干(上述操作重复3次)。每孔各加入50μL底物A、B,将其轻轻振荡混匀,在37℃的避光条件下温育10 min。取出酶标板,快速加入50μL终止液,并立即测定结果。在450 nm波长下,对各孔的OD值进行测定。分别以标准品浓度和OD值为横纵坐标绘制标准曲线,根据血浆样品的OD值在标准曲线上获得其对应的浓度。
1.5 统计方法
该次分析数据的为SPSS 19.0统计学软件。通过Pearson分析方法分析其相关性。P<0.05为差异有统计学意义。
2 结果
2.1 S100 A12、IL-6和INF-α蛋白的表达情况
与健康对照组相比,研究组和糖尿病组血清中的S100 A12、IL-6和TNF-α的表达量均显著升高,差异有统计学意义(P<0.05),但研究组的上升趋势更加明显,研究组和糖尿病组相比,差异有统计学意义(P<0.05)。见表1。
表1 S100 A12、IL-6和INF-α蛋白的表达情况(±s)

表1 S100 A12、IL-6和INF-α蛋白的表达情况(±s)
注:与正常对照组比较a P<0.05,差异有统计学意义;与非糖尿病足比较b P<0.05,差异有统计学意义。
组别S100 A12(S100 A12/GAPDH)IL-6(ng/mL)TNF-α(ng/mL)对照组(n=60)糖尿病组(n=60)研究组(n=60)0.09±0.02(0.13±0.07)a(0.78±0.15)ab 10.4±1.6(19.1±3.3)a(32.8±5.4)ab 8.2±2.7(14.6±3.5)a(98.6±7.6)ab
2.2 S100 A12、IL-6和TNF-α在糖尿病足患者的不同分级中的表达情况
通过分析S100 A12、IL-6和TNF-α在糖尿病足患者的不同分级中的表达情况发现,糖尿病足患者的严重程度与其外周血中的S100 A12、IL-6和TNF-α的表达量紧密相关,患者的病情越重,相应的,其外周血中的S100 A12、IL-6和TNF-α的表达量越高,差异有统计学意义(P<0.05)。见表2。
表2 S 1 00 A12、IL-6和TNF-α在糖尿病足患者不同分级中的表达情况(±s)
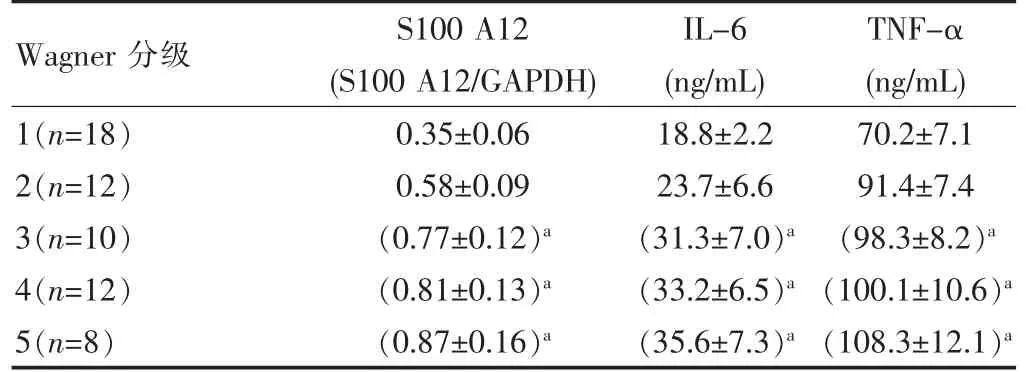
表2 S 1 00 A12、IL-6和TNF-α在糖尿病足患者不同分级中的表达情况(±s)
注:与1级比较,a P<0.05,差异有统计学意义。
Wagner分级S100 A12(S100 A12/GAPDH)IL-6(ng/mL)TNF-α(ng/mL)1(n=18)2(n=12)3(n=10)4(n=12)5(n=8)0.35±0.06 0.58±0.09(0.77±0.12)a(0.81±0.13)a(0.87±0.16)a 18.8±2.2 23.7±6.6(31.3±7.0)a(33.2±6.5)a(35.6±7.3)a 70.2±7.1 91.4±7.4(98.3±8.2)a(100.1±10.6)a(108.3±12.1)a
2.3 S100 A12与TNF-α和IL-6表达的关系
通过Pearson分析方法分析糖尿病足患者血清中S10 0A12的表达量与TNF-α和IL-6的表达量的关系,结果发现其呈现出正相关的关系,差异有统计学意义(r2=0.58,r2=0.69,P<0.05)。
3 讨论
S100 A12属于钙结合蛋白家族,其主要是由中性粒细胞和单核巨噬细胞合成和分泌而来,共包含90多个氨基酸,而且还含有4个螺旋亚基的反向平行结构,在一些炎症反应和肿瘤等多种病理性疾病的诱发过程中扮演重要角色[6-7]。S100 A12和钙离子结合后,其C端会暴露出1个疏水性裂隙,此裂隙是其靶蛋白的识别位点,因此,S100 A12能够和特异性的蛋白或肽类识别并结合[8]。当患者缺乏钙离子时,S100 A12蛋白主要存在于细胞浆中;当富余钙离子时,则S100 A12蛋白会出现在细胞支架和细胞膜上。高级聚糖化终产物以S100 A12蛋白的配体为受体,S100 A12在和RAGE结合后,能够将细胞内信号的级联反应激活(如NF-κB和丝裂原激活蛋白激酶),进而实现对炎性因子如TNF-α和IL-6的合成和分泌过程的调控,既往研究中,TNF-α和IL-6已经被证实是糖尿病足的发病机制中重要一环,因此该研究推测,S100 A12蛋白的异常是糖尿病足诱发的根本原因。
该研究结果显示,与健康对照组相比,研究组和糖尿病组血清中的S100 A12、IL-6和TNF-α的表达量均显著升高,差异有统计学意义(P<0.05),但研究组的上升趋势更加明显,研究组和糖尿病组相比,差异有统计学意义(P<0.05);同时,糖尿病足患者的病情越重,相应的,其外周血中的S100 A12、IL-6和TNF-α的表达量越高,差异有统计学意义(P<0.05);此外,通过Pearson分析方法分析糖尿病足患者血清中S100 A12的表达量与TNF-α和IL-6的表达量的关系,结果发现其呈现出正相关的关系,差异有统计学意义(r2=0.58,r2=0.69,P<0.05)。
综上所述,外周血中S100 A12的表达量在糖尿病足患者中会出现显著上升的情况,其可能在糖尿病足发病机制中扮演重要角色。
