高锰酸钾法测定石膏中钙的含量
2019-02-11程钱夏
程钱夏
(江西铜业集团有限公司 贵溪冶炼厂,江西 贵溪 335424)
1 引言
石膏是一种广泛的工业材料和建筑材料,对于一些单位来说石膏的准确测定直接影响产品的品位。石膏的主要化学成分是硫酸钙(CaSO4),理论 组 成 约 为CaO:32.5%,SO3:46.6%,H2O:20.9%[1]。但由于一般废水处理使用的生石灰产生的石膏有许多干扰元素,用酸处理测钙存在样品溶解不完全的问题,不能满足要求,本文采用碱熔法处理样品,通过试验论证其切实可行,确定了能够准确、快速的对石膏中钙量进行测定的有效方法。
2 实验试剂
(1)氧化钾;
(2)草酸;
(3)甲基橙指示剂(1g/L);
(4)氨水(1+1);
(5)硫酸(1+9);
(6)氧化钙标准;
(7)盐酸(6mol/L);
(8)CaCl2溶液(0.5mol/L);
(9) 高锰酸钾标准溶液的配制(c(1/5KMnO4)=0.0500mol/L):称取1.6g 固体高锰酸钾放于2000mL 烧杯中,加入1000mL 煮沸的蒸馏水,放置数日后,用玻璃漏斗过滤,保存在棕色试剂瓶中。
标定:称取0.2000g 预先在105℃干燥2 h 的无水草酸钠(优级纯)于250mL 烧杯中,加热溶解后,加入30mL6mol/L1/2H2SO4溶液,用水稀释至150mL,加热至70~80℃,用高锰酸钾标准滴定溶液,滴定至粉红色且在15s 内不退色为止。2.0草酸溶液(20g/L);
除非另有说明,在分析中仅使用确认为分析纯的试剂和蒸馏水、去离子水或相当纯度的水。
3 实验方法
在50mL 镍坩埚底铺1 g 氢氧化钾,称取0.5000g试样于此坩埚中,再在样品上铺2 g 氢氧化钾,在电炉上脱水、摇匀后盖上坩埚盖。放入700℃马弗炉中,10min 之后取出。稍冷,将镍坩埚放入装有50mL 热水的200mL 的烧杯中浸取,冷却。
样品定容250mL(若有沉淀进行干过滤),分取50mL 溶液于500mL 三角烧杯中,滤液用水稀释至200 ~250mL,加热至60℃,边搅拌边加入1g草酸,加热至近沸,加3 滴甲基橙指示剂,用氨水中和至有显著的氨味,用草酸溶液中和过量氨水至氨味消失,指示剂保持黄色 (此时溶液的PH 为4左右),在搅拌下煮沸5 ~10min,然后在电热板上微沸保持0.5 ~1h,使沉淀陈化。待溶液自然冷却后用慢速定性滤纸过滤,用草酸铵溶液洗涤3 ~4次,再用蒸馏水洗涤至无草酸离子为止(在洗涤近完成时,用小表面皿接取约1mL 滤液,加入CaCl2溶液,无浑浊现象,证明已经洗涤干净)。将滤纸打开,贴在原烧杯壁上,用热硫酸将沉淀洗下来,并将滤纸放入并捣碎,吹洗杯壁3 至5 次,用硫酸稀释至约100mL,加热至70 ~80℃[2],用高锰酸钾标准滴定溶液滴定,采用由慢到快的速度滴定至粉红色且在30s 内不消失为止[3]。
4 结果与讨论
4.1 选择酸或碱熔样试验
实验中涉及到样品溶解采用酸溶法还是碱熔法的选择,采用碱熔氢氧化钾的加入量、马弗炉中溶样的温度和时间,生成沉淀的酸度和滴定温度等因素的确定问题[4]。现就这几个影响因素进行条件实验。
(1)用酸溶解样品。
称取石膏如下两个样品0.5000g 于250ml 三角烧杯中,加少量蒸馏水润湿,盖上表面皿,从烧杯嘴处慢慢滴加HCL 溶液15ml,不断轻摇至不冒泡,低温加热2min。之后用试验方法测定石膏中钙含量,结果见表1。
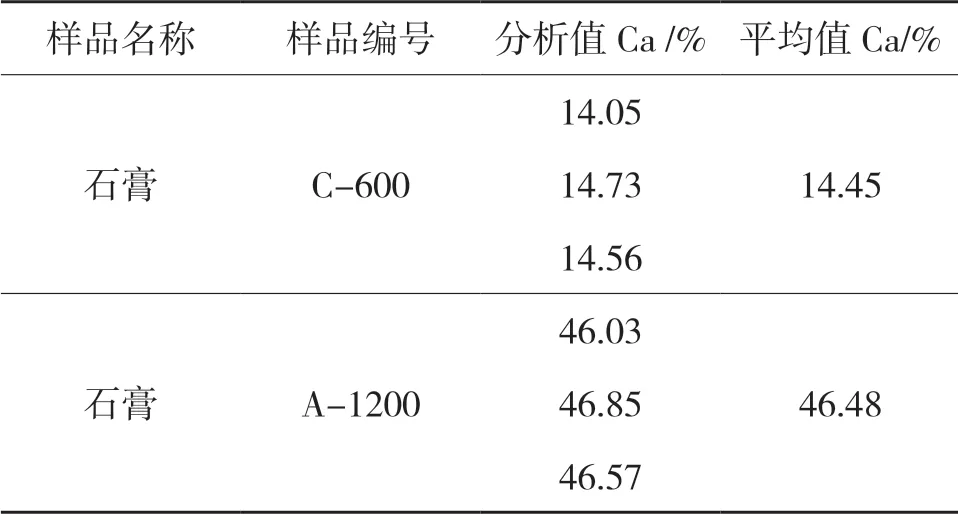
表1 酸法溶解样品试验结果
在溶解过程中可以看到用酸溶解后,烧杯底部仍然有一块不溶物,样品不能溶解完全,测定两个样品中钙含量平均值分别是14.45%和46.48%。
(2)用碱熔法溶解样品。
选取相同两个石膏样品,采用碱熔法溶解样品,称取0.5000g 样品后,加入3g 氢氧化钾,在700℃的高温马弗炉中熔融10min,采用相同试验方法测得的结果如表2。

表2 碱熔法溶解样品试验结果
试验结果可以看到采用碱熔法样品能完全溶解,采用碱熔法熔解的样品,不仅测出的钙分析值的极差较小,而且分析结果更加稳定[5]。
4.2 氢氧化钾加入量试验
称取8 杯C-600 样品各0.5000g,加入不同量的氢氧化钾,采用碱熔法溶解试样所测得的结果如表3。
从表3 中可以看出,氢氧化钾加入量小于3.0g时样品溶解不完全,测定结果偏低,当大于等于3g 后样品溶解完全,测定结果较稳定,但加入量过多会造成试剂浪费,且在出炉浸取时碱量越多越剧烈,容易引起样品飞溅,因此最佳氢氧化钾加入量为约3g。

表3 氢氧化钾加入量试验
4.3 碱熔熔融温度试验
取相同8 个脱好水的样品放入马弗炉中,我们将马弗炉温度设定为400℃、500℃、600℃、650℃、700℃、750℃、800℃、900℃,通过实验测出石膏中钙含量,结果见表4。
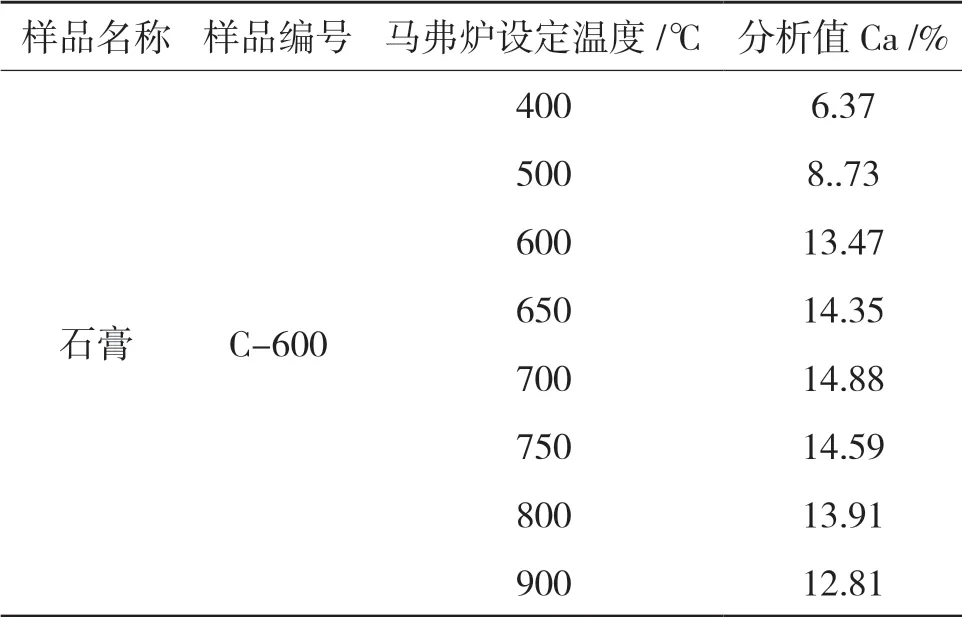
表4 碱熔熔融温度试验
试验结果可以看出马弗炉温度在700℃时,结果最佳。温度过低,样品不能溶解完全,温度过高时会造成样品飞溅,造成样品损失。
4.4 碱熔熔融时间试验
取同样6 个样品进700℃马弗炉,分别保温5min,10min,15min,20min, 25min, 30min,测定石膏中钙含量,结果见表5。
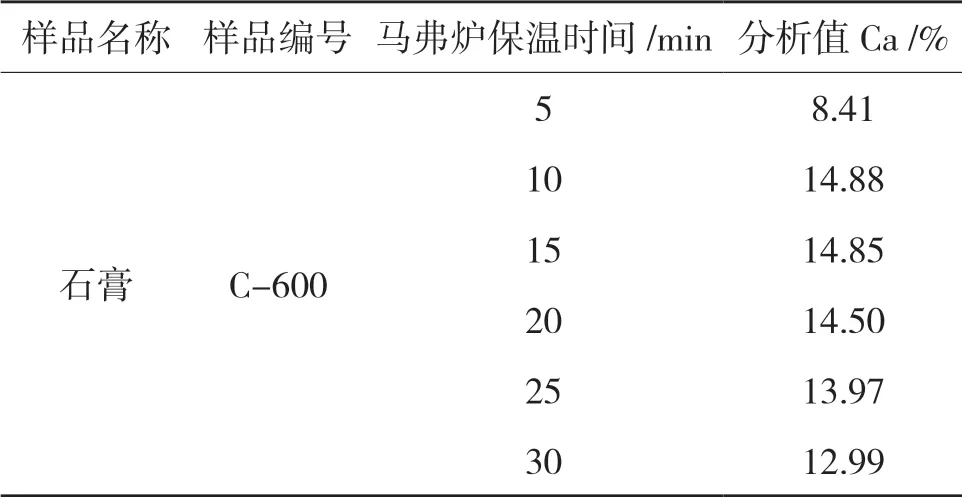
表5 碱熔熔融时间试验
结果表明样品在700℃马弗炉中保温时间过短,样品反应不充分,若时间过长样品蒸干,造成结果损失,因此在700℃马弗炉中样品的最佳时间为10 min ~15min。
4.5 草酸钙沉淀酸度试验
取0.5000gC-600 石膏样品,分取试样体积、沉淀剂量均已确定的情况下,讨论溶液的pH 值对结果的影响,如表6 所示。

表6 溶液pH 值对钙含量测定的影响
从上述试验数据可以看出:溶液的酸度对结果有明显的影响,溶液的pH 值应控制在3.5 到4.5 之间,若酸度过高一方面受酸效应影响,沉淀不完全;另一方面会使H2C2O4分解。酸度过低,KMnO4会分解成MnO2。
4.6 滴定温度试验
在同等条件下,0.5000gC-600 石膏样品,做滴定温度确定实验。温度对钙含量影响如表7。
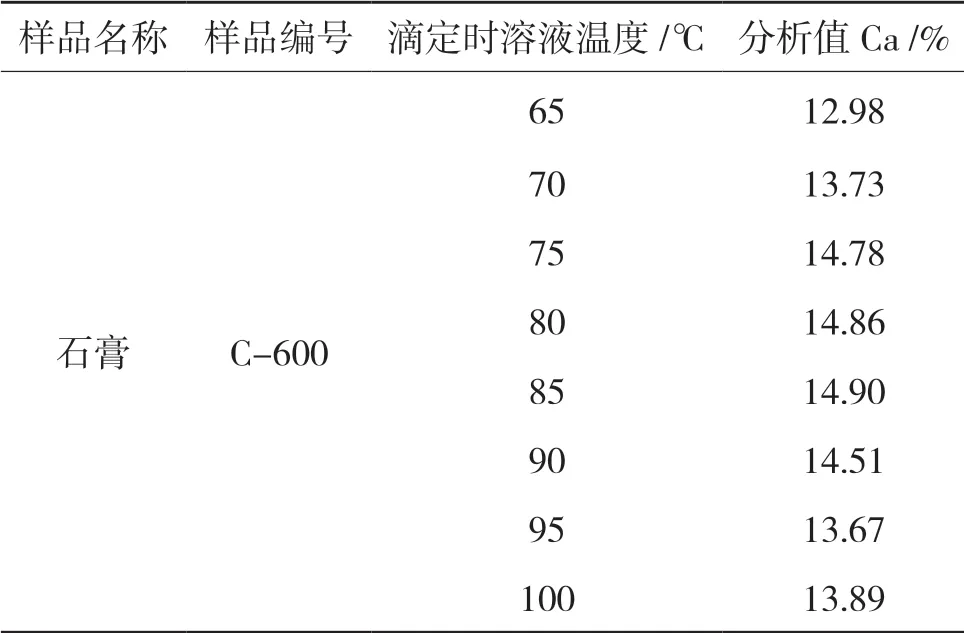
表7 滴定温度对测定结果的影响
从表7 中可以看出最佳滴定温度控制在75℃~85℃之间,若温度低,反应速度缓慢,会引起度数误差,若温度高于90℃,草酸会分解,导致结果偏低。
4.7 精密度实验
选取2 组实验样品分别进行精密度实验、准确度实验和标准加入实验,两个样品的钙含量分别为:C-600 样品中钙含量14%,A-1200 样品中钙含量47%。
选用2 个实验样品采用上述方法进行比较,结果见表8。定值为管理样品值。

表8 精密度试验
从表8 可以看出,实验所得结果极差较小,且与标准定值相吻合。精密度好,完全能够满足分析要求。
4.8 准确度实验
选用C-600 样品和A-1200 样品进行准确度实验结果见表9。
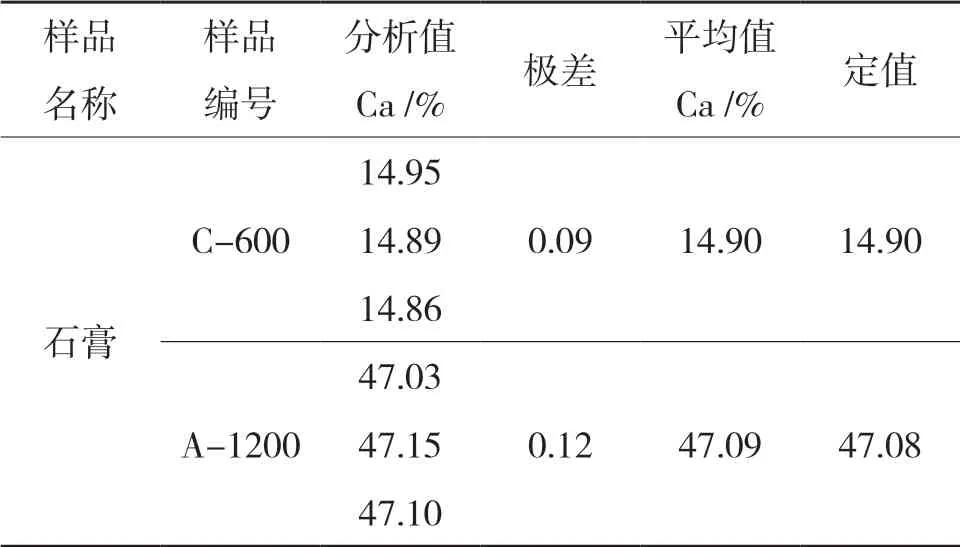
表9 准确度试验
由表9 可以看出,实验所得最终结果极差小且与标准方法定值接近,说明该方法准确度高。
4.9 加标回收率试验
称取三杯样品0.5000g,进一步做了加标回收实验,实验数据如表10。

表10 加标回收试验
从表10 可以看出:此方法回收率为99.00%~100.06%,一般认为实验方法的回收率为99.00%~101.00%之间为可靠数据,从而进一步说明采用此方法满足检测要求,数据准确可靠[6]。
5 结论
石膏通过以上碱熔时氢氧化钾的加入量、熔融时的最佳温度和熔融时间等条件试验,表明该方法能够准确的测定含量在10%~50%左右的石膏,该方法精密度好,准确度高、快速简便等。
