胆囊癌组织多个肿瘤相关基因甲基化的检测及其意义
2019-01-30孔雷徐瑞云吴庆华李能平秦建民杨华丽
孔雷,徐瑞云,吴庆华,李能平,秦建民,杨华丽
(1.上海交通大学医学院附属瑞金医院北院 普外科,上海 201821;2.上海东方肝胆外科医院安亭新院 普外科,上海 201805;3.上海市第四人民医院 超声科,上海 200081)
胆囊癌(gallbladder cancer,GC)是胆道恶性肿瘤中一种主要类型,约占胆道恶性肿瘤的1/2左右。GC的临床特点是恶性度高、预后很差,确诊时大多数病例处于晚期。早期发现、手术治疗是GC的有效治疗手段,放化疗等均无明显疗效。GC的发病机制尚不明确,胆囊结石、腺瘤、胆囊腺肌症等与GC的发病密切相关[1]。GC的临床诊断多借助于影像学检查,还没有一种简便可靠的特异性的肿瘤学标记物可以应用[2-4]。研究表明,甲基化修饰是一种表观遗传学的修饰方式,肿瘤相关基因异常甲基化,特别是抑癌基因,在肿瘤的发生、进展中起重要作用。相比其他胃肠道肿瘤甲基化研究,胆囊癌的相关报道相对较少[4]。本研究通过检测多个肿瘤相关基因在胆囊癌中的甲基化状态,分析其与临床病理学特征的关系,探讨基因异常甲基化在GC发病机制中的作用。
1 材料和方法
1.1 研究对象及组织标本
选取2014年1月至2017年12月上海交通大学医学院附属瑞金医院北院普外科行GC切除术患者的组织学标本。21例GC患者,其中男8例,女13例;平均年龄(59.6±7.1)岁(41~78岁)。Nevin分期:I期1例,II期2例,III期6例,IV期7例,V期5例。病理分级:中低分化19例,高分化2例。组织学分型:腺癌15例,鳞癌2例,腺鳞癌4例;淋巴结转移12例。另外随机选取同期20例慢性胆囊炎标本作为对照组,其中男8例,女12例;平均年龄(55.1±8.5)岁(36~81岁)。两组患者的性别、年龄等一般情况相比较,差异均无统计学意义(表1)。所有组织标本取材后立即放入液氮中保存,随后置入-80 ℃冰箱保存。另取部分组织进行病理学检查。
1.2 方法
1.2.1 胆囊组织基因组DNA提取、甲基化水平检测:采用QIAamp DNA Mini Kit试剂盒提取胆囊组织基因组DNA。UV 3000紫外分光光度仪检测基因组DNA浓度和纯度。使用Methylamp Global DNA Methylation Quantification Ulrta Kit试剂盒检测基因组总甲基化水平。根据说明书要求,纯化的200 ng组织DNA经过孵育、漂洗后,甲基化的DNA与其特异性的抗体结合后,采用BIO-RAD680酶标仪读取样本在450 nm处的吸光度值并计算基因组甲基化水平。
1.2.2 胆囊组织基因组DNA亚硫酸盐修饰:紫外分光光度仪检测基因组DNA浓度和纯度后,OD260/OD280比值处于1.8~2.0之间的样本DNA用于甲基化修饰。采用Intergen CpGenome DNA modification kit甲基化修饰试剂盒进行基因组DNA亚硫酸盐修饰。DNA经过NaOH变性、亚硫酸盐修饰、50 ℃水浴避光过夜。经过修饰后的基因组DNA,甲基化的胞嘧啶保持不变;而未甲基化的胞嘧啶转变为尿嘧啶,在PCR反应中扩增为T,而5-mC不变。根据说明书要求,取基因组DNA 500 ng,用PCR级去离子水稀释至20 μL,然后加入130 μL CT转化剂,经过孵育、脱硫、洗脱等步骤后,亚硫酸盐修饰后的基因组DNA置于-80 ℃冰箱保存,用于甲基化特异性PCR反应。
1.2.3 甲基化特异性PCR(MSP)检测:针对细胞周期依赖性蛋白激酶抑制基因P16、细胞周期依赖性蛋白激酶抑制基因P15、人DNA错配修复蛋白基因(hMLH1)、APC基因、PTEN基因和RUNX3基因启动子转录调控区域设计PCR引物。分别采用甲基化和非甲基化引物进行PCR扩增。甲基化特异性PCR反应体系为25 μL,包括修饰完毕的基因组DNA 2 μL、上下游引物各1 μL、1×PCR buffer II(Perkin-Elmer)、1 IU AmpliTaq Gold polymerase (Perkin-Elmer)、2 mmol/L MgCl、0.25 mmol/L Dntp。MSP循环条件:95 ℃预变性10 min,然后95 ℃变性30 s,特定温度退火45 s,72 ℃延伸45 s,最后72 ℃延伸7 min,共40个扩增循环。为了保证实验结果的可靠性,体外甲基化DNA(in vitro methylated DNA,Intergen)作为阳性对照,不含DNA的蒸馏水作为阴性对照。反应结束后取10 μL PCR产物,利用12%非变性聚丙烯酰胺凝胶电泳,EB染色,于紫外灯下观察分析结果。为确保结果的准确性,所有实验均重复检测。
1.3 统计学分析
应用SPSS 17.0软件包进行统计学处理,计数资料两组间的比较采用χ2检验,P< 0.05为差异具有统计学意义。
2 结果
2.1 基因甲基化与临床病理特征的关系
6个基因的甲基化状态与患者的性别、年龄、组织学类型、病理分级及Nevin分期均无相关性(P>0.05) (表1)。P16基因的甲基化状态与淋巴结转移有相关性(P< 0.05),其余五个基因与淋巴结转移无相关性(表1)。
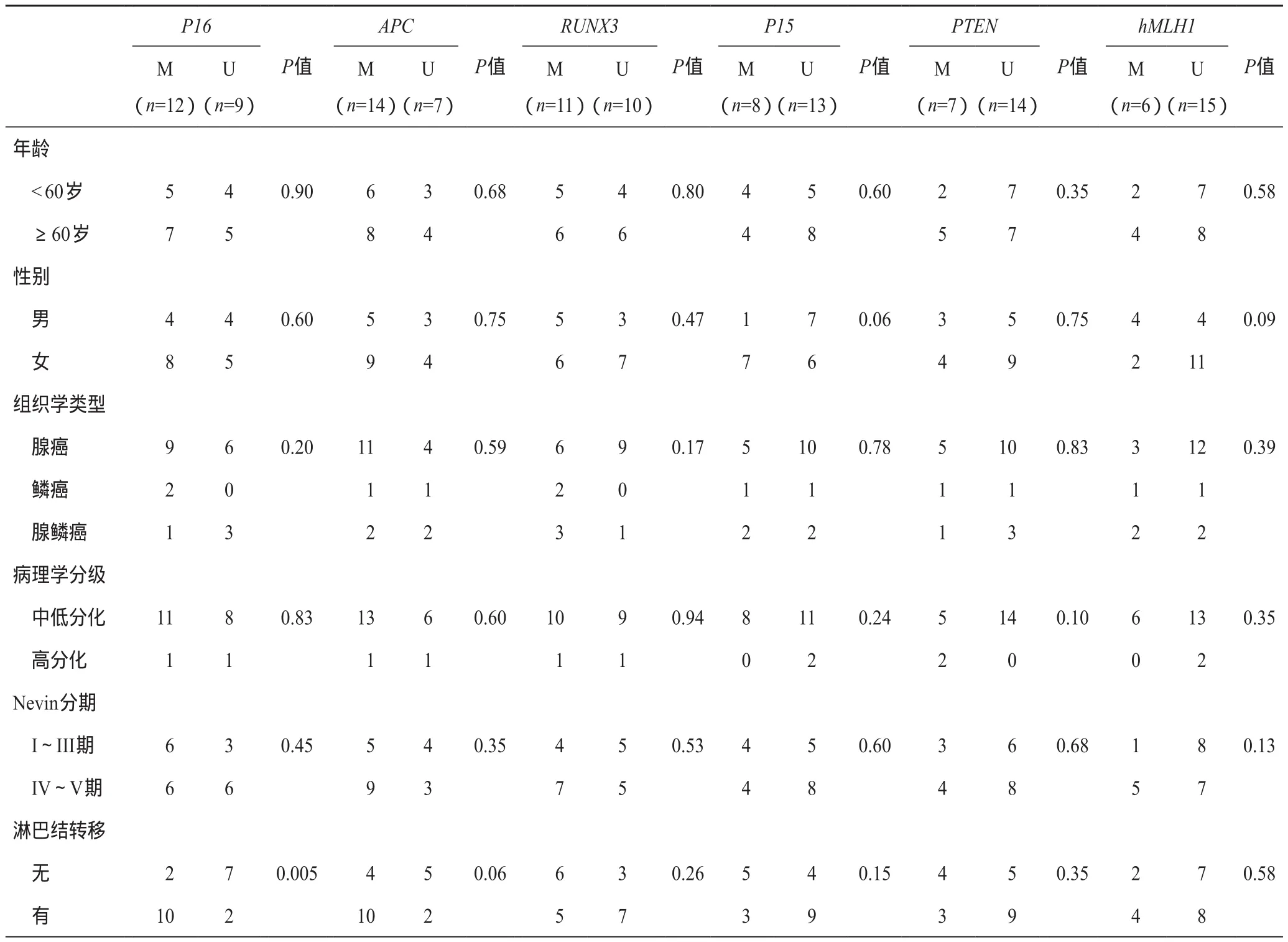
表1 胆囊癌组织异常甲基化与临床病理特征的关系 (例)
2.2 胆囊癌组织和慢性胆囊炎组织基因组总甲基化水平检测结果
GC组织基因组总甲基化水平[(4.1±0.8)%]明显低于慢性胆囊炎基因组总甲基化水平[(6.8±1.2)%],差异具有统计学意义(P< 0.05)。
2.3 甲基化特异性PCR(MSP)检测结果
检测结果显示,在21例胆囊癌组织中,均存在异常甲基化状态,其中2例(9.5%)为1个基因甲基化,8例(38.1%)为2个基因同时存在甲基化,6例(28.6%)为3个基因同时存在甲基化,3例(14.3%)为4个基因同时存在甲基化,2例(9.5%)为5个基因同时存在甲基化。
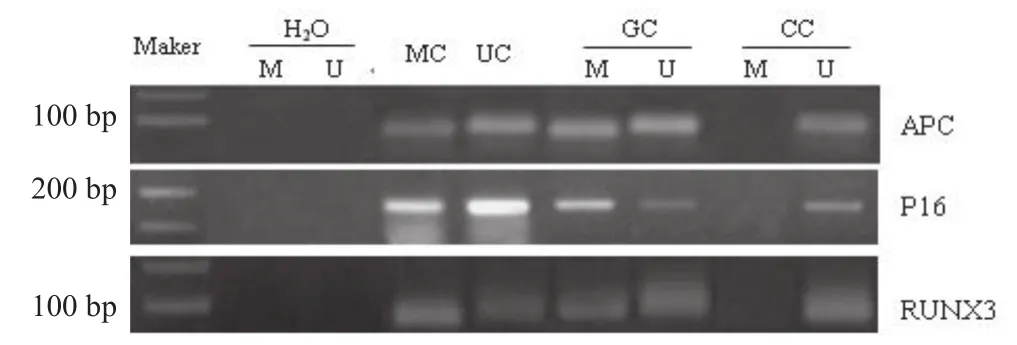
图1 胆囊癌组织基因甲基化特异性PCR产物电泳分析
在6个基因中,GC组织甲基化率较高的3个基因APC、P16和RUNX3分别为14例(66.7%)、12例(57.1%)和11例(52.4%) (电泳结果,图1),明显高于另外3个基因P15、PTEN和hMLH1在GC组织中的甲基化率分别为8例(38.1%)、7例(33.3%)和6例(28.6%)(P< 0.05)。20例慢性胆囊炎组织仅有2例发生单个且均为不同基因(分别为P15和PTEN基因)的甲基化。GC组与慢性胆囊炎组两者之间甲基化率具有明显差异(P< 0.05)。
3 讨论
DNA异常甲基化包括基因组整体的低甲基化以及特定区域的高甲基化,前者引发基因突变频率增加;后者可破坏基因组正常的甲基化程序、干扰基因正常表达,导致细胞增值失控,促进肿瘤的发生发展。在临床上,GC一经诊断绝大多数患者处于晚期,预后极差。相比肝癌和胃肠道肿瘤,GC还没有一种特异性的和针对性的肿瘤学标记物可以应用于GC的诊断和治疗[5]。DNA的异常甲基化通常发生在肿瘤显著恶性表型出现之前,故其检验可预测肿瘤的发生,具有临床应用价值[6]。
在基因组整体低甲基化状态下,通过5-mC的自发性脱氨和增加外来致癌物的亲和力等方式,导致基因不稳定、突变频率增加。在其他实体性肿瘤中,基因组总甲基化水平降低是普遍现象。本研究显示,GC的基因组总甲基化水平显著低于慢性胆囊炎,与前述结论一致。因此,有学者建议把基因组的总甲基化水平作为一种生物学标记物用于肿瘤的筛查和预后判断[7-9]。
初期的GC甲基化研究局限于单个抑癌基因的异常甲基化,如P16、PTEN、APC等[10-12]。Ueki等[13]报道中国人群P16基因异常甲基化率为14.8%(8/54)。Tozawa等[14]报道日本人群P16基因异常甲基化率为22.2%(2/9)。然而,另有学者报道P16基因异常甲基化率为56%[15]。在本研究中P16基因的甲基化率为57.1%,这表明,在GC甲基化研究中,即使同一种基因,不同学者报道的甲基化率也存在显著差异。随着研究的深入,单个基因的研究无法准确、全面的分析甲基化在GC发病机制中的作用。学者们发现多基因的联合检测相对于单基因的检测,可以明显提高检测的特异性和敏感性[16]。Hanse等[17]在胆道肿瘤组织中发现了多种异常表达的基因,开启了GC的多基因研究。Takahashi等[18]研究了24种抑癌基因在GC和慢性胆囊炎患者胆囊组织中异常甲基化情况,在GC患者中表现为高甲基化率的前6位的基因依次为:SHP1(80%)、3-OST-2(72%)、CDH13(44%)、P15 INK4B(44%)、CDH1(38%)、RUNX3(32%),GC组平均甲基化指数明显高于慢性胆囊炎组。该研究提示抑癌基因的异常甲基化是GC发病机制中的一个早期事件,而且存在多个基因的异常甲基化。
我们参考文献中有关胆囊癌基因甲基化率的报道,选择了APC等六个基因作为研究对象,这六个基因均与消化系肿瘤密切相关[13,15,18]。其中,APC基因是重要的Wnt信号途径抑制因子,异常甲基化的APC基因会导致启动增殖的相关基因的异常转录;P16基因调控细胞周期,调节细胞的分裂和增值。在本研究中,21例GC患者中,有19例(90.5%)GC可以检测到至少2个以上基因的甲基化。在6个基因中,APC、P16和RUNX3三种基因的甲基化率相对较高,推测该3种基因的甲基化所导致的基因失活促进了GC的发生与进展。6个基因的甲基化状态与患者的性别、年龄、组织学类型以及病理学分期等临床特征均无相关性。但是,P16基因的甲基化状态与淋巴结转移有显著相关性,而其余五个基因无相关性。在文献中,关于基因异常甲基化与胆囊癌的组织学类型、病理分期、淋巴结转移等是否相关还存在较大差异。House等[15]报道了6种候选抑癌基因在GC中的异常甲基化率高达72%,最高的前3种基因分别是P16、P73、APC;异常甲基化存在国家地域之间的区别,提示多个基因异常甲基化在GC中是一个普遍、频繁的事件。在文献报道中,同一种抑癌基因以及多种抑癌基因甲基化率存在较多差别,究其原因,与检测方法的灵敏性、准确性有关,与GC的病理学类型、临床分期有关,同时也与种族差异、人群分布密切相关[19]。我们认为探讨甲基化与GC临床特征的关系还需要更大的临床样本、更多的相关基因及多中心研究。
总之,在表观基因组水平制定GC完整的DNA异常甲基化变化图谱并提供高效的肿瘤相关基因来检测GC,探索其表观遗传学机制,同时将甲基化与基因沉默途径、基因印记、性别、年龄、病理学类型及分期等综合分析,是进一步努力的方向。
