加替沙星和司帕沙星的光动力抗菌研究
2019-01-30李圩田王佳雯洪阁毛丽娜刘天军
李圩田 王佳雯 洪阁 毛丽娜 刘天军,*
(1 中国医学科学院 北京协和医学院生物医学工程研究所,天津 300192;2 天津中医药大学,天津 300193)
光动力抗菌化学疗法(photodynamic antimicrobial chemotherapy, PACT)[1]是一种新型的物理化学细菌灭活方法,目前已经成为针对细菌、真菌和病毒感染特别是耐药菌感染最有前途的新的治疗方式之一[2-4],其关键是光敏剂。光敏剂[5]是一类具有光吸收能力强、较高的三线态转移效率,可与氧通过能量转移作用产生活性氧的化合物。它可以选择性地富集在特定的组织,在可见光或紫外光的激发下,产生光动力杀伤作用,从而起到杀菌的功效。并非所有的光敏剂具有抗菌活性,只有光敏剂进入细菌内部才能通过光动力杀菌。喹诺酮类药物[6-8]作为抗菌药物已经被广泛应用,它的抗菌机制是通过选择性地抑制细菌DNA促旋酶起到抑菌杀菌作用,然而临床数据揭示其抗菌效果的同时其光敏毒副作用常被提及,那么喹诺酮类药物是否真的有光敏抗菌活性?若有将会是一件好事,尤其在细菌耐药性[9-12]的报道日益增多的今天。本文将以临床用药GFLX和SPFX为例探索喹诺酮类化合物的光敏抗菌活性。
1 实验部分
1.1 材料与试剂
GFLX购于上海毕得医药科技有限公司;SPFX购于源叶生物公司,以上化合物纯度均≥98%;二甲基亚砜购于Sigma(美国);胰蛋白胨、酵母提取物、琼脂均购于Oxoid(英国);氯化钠购于天津市江天化工技术有限责任公司,肉汤培养基用相应试剂由本实验室配制。
1.2 主要仪器与设备
超净工作台(SW-CJ-IFD苏州);激光器(7404 Intense,美国);Maisheng Dc Power Supply(MP6010D,中国);多功能酶标仪(Thermo 3001,美国);离心机(MIRRO22,英国);Millipore 纯水仪(Mili-Q Biocel,美国);细菌培养箱(SANY,日本);立式高温高压灭菌锅(MJ-78A 杭州汇尔仪器设备有限公司);恒温培养振荡器(ZWY-103B,上海智诚)。
1.3 实验菌株
本实验所用MRSA(临床分离菌株)作为革兰阳性菌的代表,P. aeruginosa(临床分离菌株),E. coli(临床分离提取)作为革兰阴性菌的代表,均来自解放军304医院。
1.4 细菌的培养
1.4.1 液体培养基的配置
蛋白胨5g、酵母提取物2.5g、氯化钠5g、蒸馏水500mL搅拌溶解,经121℃高压灭菌30min后,在0~4℃冷暗处备用。
1.4.2 固体培养基配置
琼脂粉7.5g、蛋白胨5g、酵母提取物2.5g、氯化钠5g、蒸馏水500mL搅拌溶解经121℃高压灭菌30min后,放冷后,在无菌超净工作台上,将混合溶液倒入固体培养基,每个培养基大约是15~20mL,使之均匀分布,待冷却后,将其放入冰箱中储存备用。
1.5 喹诺酮类化合物的的紫外吸光谱研究
分别移取GFLX、SPFX的母液50μL置于不同的5mL容量瓶中,各自用0.01mol/L的盐酸溶液定容至5mL并超声分散,分别得到相应浓度为0.01mmol/L的GFLX、SPFX化合物待测液。各待测液室温静置,在波长200~700nm范围内进行紫外光谱扫描,并选择其合适的光照波长。
1.6 照射光波长的影响
光源:650nm激光器, 450nm LED,365nm LED,白光来源于日光灯。实验前所有光源的光功率经过功率计核准。用LB液体培养基,通过二倍浓度稀释法将药物配置成相应梯度浓度,37℃下与菌液(106CFU/mL)在暗处孵育30min,然后用不同波长的光照射(650nm、450nm、365nm,白光),光照功率均为1.5mW,光照时间30min作为光毒组(暗毒组不进行光照),通过测定GFLX、SPFX化合物的MIC与MBC,评价其光动力抗菌活性与有效工作波长。
首先,在37℃无菌摇床条件下避光孵育30min,然后在相应光照条件下光照30min(暗毒组,不进行光照)。然后,分别吸取100μL该96孔微量测试板中不同梯度浓度药物和细菌的混合液,将混合液均匀涂布在LB固体培养基上。随后,将LB固体培养基在37℃培养箱条件下避光孵育,24h后评估,菌落数与对照组相比明显减少且空白组没有菌落生长为MIC,菌落个数小于等于5的为MBC。MIC、MBC的数值越小说明药物的抗菌活性越好。
MIC和MBC的测量方法具体如下:以GFLX为例子。首先在96孔平底板中,分别向每个孔中加入180μL不同梯度浓度的GFLX和20μL的MRSA并混合均匀。空白组为200μL的液体培养基,对照组为180μL的LB液体培养基和20μL的MRSA混合液,进行了3组独立实验。首先,在37℃无菌摇床条件下避光孵育30min,然后在相应光照条件下光照30min(暗毒组,不进行光照)。然后,分别吸取100μL该96孔微量测试板中不同梯度浓度药物和细菌的混合液,将混合液均匀涂布在LB固体培养基上。随后,将LB固体培养基在37℃培养箱条件下避光孵育,24h后评估,菌落数与对照组相比明显减少且空白组没有菌落生长为MIC,菌落个数小于等于5的为MBC。MIC、MBC的数值越小说明药物的抗菌活性越好。
1.7 SPFX、GFLX单线态氧的测定
据文献报道[13-15],喹诺酮类化合物可以产生多种活性氧物质,包括1O2、O2-、OH-等其中单线态氧在人体中有非常重要的化学反应活性。我们基于文献方法[16-18],以1,3-二苯基异苯并呋喃(DPBF)作为单线态氧捕获剂,测定了SPFX、GFLX在的单线态氧产生效率。
具体步骤为:(1)分别配置好0.02mmol/L DPBF和相应药物;(2)将配置好的药物(100μL)和DPBF(100μL)混合,并设计两个对照组;(3)光照单独对DPBF的消耗影响及对药物的影响,以及光照对DPBF与药物混合溶剂影响;(4)检测不同光照时间对DPBF在410nm处吸收光度值影响。
1.8 光照功率的影响
1.8.1 GFLX抗菌MIC、MBC值的能量依赖性
用LB液体培养基,通过二倍浓度稀释法将药物配置成相应梯度浓度,37℃下与菌液(106CFU/mL)暗孵育30min,选用450nm的光,在1.5、3、4.5和6mW等不同功率下,分别光照30min,测定GFLX的MIC与MBC,评价喹诺酮类化合物的光动力抗菌活性,选择合适的光照功率。
1.8.2 GFLX在MIC值处不同光能量密度对MRSA的PACT作用
取对数生长期的MRSA细菌,进行离心,并用PBS洗菌,然后重悬细菌,用紫外分光光度计测定其A值,直到A600=0.7,然后稀释菌液10倍,取稀释的菌液100μL,和配置好的GFLX溶液100μL,使得混合后药物浓度为0.62μg/mL。37℃下,在96孔板暗孵育30min。用450nm LED灯照射,光照能量密度分别为1、2、4、6和8J/cm2,然后分别吸取不同能量密度下的药物与菌液混合液,进行10倍梯度稀释,分别取稀释度为10-4、10-5、10-6和10-7的药物与菌液的混合液,并迅速涂固体培养基,每个梯度下涂3块板,37℃烘箱下培养,24h后菌落计数。来表征不同激光能量密度对MRSA的PACT作用。
1.9 GFLX、SPFX对3T3细胞毒性
据文献报道[19],研究GFLX、SPFX对3T3细胞毒性是非常有意义的,因此收集对数生长期的3T3细胞,在DMEM(含10%的血清)培养液中以1×104个细胞/孔的密度接种于96孔板中,置于37℃,5% CO2培养箱中培养24h;随后吸出培养液,分别将不同浓度的GFLX和SPFX加入到每孔中,于37℃,5% CO2培养箱中孵育30min。随后将其分组进行光毒性与暗毒性研究。光照组采用波长为650nm的光(P=2.3mW、30min、4J/cm)照射96孔板30min;暗毒组在相同条件下避光30min;随后将光毒性与暗毒性的细胞96孔板分别置于37℃,5% CO2培养箱中孵育24h。然后每孔中加入50μL MTT溶液(1mg/mL),于37℃,5% CO2培养箱中作用4h。除去上清液,每孔中加入DMSO溶液150μL,震荡摇匀,通过酶标仪在570nm波长处检测各孔吸光度(A)值。3T3细胞存活率按以下公式计算:细胞的存活率(%)=给药组A值/对照组的A值×100%。
2 结果与讨论
2.1 GFLX、SPFX的紫外吸光谱研究
图1给出了GFLX、SPFX的吸收光谱,它们在275~300nm处有很强的吸收峰,GFLX在374nm处也有一个较强的紫外吸收峰。全波长光谱对GFLX、SPFX在光照波长选择上有一定的指导作用,因此,在“2.2”项中,本文探讨了365、450、650nm、白光及暗毒组等不同波长条件下GFLX、SPFX的抗菌活性。
2.2 GFLX、SPFX在不同波长光照射下的MIC、MBC值

图1 GFLX、SPFX紫外吸收图谱Fig.1 GFLX, SPFX UV absorption spectrum
由于SPFX药物在365nm有较强的吸收,本研究探讨了SPFX在365nm的光动力灭菌活性,结果表明在365nm光的照下空白对照组的A600=0.4,而暗毒组的A600=0.7,说明365nm处光照已经具有杀菌作用。紫外光(200~400nm)可以独立灭菌,同时对细胞也具有一定的杀伤作用,在此区间进行研究意义不大,因此我们的研究选取可见光区,包括蓝光(450nm),红光(650nm)以及白光(长波混合光)进行研究,尽管在此区间GFLX与SPFX的吸收光子能力较弱且相互间有差异,这会致使其光动力抗菌活性的差异,但研究结果具有一定的借鉴意义。
本文探讨了450nm、650nm和白光等不同光照条件下,SPFX、GFLX对MRSA、P. aeruginosa、E.coli的抗菌活性(表1~2),结果表明,在光照条件下,喹诺酮的抗菌活性的确有一定程度的提高,远优于暗毒组;且用不同波长的光照射,对于同一种细菌其MIC/MBC值均有一定的差别。表1说明GFLX在450nm的光照下其抗菌活性略优于其它光照条件下。由于GFLX为第四代喹诺酮类抗菌药物,为新一代抗菌喹诺酮药物。因此,本文选择450nm处光照条件下进行下近一步深入研究。
2.3 GFLX、SPFX单线态氧测定
图2表明,伴随着光照时间的延长,光照对DPBF的影响与光照对药物SPFX、GFLX产生单线态氧对DPBF的影响趋势一样,说明了光照SPFX、GFLX产生较弱的单线态氧。这与表1~2的实验结果一致,即光照可以增加喹诺酮药物的抗菌活性,但提升有限。
2.4 GFLX抗菌MIC、MBC的值的能量依赖性
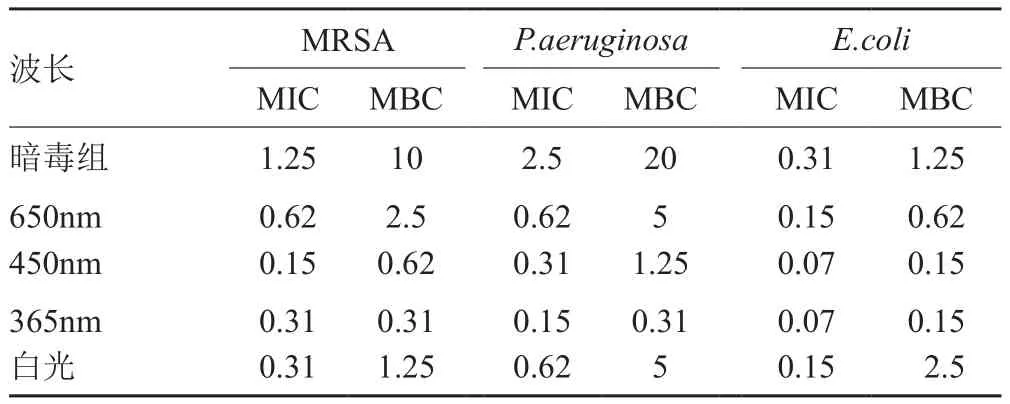
表1 GFLX在不同波长下的抗菌MIC、MBC的值/(μg/mL)Tab. 1 Antibacterial MIC and MBC values of GFLX at different wavelengths/(μg/mL)

表2 SPFX在不同波长下的抗菌MIC、MBC的值/(μg/mL)Tab. 2 Antibacterial MIC and MBC values of SPFX at different wavelengths/(μg/mL)
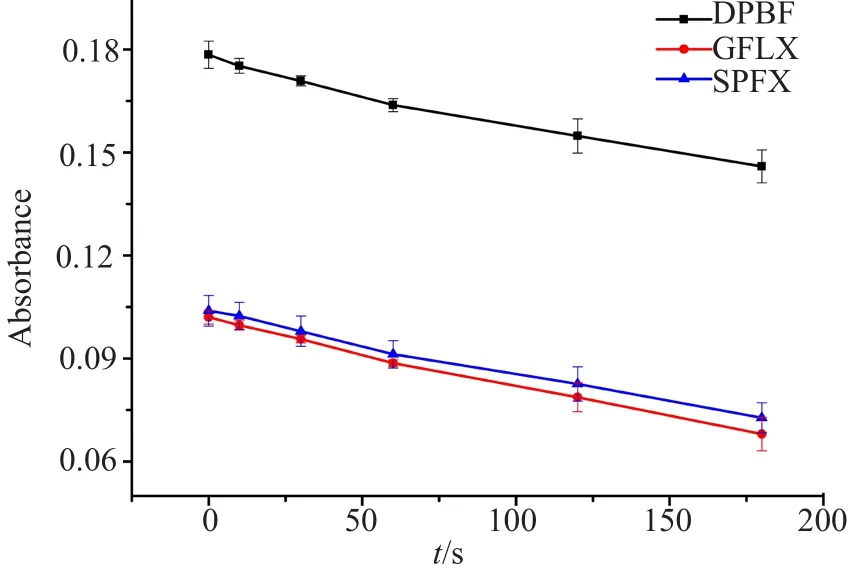
图2 DPBF作为单线态氧捕获剂在不同溶液状态下随时间变化图Fig.2 Graph of DPBF as a singlet oxygen trap over time in different solution states

表3 GFLX在450nm波长下的抗菌MIC和MBC(μg/mL)Tab. 3 Antibacterial MIC and MBC of GFLX at 450nm wavelength(μg/mL)

图3 GFLX在450 nm波长下光稳定性研究Fig.3 Photostability study of GFLX at 450nm wavelength
表3是GFLX在450nm光照射下对于3种细菌的MIC、MBC随着光照能量的变化,结果表明随着光照能量的增大。对于革兰阳性菌MRSA和革兰阴性菌E. coli,其MIC、MBC值都有一定程度的增大,对于革兰阴性菌P. aeruginosa,MIC值略有增加,而MBC总体减小。这与强光敏抗菌药物的行为有很大差异。这种差异可能源于GFLX的浓度减少,然而图3表明GFLX在12J/cm2以内照射光谱变化不大,对于光照保持良好的稳定性,并无光分解,因而药物浓度相对稳定。因而本文认为MIC和MBC的反常变化源于喹诺酮类药物弱的光敏抗菌活性以及光照引起细菌培养液的温度少幅度提升带来细菌的增殖,这进一步表明GFLX不适合光敏抗菌用。
2.5 GFLX在MIC值处不同激光能量密度对MRSA的PACT作用结果
进一步探究光能量密度对于细菌的菌落数量的影响,图4说明了能量密度由2~4J/cm2光照后,细菌存活数量迅速减少,起到了强烈的光动力抗菌活性;随着能量密度的增大,在能量密度为4J/cm2,细菌的菌落数保持一定的数量基本不在减少,这一说明喹诺酮类药物的光动力灭菌效能不高,尽管临床上这类药物有一定的光敏毒副作用,还不足以用于临床杀菌。
2.6 SPFX、GFLX对3T3细胞毒性
图5的MTT结果表明,当GFLX、SPFX药物浓度小于20μg/mL,光照对3T3细胞没有表现出明显的毒性,且光照组与暗毒组没有明显的差异,而药物的抗菌MIC、MBC值远小于20μg/mL,因此,在此条件下光动力抗菌是安全的。

图4 不同光照能量密度对MRSA的PACT作用Fig.4 PACT effects of different light energy densities on MRSA
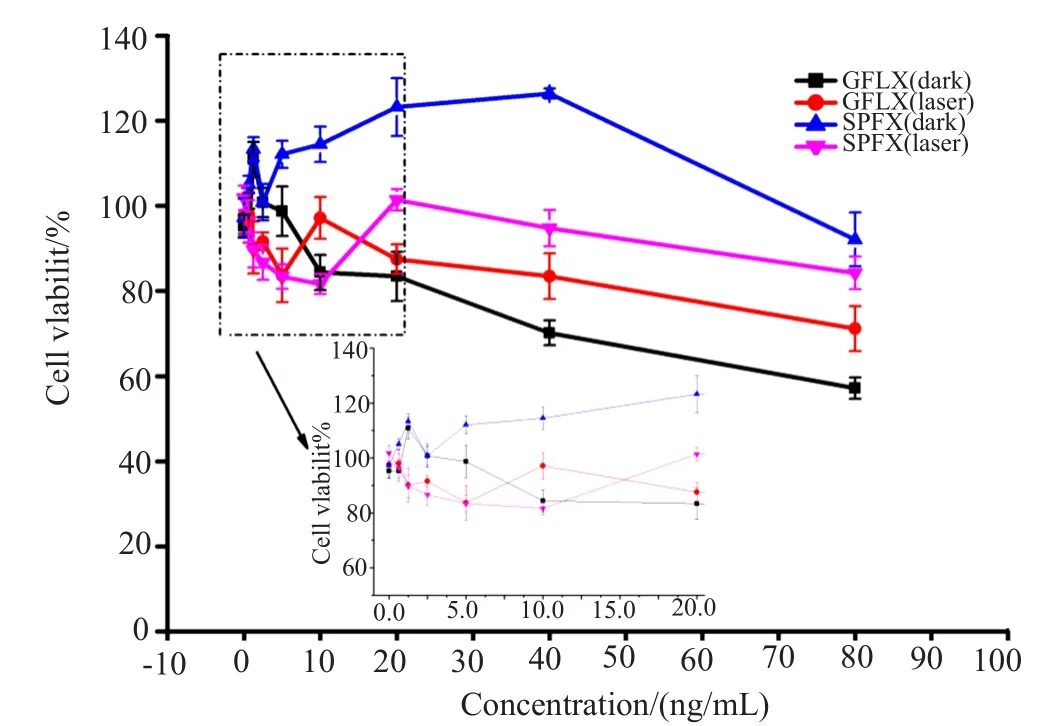
图5 GFLX、SPFX对3T3细胞毒性图Fig.5 GFLX and SPFX to 3T3 cytotoxicity
3 结论
通过SPFX,GFLX对MRSA、P.aeruginosa、E. coli光动力研究,对比了不同光照条件与暗毒组抗菌活性结果,得出光动力手段可以一定程度上增加GFLX和SPFX的抗菌活性,但提升有限,在此区间其光敏毒副作用有限,这类药物不会伤及细胞,因而喹诺酮类药物在临床上不足以作为光敏抗菌药物使用,相对安全。
