西藏绵羊溶血性曼氏杆菌分离鉴定及药敏特性研究
2019-01-30江金欢张丽鸿汪亚苹李奥运张佳露参木有巴桑旺堆李家奎
江金欢,张丽鸿,汪亚苹,李奥运,张佳露,参木有,巴桑旺堆,李家奎,2
(1.华中农业大学动物医学学院,武汉 430070;2.西藏农牧学院动物科技学院,林芝 860000;3.西藏自治区农牧科学院草业科学研究所,拉萨 850009;4.西藏自治区农牧科学院畜牧兽医研究所,拉萨 850000)
溶血性曼氏杆菌(Mannheimia haemolytica)原名溶血性巴氏杆菌,是反刍动物(牛、绵羊)肺炎、新生羔羊急性败血症的病原菌。本属成员原属于巴氏杆菌属。
Angen 等[1]根据DNA 杂交及16S rRNA 序列分析的结果,建议建立一新属,其代表种即为溶血性曼氏杆菌。该菌属于条件致病菌,通常寄生于牛、羊鼻咽部等上呼吸道[2],在受到应激或感染病毒以后,溶血性曼氏杆菌数量增加并下行到肺部,导致急性肺炎[3]。根据溶血性曼氏杆菌荚膜抗原的不同,将其分为12 个荚膜血清型,其中感染牛引起发病的主要为血清1、6 型,感染羊引起发病的主要为血清2 型[1]。溶血性曼氏杆菌在美国、加拿大、澳大利亚、土耳其等多个国家均有报道,给世界牛、羊养殖业带来巨大的经济损失[2-4(]NCBI 网络数据库)。我国吉林、山东、安徽、四川、重庆、云南等多个省市均有牛、羊感染溶血性曼氏杆菌导致死亡的情况,给养殖业带来经济损失[5-7]。
2017 年8 月,西藏山南市某地某农户饲养的绵羊出现大批死亡,为查明其发病原因,本研究采集了病死羊心脏、脾脏、小肠、肺脏、气管等样品,对病原进行分离和鉴定,并对分离菌株的血清型和耐药性进行分析,以查明该病致病病菌,从而为该病的临床诊断和防控提供依据。
1 材料与方法
1.1 临床样品采集
病死绵羊心脏、脾脏、小肠、肺脏、气管等来自西藏山南市某农户。
1.2 主要试剂
血琼脂平板购自青岛海博生物技术有限公司;营养琼脂购自武汉科瑞生物技术有限公司;麦康凯琼脂购自北京陆桥技术有限责任公司;马丁肉汤购自青岛宾得生物技术有限公司;生化反应试剂、药敏纸片均购自杭州微生物试剂有限公司;PCR 试剂、DNA Marker 等均购自杭州新景生物试剂开发有限公司。
1.3 细菌的分离培养
无菌挑取心脏、脾脏、小肠、肺脏、气管,接种于营养琼脂和血琼脂平板上,37 ℃培养24 h。挑取血琼脂平板上露珠样单菌落,转接于血琼脂平板纯化,37 ℃培养24 h。再挑取血琼脂平板上单菌落,转接于血琼脂平板和麦康凯琼脂,37 ℃培养24 h。挑取血琼脂平板上纯化后的菌落,进行瑞氏染色和革兰氏染色镜检,并挑取血琼脂平板上单菌落接种于马丁肉汤中,于37 ℃的空气浴水平摇床(120 r/min)进行增菌培养24 h。
1.4 分离菌株的生化试验
按照生化试剂说明书的方法,将分离株的增菌液取10 μL 接种于葡糖糖、甘露醇、甘露糖、蔗糖、半乳糖、乳糖、血清菊糖、蕈糖、果糖、麦芽糖、鼠李糖生化培养基内,置于37 ℃培养24 h 后,观察其主要生化特性。
1.5 分离菌株16S rDNA 基因序列的扩增与遗传进化分析
用水煮加冰浴的方法提取上述溶血性曼氏杆菌分离菌株的基因组DNA。采用文献[7]的PCR 方法,以16S rDNA 的通用引物进行PCR 扩增,引物序列为5'-AGAGTTTGATCCTGGCTCAG-3'/5'-TACGGCTACCTTGTTACGACTT-3',引物由北京擎科新业生物技术有限公司合成,扩增长度约1 500 bp。PCR 反应体系50 μL:PCR-MIX 25 μL,ddH2O 21 μL,DNA 模板2 μL,上下游引物各1 μL。PCR 反应条件:95 ℃5 min;95 ℃30 s、55 ℃30 s、72 ℃1 min,30 个循环;72 ℃10 min。PCR 扩增产物经2%琼脂糖凝胶电泳检测,PCR 产物由北京擎科新业生物技术有限公司测序。
在NCBI 上利用BLAST 将测序确定的分离株16S rDNA 基因序列同GenBank 数据库中收录的亲缘关系较近的细菌基因序列进行同源性比对,并从GenBank中下载不同国家、不同宿主、不同时间同源性较高的细菌基因序列20 条,采用Mega7.0 软件构建该菌的系统发育树。
1.6 分离菌株荚膜血清型的鉴定
将分离株的基因组DNA 采用Klima 等[8]建立的鉴定该菌株荚膜血清型1、2 和6 的多重PCR 方法进行扩增,分别以Hyp、Core2、TupA为靶基因,引物信息见表1。PCR 反应体系50 μL:PCR-MIX 25 μL,上下游引物3对各0.2 μM,模板DNA 2 μL,补充ddH2O 到50 μL。PCR 反应条件:95℃15 min;94 ℃30 s,55 ℃45 s,72 ℃1 min,35 个循环;72 ℃10 min。PCR 扩增产物经2%琼脂糖凝胶电泳检测。
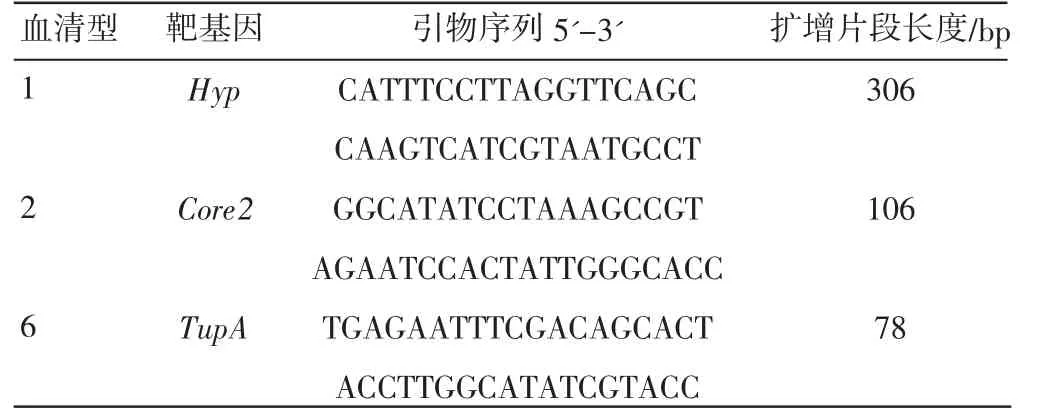
表1 检测溶血性曼氏杆菌荚膜血清型1、2 和6 的特异性引物序列
1.7 分离菌株的药敏试验
按照WHO 推荐的K-B 纸片法挑取分离株进行药敏试验。挑取纯化的单菌落接种于马丁肉汤培养基中,37 ℃培养24 h。取100 μL,用无菌推杆均匀涂布于血琼脂平板,放置药敏片,37 ℃培养24 h。药敏结果判定按照美国临床实验室标准化委员会(NC-CLS)2009 年标准记录进行。
1.8 临床采集样品中分离株的特异PCR 检测和主要毒力基因lktA 基因检测
将纯化后的单菌落接种于马丁肉汤培养基中,37 ℃培养24 h。取2 000 μL,用水煮加冰浴的方法进提取。以其为模板,采用文献[9]建立的特异性检测分离株gcp基因和文献[10]建立的检测lktA毒力基因的PCR 方法进行扩增,gcp引物序列为5'-TGGGCAATACGAACTACTCGGG-3'/5'-CTTTAATCGTATTCGCAG-3',预期扩增片段为227 bp;lktA引物序列为5'-CTTACATTTTAGCCCAACGTG-3'/5'-TAAATTCGCAAGATAACGGG-3',预期扩增片段为497 bp;引物由北京擎科新业生物有限公司合成。PCR 反应体系50 μL:PCR-MIX 25 μL,上下游引物各0.2 μM,DNA 模板2 μL,补充ddH2O 到50 μL。PCR 反应条件:95 ℃5 min;95 ℃30 s,54 ℃30 s,72 ℃30 s,40 个循环;72 ℃10 min。lktA基因PCR 反应条件:95 ℃5 min;95 ℃30 s,52 ℃30 s,72 ℃40 s,40 个循环;72 ℃10 min。PCR 扩增产物经2%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 细菌的分离培养
病料接种于营养琼脂和血琼脂平板上,于37 ℃培养24 h。肺脏、气管接种的血平板长出灰白色、光滑、半透明、露珠样小菌落(图1),营养琼脂上菌落生长贫瘠。挑取血琼脂平板上露珠样单菌落接种于麦康凯琼脂,37 ℃培养24 h,菌落未生长。挑取血琼脂平板纯化后的菌落染色镜检,瑞氏染色可见蓝紫色的球杆菌;革兰氏染色可见两极着色的红色短杆菌,菌体两端钝圆。菌落形态、培养特性、染色特性疑似溶血性曼氏杆菌菌落。
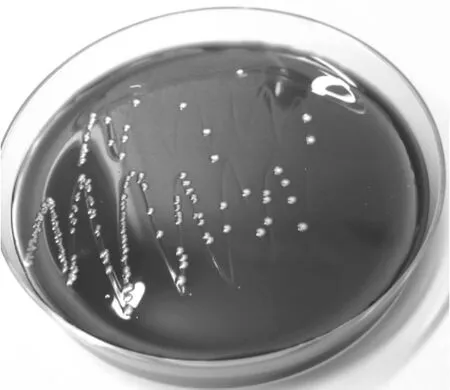
图1 病死羊肺脏挑菌接种血平板分离菌株菌落生长形态
2.2 分离菌株的生化反应特性
将分离菌株的增菌液接种于生化培养基内,检测其生化特性,结果显示该菌株发酵葡萄糖、甘露糖、甘露醇、半乳糖、蔗糖、蕈糖、血清菊糖、果糖、麦芽糖,不发酵乳糖、鼠李糖。生化试验重复3 次,结果一致(表2)。

表2 分离菌株生化特性
2.3 分离株16S rDNA 基因序列扩增与遗传进化分析
以分离菌株的DNA 为模板,利用16S rDNA 的通用引物进行PCR 扩增,扩增产物经琼脂糖凝胶电泳检测,在约1 500 bp 的位置出现条带,与预期目的片段相符(图2);将测序结果与NCBI 上GenBank 网络数据库进行比对,结果显示为溶血性曼氏杆菌。

图2 分离菌株16S rDNA 基因PCR 扩增产物琼脂糖凝胶电泳
将分离菌株的16S rDNA 基因序列与不同国家、不同宿主、不同时间分离株同源性高的溶血性曼氏杆菌16S rDNA 基因序列做系统发育分析,结果显示,分离的溶血性曼氏杆菌与2013 年美国株牛源溶血性曼氏杆菌(CP005972.1)遗传进化关系最近(图3)。进一步证明分离株为溶血性曼氏杆菌。
2.4 溶血性曼氏杆菌分离株荚膜血清型的鉴定结果
以阳性分离株的基因组DNA 为模板,用特异性鉴定溶血性曼氏杆菌荚膜血清型1、2 和6 的PCR 方法进行扩增,结果显示在约160 bp(Core2基因)处扩增出目的条带,证明其为荚膜血清2 型(图4)。本试验重复3 次,结果一致,证明分离的溶血性曼氏杆菌为荚膜血清2 型。
2.5 溶血性曼氏杆菌分离株的药敏试验
挑取溶血性曼氏杆菌分离株进行药敏试验,结果显示,分离的溶血性曼氏杆菌对环丙沙星、四环素、头孢呋辛、诺氟沙星、氟苯尼考、红霉素、氨苄西林、头孢唑林、多西环素、氯霉素、庆大霉素、新生霉素、阿奇霉素、头孢拉定、头孢氨苄、卡那霉素、复方新诺明等17种临床常用抗生素敏感,对头孢曲松、头孢克肟、阿莫西林等3 种药物中度敏感(表3)。
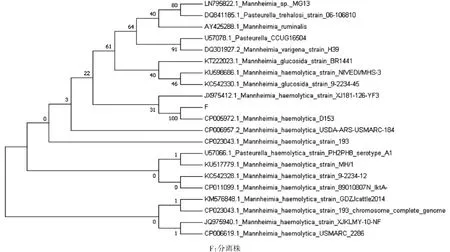
图3 溶血性曼氏杆菌16S rDNA 基因的遗传进化树
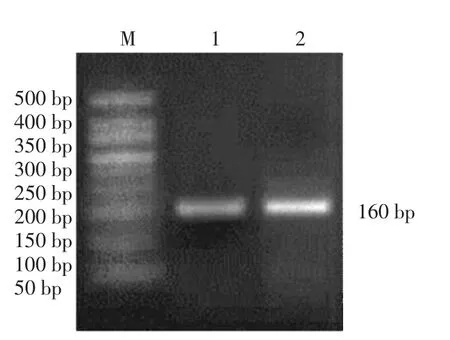
图4 分离的溶血性曼氏杆菌荚膜血清型多重PCR扩增产物琼脂糖凝胶电泳

表3 分离菌株药敏试验结果
2.6 溶血性曼氏杆菌分离株PCR 检测结果
以分离菌株纯化后的单菌落增菌液提取基因组DNA 为模板,利用特异性检测溶血性曼氏杆菌gcp基因的PCR 方法进行扩增,结果显示gcp基因(图5)和lktA毒力基因(图6)均扩增出了目的条带。表明引起该户绵羊死亡的病原为溶血性曼氏杆菌。

图5 分离的溶血性曼氏杆菌gcp 基因PCR 扩增产物琼脂糖凝胶电泳
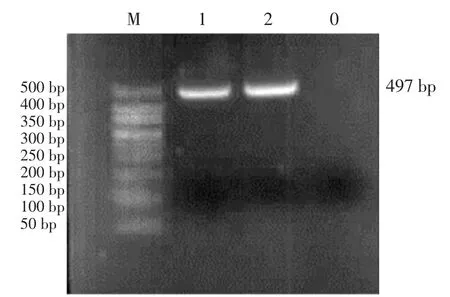
图6 分离的溶血性曼氏杆菌lktA 基因PCR 扩增产物琼脂糖凝胶电泳
3 讨论
本研究在西藏成功分离了溶血性曼氏杆菌,分离株普通琼脂生长贫瘠,基本不生长;血琼脂平板生长良好,菌落特性与溶血性曼氏杆菌菌落特性符合。染色特性为革兰氏阴性两极着色短杆菌,瑞氏染色为蓝紫色球杆菌,与溶血性曼氏杆菌相符。生化特性与文献[1]记载基本相同,不同之处为文献[1]记载,该菌不发酵菊糖和甘露糖,但本试验分离菌株发酵这两种糖类。分析原因可能为该菌分离自高原动物,在氧气稀薄、气候恶劣的环境下,在绵羊体内遗传进化过程中调控某些生化特性的基因发生改变。
目前,GenBank 中登录国内的溶血性曼氏杆菌16S rDNA 基因序列仅有9 条。遗传进化分析结果显示,该试验分离的溶血性曼氏杆菌与美国羊源溶血性曼氏杆菌菌株聚为一支,表明分离株与美国羊源菌株遗传进化关系较近。gcp基因特异性检测溶血性曼氏杆菌为Shanthalingam 等[9]建立的方法,本试验使用该方法准确检测出了分离株,具有较好的特异性。而lktA基因为溶血性曼氏杆菌的毒力基因,并未存在于所有溶血性曼氏杆菌中,溶血性曼氏杆菌的致病性与该基因有关[9]。本试验采用Bavananthasivam 等[10]检测lktA基因的方法检测出分离株存在该基因,以往研究认为该基因与溶血性曼氏杆菌的β-溶血有关,但Bavananthasivam等研究认为,β-溶血可能不是溶血性曼氏杆菌分离株白细胞毒性的可靠指标。本试验分离株具有lktA基因,但溶血性试验发现该菌为γ-溶血,即未见溶血环。
溶血性曼氏杆菌已经确定的血清型为12 个,血清型1、2 和6 在不同宿主间流行较为广泛,也是引起绵羊肺炎较常见血清型[11-12]。不同血清型毒力差别较大,在美国,约60%的病例可分离到6 型菌株[1]。Klima 等[8]建立的检测血清1、2 和6 的多重PCR 方法操作简便,较传统凝集试验节省时间和人力。本试验采用该方法简便、迅速地测出分离株为血清2 型。国内对绵羊溶血性曼氏杆菌血清型流行病学调查较少,而不同血清型毒力差别较大,所以血清型鉴定和流行病学调查对诊断、预防和治疗该疾病均有重要意义。
抗生素是治疗细菌性疾病的主要措施,了解分离株对临床常用抗生素的敏感性有利于在临床爆发溶血性曼氏杆菌疾病时指导用药。据文献记载,该菌在国内外均有报道耐药菌株的出现,其中国外以替米考星、土霉素、氟苯尼考、氯霉素、链霉素、卡那霉素、阿莫西林居多[13],国内以氨苄西林、苯唑西林、头孢氨苄、先锋噻肟、头孢噻吩、头孢呋肟为主[14]。为了筛选出该分离株敏感性药物,本研究采用20 种抗生素对分离株进行药物敏感性试验,结果发现,该分离株对大多数临床常用抗生素均表现敏感或中度敏感,无耐药菌株出现,与文献[6]记载一致。虽然本试验分离的溶血性曼氏杆菌对临床常用抗生素未表现出耐药性,但国内已经出现耐药菌株。其中四川、吉林、安徽、重庆均分离出耐药菌株[5,14],以重庆肉牛溶血性曼氏杆菌分离株尤为明显,对卡那霉素、链霉素、头孢呋肟、庆大霉素、先锋噻肟、头孢噻吩、头孢氨苄、苯咗青霉素、罗红霉素、羧苄青霉素、洛美沙星、氨苄青霉素、青霉素G 等多种临床常用抗生素表现耐药性[7]。本研究结果进一步说明了不同地区分离菌株的耐药性存在差异,同时表明该地区抗生素滥用情况较少。研究结果对该地区治疗绵羊感染溶血性曼氏杆菌用药提供了参考。
