气相色谱-串联质谱法测定肉制品中10种挥发性N-亚硝胺类化合物
2019-01-29朱萌萌周婷婷陈卢涛俞璐萍胡晋峰
朱萌萌, 叶 群, 周婷婷, 陈卢涛, 俞璐萍, 黎 斌, 胡晋峰, 周 敏*
(1. 绿城农科检测技术有限公司, 浙江 杭州 310000; 2. 浙江茗皇天然食品开发股份有限公司, 浙江 杭州 310000; 3. 安徽农业大学茶与食品科技学院, 茶叶生物与利用国家重点实验室, 安徽 合肥 230036)
N-亚硝胺类化合物在食品、饮用水、消费品以及污染的空气中广泛存在,常见于腌制、烟熏、烘烤等肉制品中[1-3]。Yurchenko和Molder[4]对爱沙尼亚2001~2005年间386个不同肉制品样品(原料肉、油炸肉、烟熏肉、腌渍肉、烤肉和罐头肉)进行了5种挥发性N-亚硝胺类化合物的分析,分别检出了N-亚硝基二甲胺(N-nitrosodimethylamine, NDMA)、N-亚硝基二乙胺(N-nitrosodiethylamine, NDEA)、N-亚硝基吡咯烷(N-nitrosopyrrolidine, NPYR)、N-亚硝基哌啶(N-nitrosopiperidine, NPIP)和N-亚硝基二丁胺(N-nitrosodibutylamine, NDBA),总挥发性N-亚硝胺类化合物的平均含量为3.97 μg/kg。肉类产品经烟熏、油炸、焙烤和腌渍等工艺加工和储藏后,会产生独特的风味,并可延长保质期,深受中国消费者的喜爱,但其在加工过程中,会使用硝酸盐和亚硝酸盐作为防腐剂和发色剂,在微生物的作用下蛋白质、氨基酸降解产生胺类物质,适宜条件下,亚硝酸盐与胺类物质发生亚硝基化作用,从而产生具有强致癌性的N-亚硝胺类化合物[5,6]。目前,已有大量研究表明,N-亚硝胺类化合物是一类具有强毒性的化合物,对机体的神经和肾脏具有致畸性和致癌性[7,8],超过300多种N-亚硝胺类化合物在一种或多种动物身上显示出致癌作用[9]。1987年国际癌症研究机构(IARC)将亚硝胺定义为有强致癌性的食物污染物,N-亚硝基二甲胺和N-亚硝基二乙胺被列为2A类致癌物,具有潜在的致癌性,其他亚硝胺为2B级,是可能致癌物。中国一些地区胃癌和食道癌的发病率较高,这可能与当地居民喜欢食用烟熏肉和腌制食品等习惯有关。我国GB 2762-2017标准《食品安全国家标准 食品中污染物限量》中规定肉及肉制品中N-二甲基亚硝胺的限量值为3.0 μg/kg。
近年来,N-亚硝胺类化合物的检测方法主要有气相色谱-热能分析仪法(GC-TEA)[10]、气相色谱-氮磷检测器法(GC-NPD)[11]、气相色谱-质谱法(GC-MS)[12,13]、高效液相色谱法(HPLC)[14]和高效液相色谱-串联质谱法(HPLC-MS/MS)[15,16]。GB 5009.26-2016标准《食品安全国家标准 食品中N-亚硝胺类化合物的测定》中第二法使用GC-TEA对N-二甲基亚硝胺进行测定,方法检出限为0.15 μg/kg,但热能分析仪价格昂贵且专一性极强(仅对含氮化合物具有高选择性),普及面窄,不适合大面积推广使用。高效液相色谱-质谱法可以对非挥发性、相对分子质量较高的亚硝胺具有良好的分析能力,多用于饮用水及污水中非挥发性亚硝胺物质的检测[17]。
前处理方法主要包括液液萃取法、固相微萃取法(SPME)[18,19]、水蒸气蒸馏萃取法、超临界萃取法[20]和QuEChERS等。赵庄等[21]采用QuEChERS结合气相色谱-串联质谱法对酸肉中的10种挥发性亚硝胺化合物进行检测,样品浓缩5倍,定量限为0.1~1.0 μg/kg。而亚硝胺类化合物具有强亲水性和强极性,导致其较难从水相中分离[22],且N-亚硝胺类化合物在肉制品中的含量极低,往往随时间、空间波动较大,需要较高的浓缩倍数来提高方法检出限,最常用的方法是使用水蒸气蒸馏萃取法,可实现样品浓缩100~200倍,但其操作繁琐耗时,前处理步骤多,回收率不稳定。气相色谱-质谱法选择性好、灵敏度高,已广泛用于挥发性亚硝胺类化合物的测定[23]。同时蒸馏萃取法(simultaneous distillation extraction, SDE)与水蒸气蒸馏萃取法相似,在不改变富集倍数的情况下,可实现蒸馏与提取同时进行,具有更好的重复性和萃取率,操作简便,检出限更低,已广泛用于食品尤其是肉类产品中挥发性化合物的提取[24]。
本文拟采用优化后的SDE结合GC-MS/MS,建立一种操作简单、稳定性高、检出限低、灵敏度高的分析方法,用于肉制品中10种挥发性N-亚硝胺类化合物的检测分析。
1 实验部分
1.1 仪器、试剂与材料
GC-2010 plus气相色谱仪、TQ8040质谱仪(日本Shimadzu公司);同时蒸馏萃取装置(泰州市世星教学设备有限公司); ST-16R离心机(美国Thermo Fisher公司); BSA2202S电子天平(德国Sartorius公司); Reeko AutoEVA-20全自动氮吹浓缩仪(杭州博睿科仪器有限公司); HH-WO可升降恒温水浴锅(郑州予创仪器设备有限公司); ZNHW智能恒温数显电热套(上海湃澜仪器设备有限公司); DLSB-5L/10低温冷却液循环泵(巩义市子华仪器有限责任公司);漩涡混合器(美国Henry Troemner公司); KQ5200E超声波清洗器(昆山市超声仪器有限公司)。
无水乙醚和无水硫酸钠(分析纯,国药集团化学试剂有限公司);乙腈(色谱纯,美国Baker公司);试验室所用水均为去离子水。
10种挥发性N-亚硝胺混合标准储备液包括N-亚硝基二甲胺、N-亚硝基乙基甲基胺(N-nitrosoethylmethylamine, NEMA)、NDEA、N-亚硝基二异丙胺(N-nitroso-diisopropylamine, NDiPA)、N-亚硝基二正丙胺(N-nitrosodi-n-propylamine, NDPA)、N-亚硝基二丁胺、N-亚硝基哌啶、N-亚硝基吡咯烷、N-亚硝基吗啉(N-nitrosomorpholine, Nmor)、N-亚硝基二苯胺(N-nitrosodiphenylamine, NDPhA),质量浓度均为1 000 mg/L,购自美国O2Si公司。
火腿肠、中式香肠和腌渍腊肉等肉制品均采自杭州各大超市,每种肉制品均10批,共计30批样品,于-20 ℃保存,待测。
1.2 标准溶液的配制
准确吸取10种挥发性N-亚硝胺类化合物各1.0 mL,置于25 mL容量瓶中,用丙酮定容,配制成40.0 mg/L的标准储备液,于4 ℃冰箱避光保存,有效期6个月;分别移取适量标准储备液,用丙酮稀释,配制成10.0 mg/L和1.0 mg/L的混合标准溶液,于4 ℃冰箱避光保存,有效期3个月。
1.3 样品前处理
1.3.1样品提取
称取200 g(精确至0.1 g)样品,置于1 000 mL圆底烧瓶中,加入少量沸石和100 mL蒸馏水;向三角锥形瓶中加入40 mL无水乙醚,设置加热温度为40 ℃。待样品溶液沸腾后开始计时,同时蒸馏萃取30.0 min。将无水乙醚萃取物转移至装有10 g无水硫酸钠的离心管中,涡旋2.0 min,静置30.0 min,转移上清液至鸡心瓶中,于室温下氮吹至近干,用乙腈洗涤鸡心瓶,将洗涤液转移至5 mL具塞离心管中,用乙腈定容至2.0 mL,密闭,待净化。
1.3.2样品净化
将具塞离心管置于-20 ℃冷冻层中冷冻2.0 h,取出离心管,在4 ℃条件下以8 000 r/min离心3.0 min,过0.22 μm微孔有机滤膜,待气相色谱-串联质谱检测。
1.4 空白基质匹配校准溶液的配制
取200 g样品,置于1 000 mL圆底烧瓶中,加入少量沸石和100 mL蒸馏水,将样品加热至微沸状态并持续30.0 min,再按1.3节方法处理后上机分析,经检测,处理后的样品中无10种挥发性N-亚硝胺类化合物。将微沸30.0 min处理后的样品过滤并晾干,作为空白基质样品。
取空白基质样品,按1.3节方法进行提取净化,得到空白基质溶液。取适量10种挥发性N-亚硝胺类化合物混合标准溶液,用空白基质溶液稀释,配制成1.0、5.0、10.0、50.0、100、500、1 000 μg/L的系列空白基质匹配校准溶液,现用现配。
1.5 分析条件
1.5.1色谱条件
色谱柱:DB-WAX色谱柱(30 m×0.25 mm×0.25 μm);进样口温度:220 ℃;载气:高纯氦气;碰撞气:高纯氩气,纯度≥99.999%;柱流量:1.5 mL/min;进样方式:不分流进样,1.0 min后开阀;升温程序:初始温度36 ℃,保持1.0 min,以8 ℃/min的速率升至150 ℃,以40 ℃/min的速率升至230 ℃,保持6.0 min;进样量:1.0 μL。
1.5.2质谱条件
离子源:EI源;离子源温度:230 ℃;电离能量:70 eV;接口温度:230 ℃;检测器电压:1.40 kV;测定方式:多反应监测(MRM)模式。10种挥发性N-亚硝胺类化合物的保留时间、定性、定量离子和碰撞能量(CE)等参数见表1。
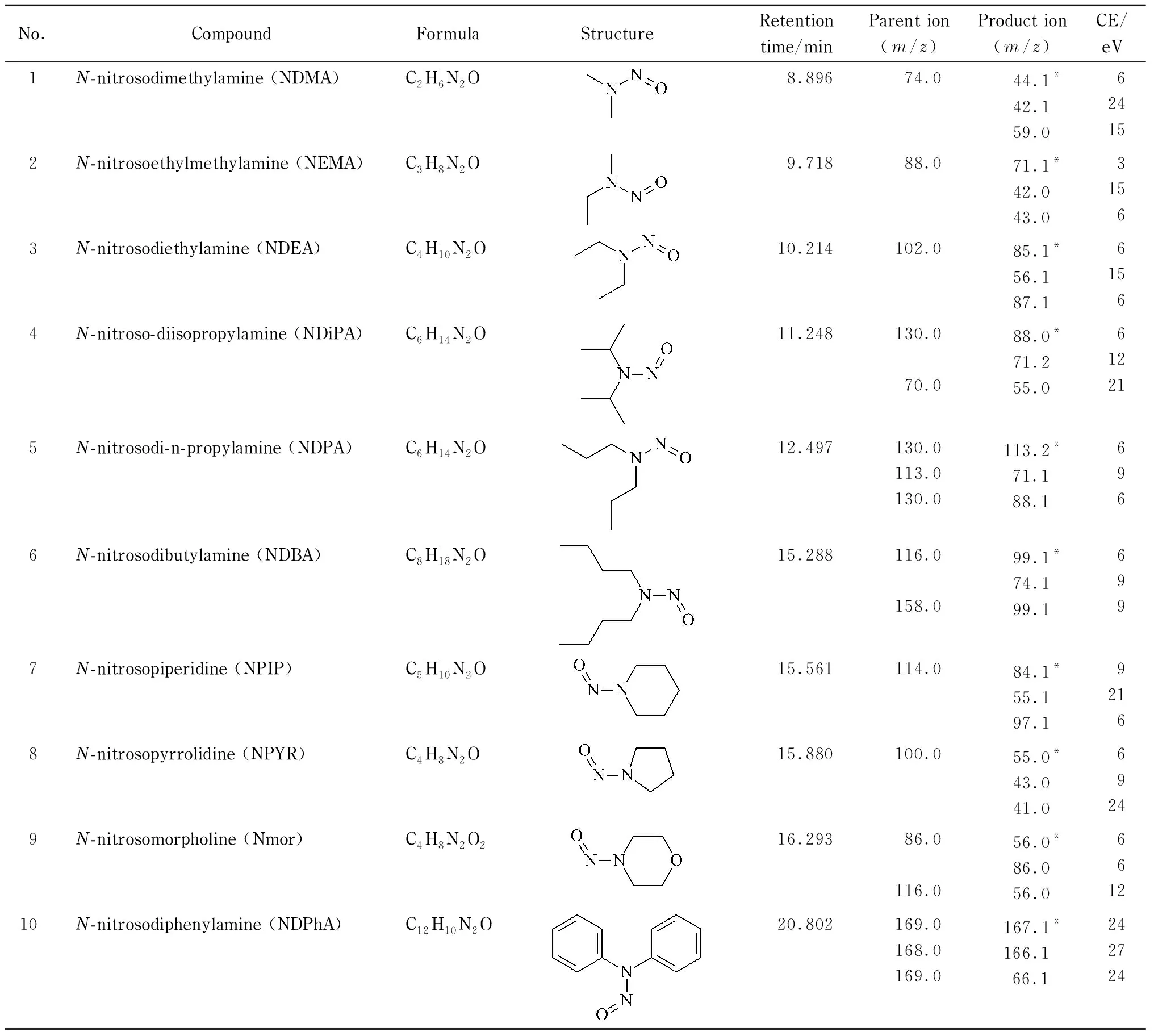
表 1 10种挥发性N-亚硝胺类化合物的分子式、结构式、保留时间、母离子、子离子和碰撞能量
* Quantitative ion.
2 结果与讨论
2.1 质谱条件的优化
在EI源模式下对10种挥发性N-亚硝胺类化合物进行一级质谱分析(Q3 scan),在质谱图中选择质荷比较大、绝对强度较大的离子作为前体离子;将碰撞能量设为3~45 eV(每3 eV一个间隔),对选定的前体离子峰进行二级质谱分析(产物离子扫描),根据二级质谱图,选择离子强度最大的离子作为定量离子,离子强度次之的为定性离子。图1为10种挥发性N-亚硝胺类化合物在MRM模式下的色谱图。

图 1 在MRM模式下10种挥发性N-亚硝胺类化合物的色谱图Fig. 1 Chromatograms of 10 volatile N-nitrosamines in multiple reaction monitoring (MRM) mode
2.2 气相色谱条件的优化
分别考察了3种不同极性的毛细管柱(HP-5MS(30 m×0.25 mm×0.25 μm)、DB-1701(30 m×0.25 mm×0.25 μm)、DB-WAX(30 m×0.25 mm×0.25 μm))对10种挥发性N-亚硝胺类化合物的检测效果。结果表明,在MRM分析条件下,3种毛细管柱均可用于10种挥发性N-亚硝胺类化合物的分离,但大部分挥发性N-亚硝胺类化合物极性较强,尤其是NDMA,即使初始温度设置为35 ℃,保持10.0 min, NDMA在DB-5MS和DB-1701毛细管柱中的保留均不好,出峰时间在3.0 min左右,且存在一定程度的峰拖尾现象,不适合准确定量,这与翟孟婷等[25]检测鱼干等材料中8种挥发性N-亚硝胺化合物时发现的情况一致;而10种挥发性N-亚硝胺类化合物在DB-WAX毛细管柱中,除NEMA峰形有前伸之外,其余9种挥发性N-亚硝胺类化合物均响应较好。因此选择DB-WAX极性毛细管柱用于10种挥发性N-亚硝胺类化合物的检测。通过优化初始柱温、流速、升温速率,使10种挥发性N-亚硝胺类化合物在21 min内分离效果较好,且响应较高。图2为10种挥发性N-亚硝胺类化合物的总离子流色谱图。
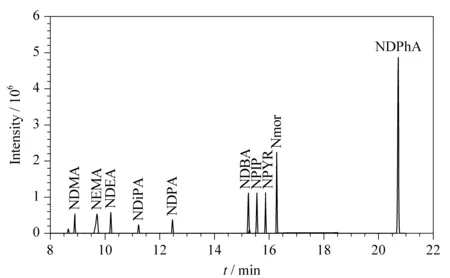
图 2 10种挥发性N-亚硝胺类化合物(0.500 mg/L)的 总离子色谱图Fig. 2 Total ion chromatogram of the 10 volatile N-nitrosamines (0.500 mg/L)
2.3 提取条件优化
2.3.1提取时间的考察

图 3 提取时间对10种挥发性N-亚硝胺类化合物萃取 效果的影响(n=3)Fig. 3 Effect of extraction time on the extraction effects of the 10 volatile N-nitrosamines (n=3)
同时蒸馏萃取是通过对有机溶剂进行加热,同时对样品进行加热并至沸腾状态来实现的,该装置优点在于蒸馏和萃取同时进行,只需要少量溶剂就可以提取大量样品,被检测组分得到较大程度的浓缩[26]。该方法常对香辛料、肉类、茶叶等样品进行挥发性香气物质的提取,为达到香气物质的全面提取,萃取时间常为1.0~2.0 h。为提高实验效率,本实验对提取时间进行了考察,SDE萃取时间分别设置为20.0、30.0、40.0、50.0和60.0 min(见图3)。当SDE萃取时间为20.0 min时,保留时间靠前的NDMA、NEMA、NDEA、NDiPA、NDPA和NDBA 6种挥发性N-亚硝胺类化合物的回收率低于80.0%,保留时间靠后的NPIP、NPYR、Nmor和NDPhA 4种挥发性N-亚硝胺类化合物的回收率低于60%;当SDE萃取时间延长至30.0 min时,10种挥发性N-亚硝胺类化合物的回收率全部达到80.0%以上;当萃取时间继续延长时,除NDBA和Nmor的回收率有所降低外,其余挥发性N-亚硝胺类化合物的回收率均保持稳定,可能由于在持续高温沸腾过程中,NDBA和Nmor发生一定程度的降解,导致回收率有所降低。因此,将同时蒸馏萃取时间设置为30.0 min。
2.3.2净化效果的考察
由于肉制品中脂肪含量较高,使用蒸馏萃取的方法依然会有大量的脂肪被同时提取出来,在分析过程中,这些酯类物质会吸附在进样口及色谱柱上,从而影响色谱分离和鉴定。根据目标化合物和脂类物质熔点的差异,可利用冷冻的方法将脂类物质从提取液中有效分离。本实验取脂肪含量较高的中式香肠作为实验样品,采用1.3.1节方法提取浓缩后,于-20 ℃分别冷冻0.5、1.0、1.5、2.0和2.5 h,发现当冷冻小于1.5 h时,有少量白色颗粒物析出;当冷冻时间大于2.0 h时,大量白色颗粒状的脂类物质沉淀于离心管底部,经过离心后过膜,待上机样品由深黄色变为淡黄色。将未经冷冻处理空白样品与经过冷冻处理的空白样品进行Q3 scan分析,由图4可知,经过冷冻处理后的样品,基线变得干净平滑,干扰物质明显变少。同时进行回收率试验,冷冻处理未对10种挥发性N-亚硝胺化合物的回收率产生明显变化,说明-20 ℃冷冻2.0 h可有效用于10种挥发性N-亚硝胺类化合物的净化。

图 4 (a)未经冷冻与(b)冷冻处理后空白腌渍腊肉样品的 总离子色谱图Fig. 4 Total ion chromatograms of blank pickled bacon samples (a) without and (b) with freezing treatment
2.4 基质效应的考察
基质效应(ME)是指样品中除分析物以外的其他成分对待测物测定值的影响,即非待测组分引起待测物响应值增加或减少的现象。本实验前处理过程用到大量有机试剂,且肉制品基质复杂,可能对目标物的响应产生一定影响。本文对基质效应的考察参照文献[27]萃取后添加的方法:配制质量浓度为0.100 mg/L的10种挥发性N-亚硝胺类化合物标准溶液和空白基质匹配校准溶液,在同样条件下进行分析,根据公式(1)计算ME,结果见图5。

ME=PmPs-1×100% (1)
Y: perk area of the quantitative ion;X: mass concentration, μg/L.
其中,Ps和Pm分别为标准溶液和空白基质匹配校准溶液中N-亚硝胺类化合物的响应值。当ME=0时,表示没有基质效应;当ME<0或ME>0时,分别表示存在基质抑制或基质增强效应。由图5可知,10种挥发性N-亚硝胺类化合物在肉制品中均存在基质增强效应,在火腿肠中基质效应比中式香肠和腌渍腊肉中的基质效应明显要弱,可能与火腿肠中淀粉含量(一般为5%~30%)较高有关,而中式香肠和腌渍腊肉中脂肪含量较高,在前处理过程中,虽有冷冻净化步骤,除去大量脂肪成分,但净化效果依然有限,导致10种挥发性N-亚硝胺类化合物在中式香肠和腌渍腊肉中基质增强效应明显。前6种熔沸点较低的挥发性N-亚硝胺类化合物基质增强效应要小于后4种。这可能是因为后4种挥发性N-亚硝胺类化合物熔沸点较高,在进样口挥发时,与较多杂质组分共流出,导致其基质增强效应明显。在基质效应存在的情况下,本实验采用基质匹配标准曲线定量,可以在一定程度上降低基质效应的影响,使定量结果更加准确。

图 5 不同基质对10种挥发性N-亚硝胺类化合物 基质效应的影响(n=3)Fig. 5 Effect of different matrices on the matrix effects of the 10 volatile N-nitrosamines (n=3)
2.5 线性关系、检出限和定量限
对1.0、5.0、10.0、50.0、100、500和1 000 μg/L的系列空白基质匹配校准溶液进行分析,以10种挥发性N-亚硝胺类化合物的峰面积为纵坐标、对应的质量浓度为横坐标绘制标准曲线。结果表明,10种挥发性N-亚硝胺类化合物线性关系良好,相关系数(r2)均大于0.99(见表2)。以定量离子信噪比(S/N)为3和10时的响应定义方法的检出限(LOD)和定量限(LOQ), 10种挥发性N-亚硝胺类化合物的检出限为0.01~0.02 μg/kg,定量限为0.04~0.07 μg/kg。本方法的线性范围广,灵敏度高。
2.6 准确度和精密度
按照1.3节前处理方法,取不含目标化合物的空白基质样品,分别添加不同水平(LOQ水平、1.0和2.0 μg/kg)的10种挥发性N-亚硝胺类化合物标准溶液,通过加标回收试验考察方法的准确度和精密度,每个添加水平重复3次,加标回收试验结果见表3。结果表明,10种挥发性N-亚硝胺类化合物的平均回收率为74.8%~94.3%,相对标准偏差小于8.3%(n=3),符合GB/T 27404-2008附录F中对检测方法确认的要求。

表 3 火腿肠、中式香肠和腌渍腊肉样品中10种挥发性N-亚硝胺类化合物的加标回收率及相对标准偏差(n=3)
2.7 实际样品的检测
按本文建立的方法对抽取的10个火腿肠、10个中式香肠和10个腌渍腊肉共计30个样品进行检测。结果表明,6种挥发性N-亚硝胺类化合物(NDMA、NDEA、NPYR、NPIP、NDBA和NDPA)被检出(见表4),其中NDMA、NPYR和NDPA的检出率最高,且有3个中式香肠、5个腌渍腊肉样品中NDMA含量大于我国GB 2762-2017标准《食品安全国家标准 食品中污染物限量》中的限量值(NDMA≤3 μg/kg)。此外,腌渍腊肉样品中6种挥发性N-亚硝胺类化合物的检出值均高于火腿肠、中式香肠样品,可能与腌渍肉制品独特的加工工艺有关[28],较长的加工时间增加了挥发性N-亚硝胺类化合物在肉制品中的转化。
表4火腿肠、中式香肠和腌渍腊肉样品中10种挥发性N-亚硝胺类化合物的检测结果
Table4Detected results of the10volatileN-nitrosamines in ham sausage, Chinese sausage and pickled bacon
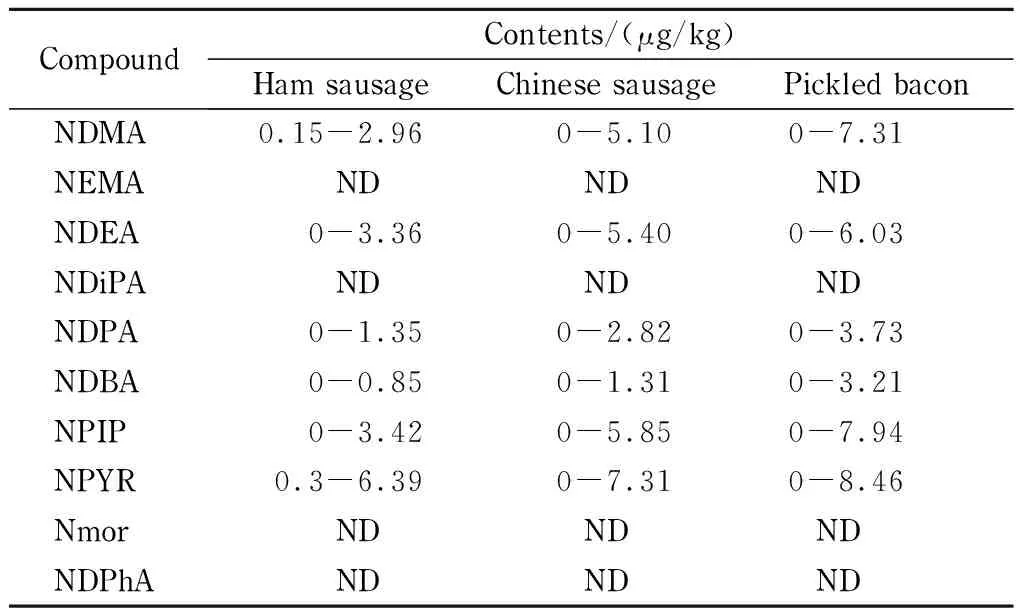
CompoundContents/(μg/kg)Ham sausageChinese sausagePickled baconNDMA0.15-2.960-5.100-7.31NEMANDNDNDNDEA0-3.360-5.400-6.03NDiPANDNDNDNDPA0-1.350-2.820-3.73NDBA0-0.850-1.310-3.21NPIP0-3.420-5.850-7.94NPYR0.3-6.390-7.310-8.46NmorNDNDNDNDPhANDNDND
ND: not detected.
3 结论
本文采用同时蒸馏萃取法结合GC-MS/MS对肉制品中10种挥发性N-亚硝胺类化合物进行分析,该方法检出限低,精密度高,可应用于各类肉制品中10种挥发性N-亚硝胺类化合物的测定。本研究所建立的方法能够为挥发性N-亚硝胺类化合物的检测提供更多选择,为评价各类工艺加工的肉制品的安全性提供技术支持。