不同加工方式对鹿茸中水溶性多糖含量及单糖组成的影响
2019-01-29宫瑞泽王燕华祁玉丽陈丽雪李珊珊孙印石
宫瑞泽, 王燕华,, 祁玉丽,, 陈丽雪,, 李珊珊, 孙印石*
(1. 中国农业科学院特产研究所, 吉林 长春 130112; 2. 吉林农业大学中药材学院, 吉林 长春 130118)
鹿茸(CerviCornuPantotrichum)是哺乳纲偶蹄目鹿科鹿属动物梅花鹿或马鹿雄鹿未骨化密生茸毛的幼角[1]。新鲜鹿茸富含血液,若不及时加工容易腐败变质,因此鹿茸的产地初加工直接关系鹿茸的品质和养殖业的经济效益。商品鹿茸通常按不同加工方式分为煮炸茸、冻干茸、排血茸和带血茸;按不同切制部位分为蜡片、粉片、纱片和骨片。
鹿茸中富含多糖、蛋白质、多肽、激素、生长因子、核苷等生物活性成分[2-7],鹿茸多糖是其中研究较多的活性成分,现代研究表明,鹿茸多糖具有抗氧化、抗肝损伤、减肥降脂、增强机体免疫力等功能[8-11]。鹿茸的不同加工方式会在一定程度上影响其化学成分和药理作用[12,13]。
本课题组通过前期研究发现,不同加工方式、不同部位及不同炮制方式对鹿茸中的粗蛋白、氨基酸、脂肪酸、硫酸软骨素、矿质元素、核苷、生物胺等成分均存在显著影响[14-19]。目前,不同加工方式对鹿茸中水溶性多糖及单糖组成的影响未见报道。本研究用水提醇沉法提取鹿茸中的水溶性多糖,经水解-衍生后以UPLC分析各单糖组成及含量。本文通过研究不同加工方式对鹿茸中水溶性多糖含量及单糖组成的影响,以期为鹿茸的加工利用及产品开发提供参考。
1 实验部分
1.1 仪器、试剂与材料
Acquity UPLC H-Class超高效液相色谱仪,配备二极管阵列检测器(美国Waters公司); 721G紫外可见分光光度计(上海仪电分析仪器有限公司); DM-200冷冻干燥机(北京博医康实验仪器有限公司); DTC-8超声波清洗机(鼎泰(湖北)生化科技设备制造有限公司); VORTEX-BE涡旋机(海门市其林贝尔仪器制造有限公司); HH-4A数显恒温水浴锅(常州国华电器有限公司); DHG-9123A电热恒温鼓风干燥箱(上海精宏实验设备有限公司); SF-TDL-5A大功率离心机(上海菲恰尔分析仪器有限公司); FW135中草药粉碎机(天津泰斯特仪器有限公司); WP-UP-WF-40微量分析型超纯水机(四川沃特尔水处理设备有限公司); 0.22 μm针筒式滤膜(有机系)(天津津腾实验设备有限公司)。
单糖对照品:D-甘露糖(批号:C25D8H51117)、D-氨基葡萄糖盐酸盐(批号:S27M7I15344)、D-核糖(批号:J03D7R26100)、D-葡萄糖醛酸(批号:K14J7S9017)、D-半乳糖醛酸(批号:S29J8I40844)、D-氨基半乳糖盐酸盐(批号:YS0918TA14)、D(+)-无水葡萄糖(批号:S08J6G1)和D-半乳糖(批号:Z22J9H64187)(纯度均≥98%,上海源叶生物技术有限公司)。
1-苯基-3-甲基-5-吡唑啉酮(PMP,分析纯,上海源叶生物科技有限公司);三氟乙酸(色谱纯,赛默飞世尔科技(中国)有限公司);乙腈、甲醇(色谱纯,美国Sigma公司);石油醚、浓硫酸、苯酚、无水乙醇、盐酸、氯仿和正丁醇(分析纯,北京化工厂)。超纯水(电阻率≥18.25 MΩ5cm)由实验室超纯水机制备。
鲜鹿茸购自吉林省长春市双阳区鹿乡镇,经中国农业科学院特产研究所李春义研究员鉴定为梅花鹿(CervusnipportTemminck)的茸角(二杠)。参考文献方法[20],随机选取3副鲜鹿茸进行煮炸与冻干的加工,3副鲜鹿茸进行排血与带血的加工。将加工完的鹿茸按蜡片、粉片、纱片、骨片分为4个部位,粉碎,过筛(60目),置干燥器中备用。
1.2 鹿茸中水溶性多糖
1.2.1葡萄糖标准曲线的绘制
取适量无水葡萄糖,于105 ℃下烘至恒重,准确称取10.0 mg,置于100 mL容量瓶中,加超纯水溶解并定容至刻线。依次吸取0.1、0.2、0.3、0.4、0.5和0.6 mL,置于试管中,加入1.0 mL超纯水、2.5 mL浓硫酸和0.5 mL质量分数为6%的苯酚水溶液,涡旋混匀,于室温静置30 min,在490 nm处测定吸光度。
1.2.2鹿茸水溶性多糖的提取与纯化
准确称取鹿茸样品粉末1.0 g,每个样品3份,加入5 mL石油醚,涡旋10 min,以8 000 r/min离心5 min,弃去上清液,残渣重复脱脂2次,氮气吹干溶剂。然后加入10.0 mL超纯水,涡旋混匀,预浸12 h,于50 ℃超声提取30 min,以8 000 r/min离心5 min,残渣加入10.0 mL超纯水重复提取1次,合并2次提取液。采用Sevag法除蛋白,加入5 mL氯仿-正丁醇(1∶1, v/v)溶液,涡旋10 min,以8 000 r/min离心5 min,沉淀蛋白质,重复上述操作,然后加入80.0 mL无水乙醇,于4 ℃冷藏过夜,以8 000 r/min离心10 min,弃去上清液,用无水乙醇洗涤沉淀2~3次,即得鹿茸水溶性多糖供试品。
1.2.3鹿茸水溶性多糖的测定
准确称取1.2.2节下制备的鹿茸水溶性多糖供试品1.0 mg,加入10 mL超纯水溶解,准确量取1 mL溶液,参照1.2.1节方法测定吸光度,计算不同加工方式的鹿茸中不同部位上水溶性多糖的含量。
1.3 鹿茸中水溶性多糖中的单糖组成
1.3.1对照品溶液的制备
精密称取单糖对照品各5.0 mg,置于5 mL容量瓶中,加入适量超纯水溶解并定容至刻度,配成质量浓度为1 g/L的单糖混合对照品溶液;精密吸取1 mL混合对照品溶液,置于试管中,分别加入0.3 mol/L PMP溶液和0.3 mol/L NaOH溶液各0.5 mL,充分混匀,然后于70 ℃水浴反应30 min,加入0.5 mL 0.3 mol/L HCl溶液。最后加入5 mL氯仿萃取,以8 000 r/min离心5 min,弃去下层溶液,重复多次以除去多余的PMP衍生化剂,上清液用0.22 μm有机系滤膜过滤,即得衍生处理的单糖混合对照品溶液。
1.3.2供试品溶液的制备
精密称取按1.2.2节下制备的不同加工方式鹿茸水溶性多糖各2.0 mg,加入2 mol/L HCl甲醇溶液0.5 mL,然后充氮气封管,于80 ℃水解16 h,水解后氮气吹干。随后加入2 mol/L三氟乙酸溶液0.5 mL,于120 ℃水解1 h,水解液转移至蒸发皿中,加入2 mL无水乙醇,于70 ℃蒸干以除尽三氟乙酸。向蒸发皿中加入1 mL超纯水,溶解水解后的多糖样品,然后分别加入0.3 mol/L PMP溶液和0.3 mol/L NaOH溶液各0.5 mL,其余操作与1.3.1节相同。
1.3.3色谱条件
色谱柱:Acquity UPLC®BEH C18柱(100 mm×2.1 mm, 1.7 μm);柱温:30 ℃;流动相:A为0.1 mol/L磷酸盐缓冲溶液(pH=7), B为乙腈;流速:0.3 mL/min。梯度洗脱条件:0~4.8 min, 17.5%B; 4.8~10.0 min, 17.5%B~18.5%B。进样量:2 μL;检测波长254 nm。
2 结果与讨论
2.1 样品前处理及检测方法的选择
多糖的提纯通常采用水提醇沉法,以水为提取溶剂将鹿茸中的多糖提取后,通过加入无水乙醇,并使其体积分数为70%~80%,从而沉淀鹿茸中的水溶性多糖。热水煎煮法和超声辅助提取法是目前提取多糖常采用的方法,宋佳等[21]通过提取率、单糖含量等比较热水煎煮和超声辅助提取鹿茸多糖的效率,结果表明,超声辅助提取法提取鹿茸中的多糖具有操作简单、提取率高、耗时短等优点。因此本实验选择超声辅助提取法提取鹿茸多糖,水提醇沉法纯化鹿茸水溶性多糖。
采用苯酚-硫酸法对鹿茸多糖进行含量测定,多糖在浓硫酸的作用下脱水生成糠醛或羟甲基糠醛,然后与苯酚缩合形成橙红色化合物,在490 nm条件下测定其吸光度。该方法具有操作简单、灵敏度高、重复性好等优点。组成鹿茸多糖的单糖组分无紫外吸收,通过PMP衍生使其带上发色团,通过紫外检测并定量。此外,本实验首次采用UPLC对鹿茸多糖中的单糖组成进行分析,UPLC具有高分离度、高分离效率、高灵敏度的特点,大大提高了分离效果、缩短了分析时间。
2.2 单糖分析的方法学考察
2.2.1线性关系、检出限与定量限
精密吸取衍生后单糖混合对照品溶液适量,用超纯水进行梯度稀释,得到系列衍生后单糖混合对照品溶液,按1.3.3节的色谱条件进样,测定峰面积,每个质量浓度平行进样3次,以峰面积的平均值为纵坐标(Y),质量浓度为横坐标(X, mg/L),绘制标准曲线。将衍生后单糖混合对照品溶液用超纯水逐级稀释后,以信噪比(S/N)为3的溶液浓度作为检出限(LOD),以S/N为10的浓度作为定量限(LOQ)。各单糖的回归方程、线性范围、LOD和LOQ见表1, 8种单糖在线性范围内线性关系良好,相关系数(R2)均>0.99, LOD和LOQ分别为0.19~3.56 μg/L和0.62~10.69 μg/L,均能满足实际样品检测需要。

表 1 8种单糖的线性范围、回归方程、相关系数、检出限和定量限
Y: peak area;X: mass concentration, mg/L.
2.2.2精密度试验
精密吸取衍生后单糖混合对照品溶液2 μL,按1.3.3节色谱条件进样分析,连续进样5次,测定峰面积,计算各单糖衍生物峰面积的RSD值。结果表明,8种单糖峰面积的RSD为1.33%~2.17%,均小于5%,表明仪器精密度良好。
2.2.3重复性试验
精密称取煮炸茸(粉片)样品6份,每份2.0 mg,按1.3.2节制得供试品溶液,精密吸取6份供试品溶液各2 μL,按1.3.3节色谱条件依次进样分析,测定峰面积,计算各单糖的含量。结果表明,8种单糖峰面积的RSD为1.33%~2.81%,表明本实验重复性良好。
2.2.4稳定性试验
精密称取煮炸茸(粉片)样品2.0 mg,按1.3.2节制得供试品溶液,吸取供试品溶液2 μL,并分别在0、2、4、8、16和24 h后按1.3.3节色谱条件进样分析,测定峰面积。结果表明,8种单糖峰面积的RSD为1.74%~2.73%,表明仪器在24 h内稳定性良好。
2.2.5加样回收试验
精密称取9份已知鹿茸单糖含量的鹿茸样品(煮炸茸粉片)粉末1.0 mg,按照其单糖含量的80%、100%和120%加入适量的单糖对照品,按1.3.2节方法制备供试品溶液,按1.3.3节色谱条件测定各单糖衍生物峰面积,并计算单糖含量、回收率及其RSD值。结果表明,8种单糖的平均加标回收率为98.47%~101.21%, RSD为1.34%~2.16%,表明方法准确度较高。
2.3 不同加工方式鹿茸中水溶性多糖含量
采用苯酚-硫酸法测定不同加工方式鹿茸中水溶性多糖的含量,建立葡萄糖浓度与吸光度之间的回归方程。以葡萄糖浓度为横坐标(X, mg/L)、吸光度为纵坐标(Y)绘制回归曲线,得到线性回归方程Y=0.011 8X+0.012,R2为0.997 9。

图 1 煮炸茸与冻干茸中水溶性多糖的含量(n=3)Fig. 1 Water-soluble polysaccharide contents in antler velvet after boiled and freeze-dried processes (n=3) The same letter (a-e) indicated no significant difference (P>0.05), otherwise it denoted a significant difference (P<0.05).
煮炸茸和冻干茸水溶性多糖的含量见图1,煮炸茸蜡片、粉片、纱片和骨片中水溶性多糖的含量分别为1.74、1.67、1.03和1.13 g/kg,冻干茸蜡片、粉片、纱片和骨片中水溶性多糖的含量分别为2.77、3.07、1.22和3.20 g/kg。煮炸茸蜡片、粉片、纱片、骨片中水溶性多糖的含量均显著低于冻干茸的相应部位(P<0.01)。低温干燥较高温热加工更易保留鲜鹿茸中的水溶性多糖,传统煮炸茸加工过程中的沸水煮炸和长时间的高温烘烤易发生消耗鹿茸中糖类物质的反应,如焦糖化反应和美拉德反应等。
煮炸茸蜡片、粉片水溶性多糖的含量显著高于纱片、骨片(P<0.05),蜡片、粉片水溶性多糖的含量差异不显著(P>0.05),纱片、骨片水溶性多糖的含量也无显著性差异(P>0.05);冻干茸蜡片、粉片、骨片水溶性多糖的含量均显著高于纱片(P<0.05),骨片、粉片水溶性多糖的含量无显著性差异(P>0.05)。蜡片、粉片、纱片和骨片分别对应发育程度不同的软骨组织,发育程度不同的软骨组织其生长分化速率不同,营养物质水溶性多糖的含量必然也存在差异。
排血茸和带血茸水溶性多糖的含量见图2,排血茸蜡片、粉片、纱片、骨片中水溶性多糖的含量依次为1.55、1.78、0.96和0.77 g/kg,带血茸蜡片、粉片、纱片、骨片中水溶性多糖含量依次为1.69、1.64、1.01和1.31 g/kg。
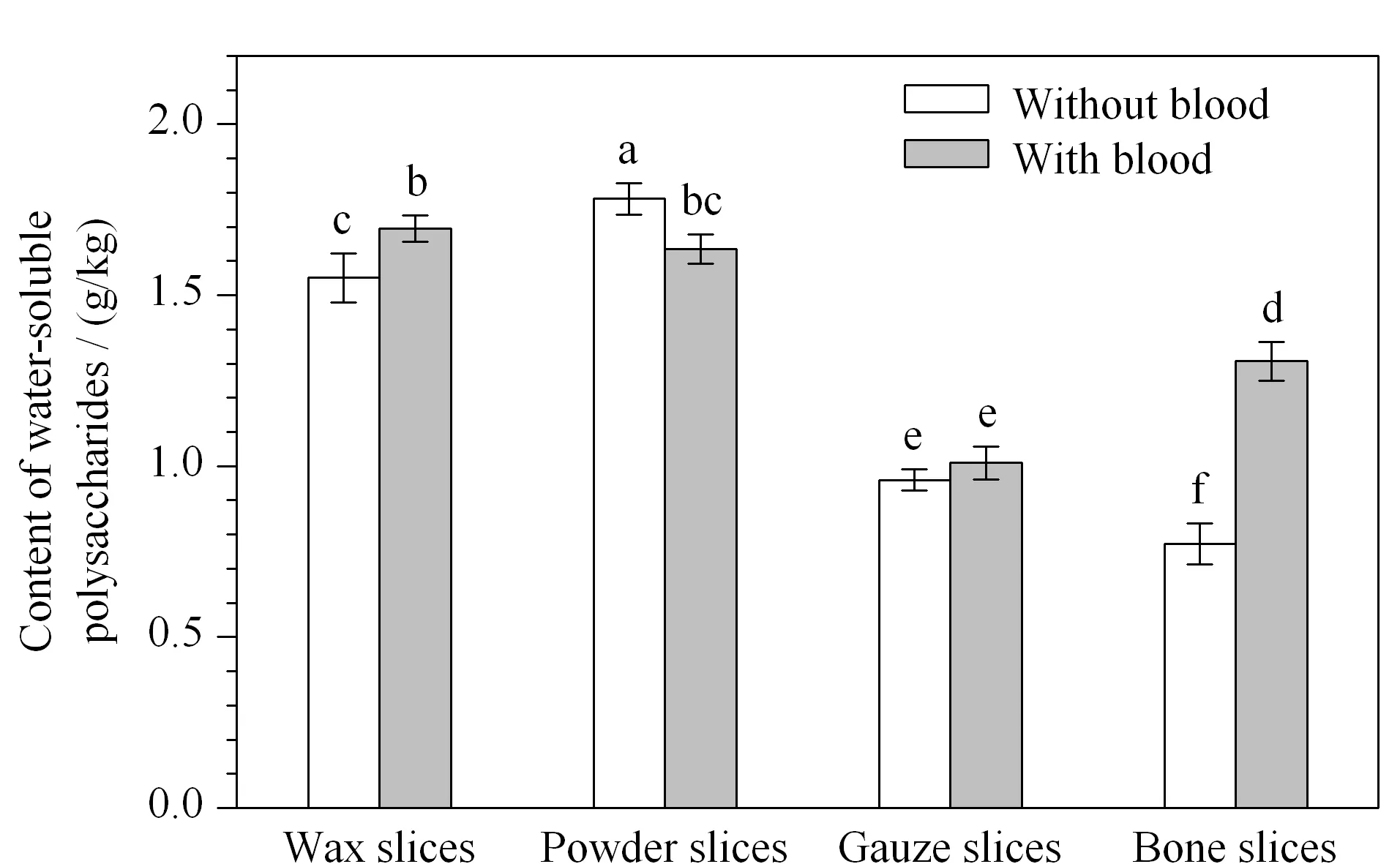
图 2 排血茸与带血茸中水溶性多糖的含量(n=3)Fig. 2 Water-soluble polysaccharide contents in antler velvet processed without and with blood (n=3) The same letter indicated no significant difference (P>0.05), otherwise it meant a significant difference (P<0.05).
带血茸的蜡片和骨片中水溶性多糖的含量显著高于排血茸(P<0.05);排血茸的粉片中水溶性多糖的含量显著高于带血茸(P<0.05);排血茸与带血茸的纱片中水溶性多糖的含量无显著性差异(P>0.05)。带血茸加工过程中无血液排出,血液中也含有丰富的糖类物质,因此带血茸蜡片、骨片中水溶性多糖的含量均显著高于排血茸相应部位;然而软骨组织中富含血液中没有的硫酸软骨素等水溶性黏多糖,粉片软骨组织较多,因此单位质量的排血茸粉片较带血茸粉片水溶性多糖含量高。
带血茸蜡片、粉片中水溶性多糖的含量显著高于骨片(P<0.05),骨片显著高于纱片(P<0.05);排血茸4个部位中水溶性多糖的含量差异显著(P<0.05),粉片、蜡片、纱片和骨片中水溶性多糖的含量依次递减。不同发育程度的软骨组织其生长分化速率、物质代谢程度的不同仍是造成上述差别的主要原因。
2.4 不同加工方式鹿茸中单糖组成和含量
不同加工方式鹿茸中单糖种类均包括甘露糖、氨基葡萄糖、核糖、葡萄糖醛酸、半乳糖醛酸、氨基半乳糖、葡萄糖和半乳糖8种(见图3),其中以氨基葡萄糖、氨基半乳糖、葡萄糖醛酸、葡萄糖和半乳糖为主,这与宋佳等[21]的报道基本一致。鹿茸是由软骨组织发育而来,硫酸软骨素是软骨组织中特有的生物活性成分,氨基葡萄糖和氨基半乳糖是硫酸软骨素中特有的单糖,因此其在鹿茸中含量较高。

图 3 (a)混合对照品溶液和(b)鹿茸样品(冻干茸纱片) 中8种单糖的色谱图Fig. 3 Chromatograms of the eight monosaccharides in (a) a mixed standard solution and (b) a gauze slices of freeze-dried antler velvet
冻干茸与煮炸茸中单糖的含量见表2。同一部位煮炸茸中各单糖含量均显著低于冻干茸(P<0.05),煮炸茸加工过程中的高温加剧了焦糖化反应和美拉德反应,消耗了一定量的糖产生非糖物质;煮炸茸与冻干茸不同部位之间表现出蜡片、粉片、纱片和骨片单糖含量依次递减的规律,发育程度不同的软骨组织其生长分化速率不同,其营养物质糖的含量必然也存在差异。

表 2 不同加工方式的鹿茸中8种单糖的含量(x±SD, n=3)
带血茸与排血茸中单糖含量见表2。带血茸与排血茸相比,因加工过程中保留了茸体中的血液,血液中富含糖、蛋白质等营养物质,所以相同部位带血茸中单糖含量显著高于排血茸(P<0.05);对氨基葡萄糖和氨基半乳糖而言,因其是软骨组织中特有成分硫酸软骨素的单糖组成成分,血液中不含有上述成分,所以单位质量排血茸中氨基葡萄糖和氨基半乳糖的含量显著高于带血茸中的含量(P<0.05);不同部位单糖含量表现出蜡片、粉片、纱片和骨片单糖含量依次递减的规律,不同发育程度的软骨组织生长分化速率、物质代谢程度的不同仍是造成单糖含量差别的主要原因。
3 结论
本实验采用苯酚-硫酸法和柱前衍生超高效液相色谱法分析了鹿茸中水溶性多糖和8种单糖,并应用该方法对鹿茸样品进行检测。结果表明,不同加工方式对鹿茸中水溶性多糖及单糖含量影响较大,该方法的建立为鹿茸多糖的结构组成、活性研究及产品开发提供了坚实的理论基础。
