魔芋葡甘露聚糖对酶解青花椒籽仁谷蛋白乳液稳定性的影响
2019-01-29瞿瑗侯晓艳黎杉珊申光辉罗擎英吴贺君蒲彪叶萌张志清
瞿瑗,侯晓艳,黎杉珊,申光辉,罗擎英,吴贺君,蒲彪,叶萌,张志清*
1(四川农业大学 食品学院,四川 雅安,625014) 2(四川农业大学 林学院,四川 温江,611130)
乳液体系是由分散相和连续相组成的热力学不稳定体系,易发生分层、絮凝、聚结、相转化、奥斯特瓦尔德熟化[1]。通常可以通过添加一些表面活性组分来稳定乳液,如蛋白质、表面活性剂、磷脂等[2]。乳液中添加蛋白质,可降低界面张力并形成黏弹性薄膜,所以可以有效地稳定分散体系[3]。多糖由于其增稠和凝胶特性常被应用于食品工业中。乳液中添加多糖,可以使其吸附到液滴表面并形成保护层,进一步提高蛋白质乳液的稳定性[4]。有研究表明,蛋白质乳液在蛋白质等电点附近和高盐浓度下易发生聚集,乳液极不稳定[5-6],由于界面电荷、结构和界面层厚度的差异,被蛋白质-多糖复合物包覆的油滴对环境压力(pH,离子强度和热处理)比单独用蛋白质包裹的油滴更耐受[7-8]。而多糖提高蛋白质乳液稳定性的能力取决于所用蛋白质和多糖的性质以及界面络合期间和之后的环境条件[9]。应用蛋白质-多糖复合物制备稳定的乳液有2种途径:(1)将多糖添加到由蛋白质和油形成的初乳液中,通过逐层组装方式,使多糖吸附到蛋白质表面[10];(2)先将蛋白质和多糖混合,形成可溶性复合物,再加入油进行乳化,使蛋白质-多糖复合物吸附到油滴表面[11]。目前已有许多关于通过添加多糖来稳定蛋白乳液的研究,比如大豆多糖-乳清蛋白乳液[12]、羧甲基纤维素钠-β-乳球蛋白乳液[13]、羧甲基纤维素钠-牛奶蛋白乳液以及瓜尔豆胶-牛奶蛋白乳液[14]。
青花椒籽蛋白是一种优质蛋白质[15-16],其中谷蛋白是青花椒籽仁中主要的储存蛋白[17]。然而,由于其水溶性较差,作为乳化剂的应用受到了限制,课题组前期研究发现,蛋白的溶解性和乳化特性可以通过适当的酶解来提高[18]。水解度为6%的青花椒籽仁谷蛋白可以形成较稳定的乳液,但是乳液的热稳定性较差,当pH值或离子强度改变时,液滴易发生聚集,乳液不稳定,这将极大地限制青花椒籽仁谷蛋白作为乳化剂应用于食品工业中。魔芋葡甘露聚糖(konjac glucomannan,KGM)是一种中性线性多糖,可以用于乳液中提高其物理稳定性[19]。迄今为止还没有关于魔芋葡甘露聚糖对酶解青花椒籽仁谷蛋白乳液稳定性影响的研究。通过蛋白质-多糖复合物来稳定乳液往往受环境温度、pH、离子强度以及制备方法的影响。因此,本文研究了影响酶解青花椒籽仁谷蛋白-魔芋葡甘露聚糖(HZADSKG-KGM)复合物包裹油滴形成稳定乳液的主要因素,分析了该乳液对环境压力(pH,离子强度和热处理)的稳定性,以期对生物大分子作为天然稳定剂应用于食品工业中提供有用信息。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
青花椒籽(ZanthoxylumarmatumDC.),采自四川省金阳县青花椒产地;魔芋葡甘露聚糖,成都光禾商贸有限公司;胰蛋白酶(酶活力>2.5×105U/g),上海瑞永生物科技有限公司; NaCl、NaOH、HCl等,均为分析纯,科龙化工试剂厂。
1.1.2 主要仪器
FW-100高速万能粉碎机,北京中兴伟业仪器有限公司;SCIENTZ-12N冷冻干燥机,宁波新芝生物科技股份有限公司;Thermo BR4i离心机,美国THERMO公司;DK-8D三孔电热恒温水槽,上海齐欣科学有限公司;PHS-3C酸度计,上海佑科仪器仪表有限公司;DHG-9101电热恒温干燥箱,上海三发科学仪器有限公司;Sartorius CP225D电子天平,德国SARTORIUS公司;JHQ-Q54-P70高压均质机,郑州玉祥食品机械有限公司;FJ-200-SH型数显高速分散均质机,上海右一仪器有限公司;Rise系列-2006型激光粒度分析仪,济南润之科技有限公司;FV1200型激光共聚焦显微镜,日本Olympus公司。
1.2 实验方法
1.2.1 测试样品制备
(1)制备青花椒籽仁谷蛋白
参考DASH等[20]的方法并适当修改。称取10 g脱脂青花椒籽仁,加入10倍的蒸馏水,搅拌30 min,8 000 r/min离心20 min,去除上清液;加入10倍质量分数为2%的NaCl溶液,重复以上操作,去除上清液;再次加入10倍体积分数为70%的乙醇溶液,重复以上操作,去除上清液;最后加入10倍质量分数为0.5%的NaOH溶液,重复以上操作,收集上清液,提取谷蛋白,室温下调节pH值至3.3,4 000 r/min离心20 min后,取沉淀物于4 ℃透析48 h,冷冻干燥备用。青花椒籽仁谷蛋白纯度达96.25%(干基,N%×6.25)。
(2)水解青花椒籽仁谷蛋白(HZADSKG)的制备
具体参考ELAVARASAN等[21]的方法并适当修改。将5 g青花椒籽仁谷蛋白加入到100 mL蒸馏水中,连续搅拌1 h。然后将pH值和温度调到所需值(pH=8,50 ℃)后加入0.1 g胰蛋白酶进行水解。酶解22.3 min后,于95 ℃下加热5 min灭活,迅速冰浴冷却至室温,离心取上清液后冻干备用。采用pH-stat法[14]测定水解度。最后获得水解度为6%的青花椒籽仁谷蛋白乳液。
(3)制备初级乳液
参考TAN等[22]的方法并适当修改。分别将5 g/L的蛋白质和5 g/L的魔芋葡甘露聚分散于10 mmol/L(pH=7.0)的磷酸盐缓冲溶液中,并在室温下水化至少2 h以保证其完全溶解。采用高速分散均质机将质量浓度为100 g/L玉米油与质量浓度为900 g/L蛋白溶液(0.5%)预混匀,12 000 r/min搅拌2 min,然后使用高压均质机,在30 MPa下高压均质3次,制备初级乳液。
(4)制备二级乳液
在初级乳液的基础上,加入一定比例的魔芋葡甘露聚糖溶液和磷酸盐缓冲溶液,混匀,高速搅拌0.5 h,最终得到二级乳液,然后加入质量浓度为0.2 g/L叠氮化钠以防止微生物生长。
(5)确定魔芋葡甘露聚糖最佳浓度
调节初级乳液的pH值为3和7,随后加入一定比例的魔芋葡甘露聚糖溶液和磷酸盐缓冲溶液,混匀,高速搅拌0.5 h,最终得到二级乳液(质量分数为1%玉米油,质量分数0.05%的青花椒籽仁谷蛋白,质量分数为0~0.5%的魔芋葡甘露聚糖)。
1.2.2 乳液稳定性的测定
(1)pH稳定性
将初级乳液和二级乳液用 0.5 mol/L HCl或0.5 mol/L NaOH调节pH值为2~7,搅拌混匀,室温下放置1 d后测定样品的粒径大小和微观结构,观察其乳析现象。
(2)离子强度稳定性
调节初级乳液和二级乳液的pH值至3。分别添加不同浓度的NaCl(0~500 mmol/L)于样品中,搅拌混匀,室温下放置1 d后测定样品的粒径大小和微观结构,观察其乳析现象。
(3)热处理稳定性
调节初级乳液和二级乳液的pH值至3。分别于30~90 ℃下水浴 30 min后迅速冷却至室温。室温下放置1 d后测定样品的粒径大小和微观结构,观察其乳析现象。
1.2.3 指标测定
(1)乳液平均粒径的测定
采用Rise系列-2006型激光粒度分析仪对乳液的平均粒径进行测定[23]。样品用相同pH值及离子强度的缓冲液稀释100倍以消除光散射效应,在25 ℃条件下进行测定。
(2)微观结构测定
根据TAN等[22]的方法采用激光共聚焦显微镜(CLSM)对乳液的微结构进行观察。尼罗红溶于乙醇中(1 mg/mL),异硫氰酸荧光素(FIFC)溶于二甲基亚砜中(10 mg/mL)。配好的染料避光保存。1 mL乳液样品分别与0.1 mL尼罗红和0.1 mL FITC混合后,取8 μL样品于载玻片中心,在盖玻片四周涂上指甲油避免水分散失。采用60倍油镜进行观察。选择 488 nm的Ar离子作为激发波长,515 nm和621 nm分别作为绿色及红色的发射波长,采集荧光图像。
1.3 数据处理
每次实验重复3次,采用SPASS 20.0进行Tukey检验分析样品之间的显著性差异。
2 结果与分析
2.1 魔芋葡甘露聚糖浓度对乳液稳定性的影响及最佳浓度确定
图1为不同浓度魔芋葡甘露聚糖(0~0.5 wt%)对乳液稳定性的影响。在图1-a中,pH值为3的初级乳液的平均粒径较大,为6.18 μm,pH值为7的初乳液的平均粒径较小,为1.48 μm。当魔芋葡甘露聚糖的浓度超过0.1%时,pH 3和pH 7条件下乳液的平均粒径都显著降低,当魔芋葡甘露聚糖浓度为0.3%时,乳液的平均粒径均最小,表明此时魔芋葡甘露聚糖的吸附能够增加静电斥力和空间斥力,从而能够避免蛋白质在等电点附近的聚集;当魔芋葡甘露聚糖浓度为0.4%和0.5%时,乳液的平均粒径又显著增大。
图1-b为乳液的宏观稳定性,与平均粒径变化结果一致。当pH值降至3时初级乳液分层,由于此pH值接近蛋白质等电点,蛋白质净电荷的缺失导致乳滴间缺乏静电斥力而发生絮凝和聚结[24];当pH值为7时,由于带电液滴间存在强烈的静电斥力可以有效抑制液滴发生聚集,初乳液很稳定。当魔芋葡甘露聚糖浓度为0.01%~0.2%时,pH值3条件下的乳液不稳定,发生乳析现象,表明低浓度的魔芋葡甘露聚糖促进乳液聚集,这可能是由于加入多糖后,液滴表面电荷降低,使得液滴之间的静电斥力降低进而发生聚集;此外,当多糖浓度较低时,单个多糖分子不能完全包裹整个油滴,导致多个油滴表面吸附1个多糖分子,进而导致桥联絮凝[25]。当魔芋葡甘露聚糖浓度超过0.4%时, pH 3和pH 7条件下的乳液平均粒径均显著增加,但是乳液保持稳定。在乳液中添加非吸附多糖可以使油滴间的吸引渗透力增加,从而导致损耗絮凝[26]。因此,当多糖浓度超过临界浓度时,液滴发生絮凝,从而促进乳液聚结。但是,魔芋葡甘露聚糖未使乳液发生乳析现象可能是由于魔芋葡甘露聚糖能够增加乳液体系的黏性,从而降低液滴絮凝的速度。以上结果表明, 0.3%的魔芋葡甘露聚糖浓度为使乳液稳定的最适添加浓度。
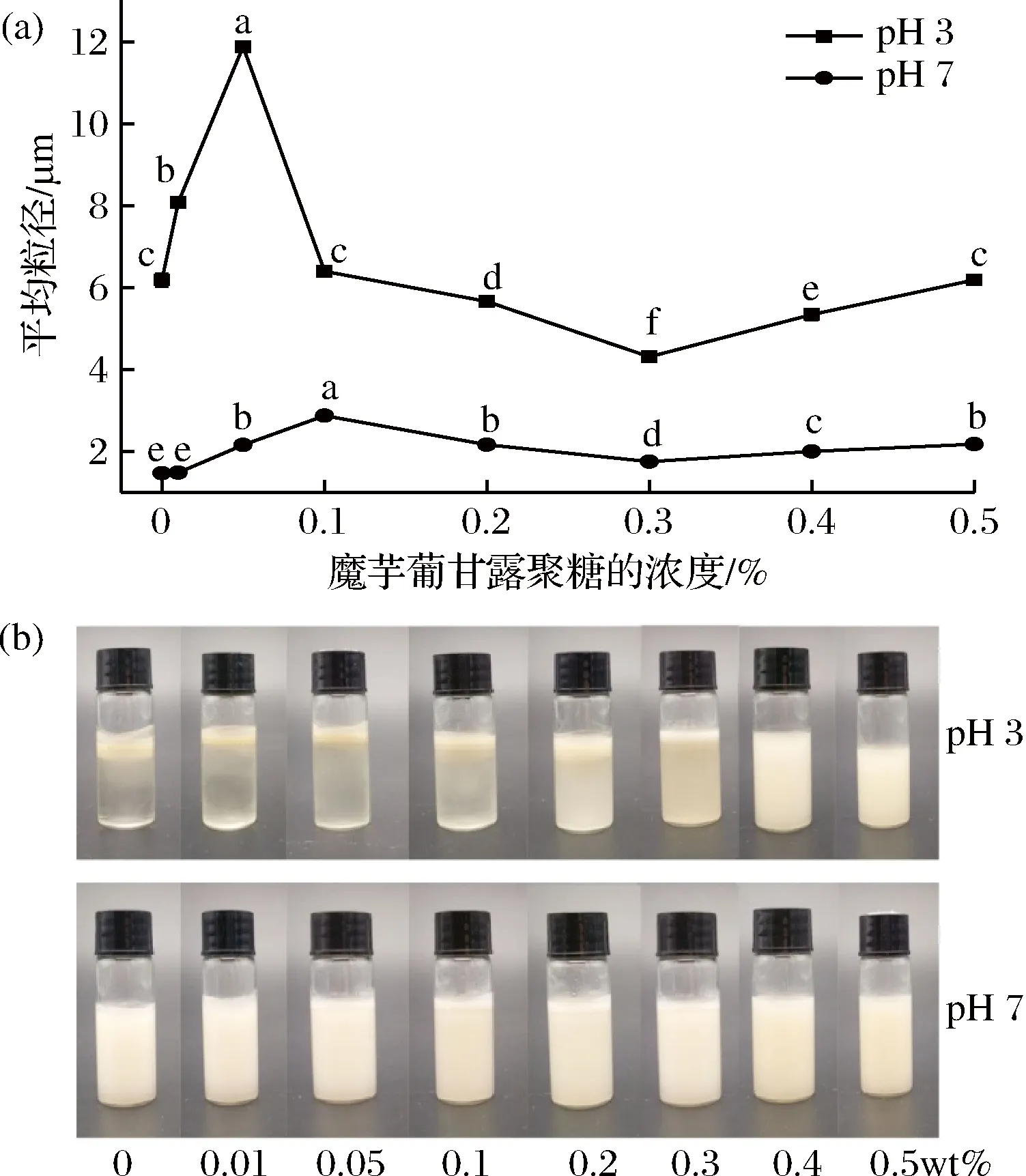
a-pH 3和pH 7的平均粒径;b-24 h后乳液的表观特性;不同小写字母表示差异显著,下同。
图1 魔芋葡甘露聚糖浓度对青花椒籽仁谷蛋白乳液在(a)pH 3和pH 7的平均粒径以及(b) 24 h后乳液的表观特性的影响
Fig.1 Influence of KGM concentration on(a) the mean particle diameter of oil-in-water emulsions at pH 3 and pH 7;(b) macroscopical characteristics of emulsions after 24 h storage at pH 3 and pH 7
2.2 pH值对乳液稳定性的影响
pH值对初级乳液和二级乳液稳定性的影响如图2所示。从图2-a中可以看出,随着pH值的增大,初乳液平均粒径显著降低,二级乳液的平均粒径在pH 5之前显著性降低,pH 5~7之间无明显变化。图2-b结果与平均粒径变化一致。初级乳液在pH 7条件下稳定,在pH 2~6情况下出现明显的乳析现象。这可能是由于在蛋白质等电点附近液滴电荷减少,静电斥力减弱造成的[24]。添加了魔芋葡甘露聚糖的二级乳液在pH 5~7范围内保持相对稳定,乳液未分层。结果表明,魔芋葡甘露聚糖对提高青花椒籽仁谷蛋白乳液的稳定性有显著效果。由于魔芋葡甘露聚糖分子吸附在液滴表面的蛋白分子上,形成较厚的带电界面层,从而增加液滴之间的静电斥力和空间位阻,进而抑制乳液聚集。而乳液在pH 2~4条件下不稳定,发生了聚集。魔芋葡甘露聚糖含有若干个包含几个残基长度的支链,是一种线性结构,可以延伸至水相中,不能产生较强的位阻排斥[27]。图2-c为乳液的激光共聚焦微观结构,在pH值3时,初乳液中的液滴发生了明显聚集,这是因为液滴间静电斥力较弱。加入魔芋葡甘露聚糖后,乳液在此pH值下也出现了液滴聚集现象。在pH值7时,初乳液的小油滴均一分布,表明液滴间存在较强的静电斥力来抑制乳液的聚集。二级乳液在此pH值条件下保持稳定,这归因于液滴间强烈的静电斥力作用,且魔芋葡甘露聚糖的浓度还不至于引起损耗絮凝。激光共聚焦结果与表观特性结果一致。
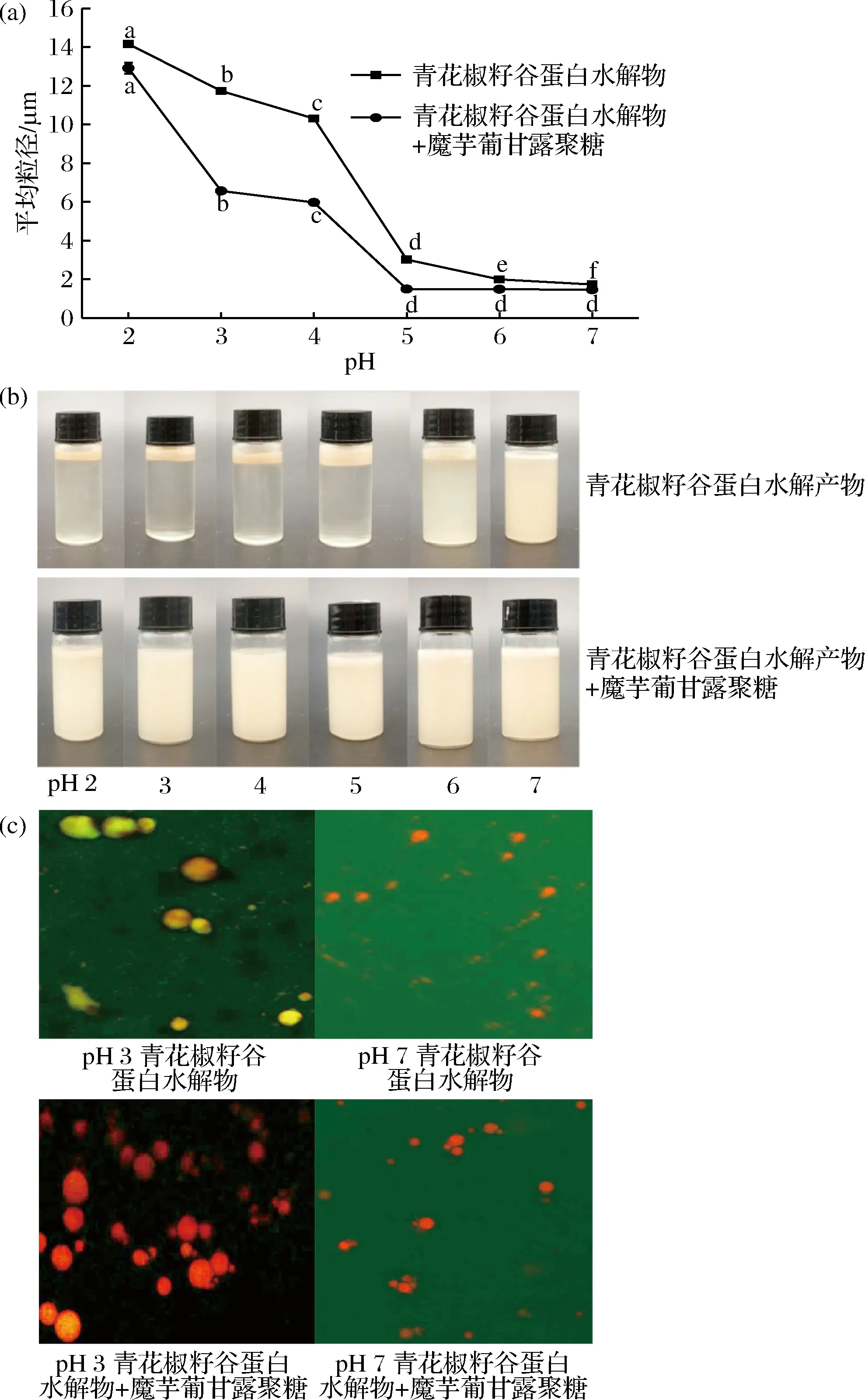
图2 pH值对魔芋葡甘聚糖存在和不存在时(a)乳液平均粒径 ;(b)放置24 h后的表观特性;(c)微观结构的影响(标尺20 μm)
Fig.2 Influence of pH values in the absence and presence of KGM on (a) mean particle diameter of emulsions;(b)macroscopic characteristics of emulsions after 24 h storage;(c)microstructures of selected emulsions (the ruler:20 μm)
2.3 离子强度对乳液稳定性的影响
NaCl对魔芋葡甘露聚糖-蛋白乳液在pH值3时的平均粒径变化如图3所示。
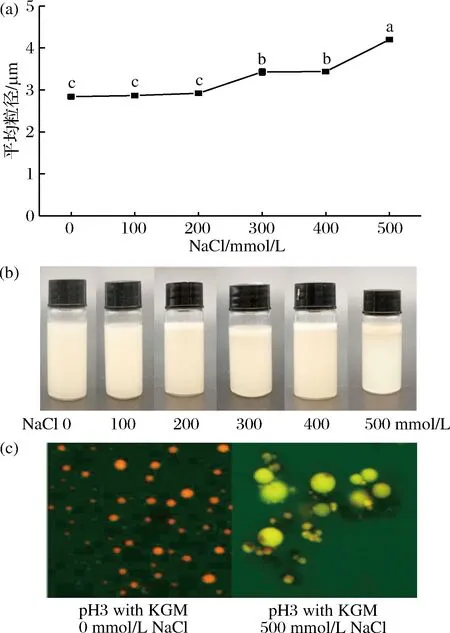
图3 NaCl浓度对魔芋葡甘露聚糖-青花椒籽仁谷蛋白乳液(a)平均粒径; (b)放置24 h后的表观特性;(c)微观结构的影响(标尺为20 μm)
Fig.3 Influence of NaCl concentration in the presence of KGM on (a) mean particle diameter of emulsions; (b)macroscopic characteristics of emulsions after 24 h storage; (c) microstructures of selected emulsions (the ruler: 20 μm)
由图3-a可知,随着NaCl浓度的增大,乳液的平均粒径显著增大。从图3-b可以看出,二级乳液在0~400 mmol/L NaCl下保持稳定,在500 mmol/L NaCl下发生聚集,出现明显的分层。这表明添加了魔芋葡甘露聚糖后,吸附了多糖分子的液滴之间的静电斥力和空间位阻远大于范德华力和疏水相互作用[28]。但是当NaCl浓度达到一个临界值时,液滴发生聚集,发生乳析。这可能因为加入高浓度的NaCl后,由于静电屏蔽作用使得液滴之间的静电斥力减弱[29];另外,高浓度的NaCl可能会使液滴表面的蛋白-多糖的吸引力(范德华力和疏水相互作用)降低,使得某些多糖分子吸附到多个液滴表面,进而引起桥联絮凝。图3-c为乳液的微观结构,低浓度的NaCl条件下,二级乳液微观结构未发生较大变化,但是在高浓度盐离子下,二级乳液发生聚集。微观结构进一步验证了前面的平均粒径变化以及表观特性结果。SALMINEN等[30]研究指出,通过添加果胶可以显著提高乳清蛋白乳液的盐离子稳定性(0~500 mmol/L NaCl),本文结果支持了上述观点。
2.4 温度对乳液稳定性的影响
从图4中可以看出,经热处理(30~90 ℃)后乳液保持稳定,未出现乳析现象(图4-b),但是随着温度的升高,二级乳液的平均粒径有所增大,60 ℃下达到最小(图4-a)。从图4-c可以看出,90 ℃处理的乳液液滴较30 ℃的大,但是液滴分布均匀,这与表观特性中未发现乳析的结果一致。
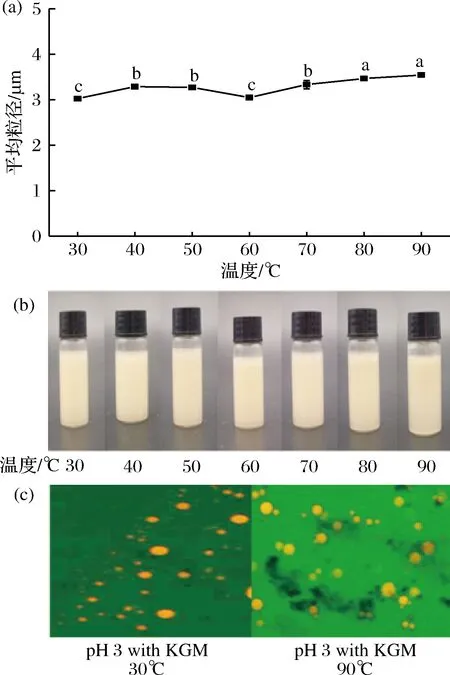
图4 温度对魔芋葡甘露聚糖-青花椒籽仁谷蛋白乳液(a)平均粒径;(b)放置24h后的表观特性;(c)微观结构的影响(标尺为20 μm)
Fig.4 (a) Influence of temperature on mean particle diameter of emulsions; (b)macroscopic characteristics of emulsions after 24 h storage; (c) microstructures of selected emul-sions (the ruler: 20 μm)
SALMINEN等[30]研究指出,通过添加果胶可以极大提高乳清蛋白乳液的热处理稳定性(40~90 ℃),XIANG等[31]研究结果也与之近似。本研究中由于魔芋葡甘露聚糖的存在,导致的液滴间有强烈的静电斥力和空间位阻,从而增加了乳液的热稳定性,进一步证实了上述研究理论。
3 结论
本文研究结果表明,魔芋葡甘露聚糖浓度对稳定青花椒籽仁谷蛋白乳液有重要作用。魔芋葡甘露聚糖的存在显著提高了青花椒籽仁谷蛋白乳液的pH稳定性、离子强度稳定性以及热处理稳定性。魔芋葡甘露聚糖主要是通过增加液滴之间的静电斥力和空间斥力来提高乳液稳定性。本文结果进一步认识了多糖与蛋白乳液稳定性的作用关系和机制,同时对青花椒籽仁谷蛋白作为乳化剂在食品中的应用提供了理论基础。
