pH偏移结合温和热处理对蚕豆分离蛋白结构和功能的影响
2019-01-29周向军董瑞红高义霞
周向军,董瑞红,高义霞
(天水师范学院 生物工程与技术学院,甘肃 天水,741001)
蚕豆(ViciafabaL.),豆科巢菜属草本作物,富含淀粉、蛋白质、纤维素、维生素、矿物质、原花色素及异黄酮等生物活性物质。我国是世界上蚕豆种植面积和总产量最大的国家,分别占世界37.3%和32.6%[1]。蚕豆蛋白含量高达25%~30%[2],仅次于大豆蛋白,含有人体必需的8种氨基酸,其氨基酸组成与人体所必需氨基酸比例接近,是一种优质的植物蛋白资源[3],被认为未来最有可能取代肉类蛋白[4]。处于极端pH条件下的蛋白质,其分子内部结构首先展开,逐渐调节pH至中性后,可发生重新折叠,即pH偏移。pH偏移可使蛋白质处于变性与未变性之间的熔球态,通常保留变性前大部分二级结构,但三级结构发生较大变化,正逐渐成为食品蛋白质修饰的一种方法。LIU[5]等研究表明,pH偏移结合温和热处理,可使大豆分离蛋白质的胶凝性、表面疏水性和颗粒大小增加,巯基向二硫键转化并形成聚集体且溶解性降低,内源性荧光表明大豆分离蛋白空间结构解体,圆二色谱表明二级结构遭到轻微破坏,该技术有助于改进大豆分离蛋白的功能特性。NIU[6]等研究了天然大豆分离蛋白和pH偏移结合温和热处理后的大豆分离蛋白,以及肌原纤维蛋白热稳定性和成胶性的影响。结果表明,处理后的大豆分离蛋白,可增加肌原纤维蛋白凝胶压力和减少水分损失,处理后大豆分离蛋白可增加氢键和二硫键,原子力显微分析表明,处理后大豆分离蛋白可降低肌原纤维蛋白凝胶的粗糙性、凝胶性和持水力等。
国内有关食品蛋白的研究,主要集中在提取、理化性质、酶解工艺、抗氧化组分及活性肽制备等方面[7-11],国外则集中在溶解性、乳化性、流变学、胶凝、表面形态、构象和质构等方面[12-17],有关pH偏移结合温和热处理蚕豆蛋白的研究未见报道。本实验以pH1.5偏移结合25、37和55 ℃温和热处理不同时间后,逐渐恢复至中性,研究蚕豆分离蛋白(broad bean protein isolate,BBPI)溶解性、乳化性、巯基/总巯基含量、紫外和荧光光谱、表面疏水性、二级结构含量和微结构的变化,为BBPI在食品行业的进一步应用提供理论依据。
1 试剂与方法
1.1 材料与仪器
蚕豆蛋白:江苏盐城朱港村五谷行。8-苯胺基-1-萘磺酸钠(ANS):东京化成工业株式会社;Ellman试剂:BBI;牛血清白蛋白:生工生物工程(上海)股份有限公司;考马斯亮蓝G-250、甘氨酸、尿素、硼酸、DTNB、Tris、EDTA、磷酸二氢钠、磷酸氢二钠和正己烷等均为国产分析纯。
RF-5301PC荧光分光光度计、UV-1800紫外可见分光光度计,日本岛津;722可见分光光度计,上海欣茂有限公司;PHS-3D雷磁pH计,上海精密科学有限公司;TGL-20M型高速台式冷冻离心机,湘仪离心机仪器有限公司;AL-204型电子天平,梅特勒-托利多有限公司;90-3型定时恒温双向磁力搅拌器,上海亚荣生化仪器厂;KDF-103F自动定氮仪,上海纤检仪器有限公司; JSM-6701F冷场发射扫描电子显微镜,日本电子;Nicolet-iS5傅立叶变换红外光谱仪,美国Thermo fisher。
1.2 方法
1.2.1 BBPI制备
参照曾茂茂的方法[18],稍作修改。取50 g蚕豆粉,按料液比1∶3(g∶mL)加入正己烷,脱脂2次,5 000 r/min离心15 min,沉淀分散于1 250 mL 0.1 mol/L NaCl溶液中,调pH 7.5~8.0,40 ℃水浴搅拌3 h,5 000 r/min离心15 min,上清液调pH4.5酸沉,静置过夜。8 000 r/min离心15 min,水洗1~2次,沉淀干燥备用。经凯氏定氮法测定,BBPI蛋白含量为(77.65±0.23)%。
1.2.2 溶解性
0.1 mg/mL牛血清白蛋白0.0、0.1、0.2、0.3、0.4和0.5 mL,分别加入0.1 mg/mL考马斯亮蓝3.0 mL,混匀595 nm测光吸收值。以牛血清白蛋白质量为横坐标,光吸收值为纵坐标,绘制标准曲线。标准曲线方程为Y=10.249X+0.018 3,R2=0.992 5,X为蛋白质量,mg,Y为光吸收值。利用0.01 mol/L pH 7.0磷酸缓冲液配置5%BBPI,调pH至1.5后,分别在25、37和55 ℃条件下水浴。0、1.5、3.5和5.5 h时,取10~15 mL调pH7.0,混匀静止1 h。搅拌分散30 min后,5 000 r/min离心15 min,稀释后取0.5 mL上清液测光吸收值[19]。总蛋白含量采用凯氏定氮法测定。

(1)
1.2.3 乳化性
利用0.05 mol/L pH 7.0磷酸缓冲液配置2%BBPI,其余同1.2.2。9.0 mL 2%BBPI与3.0 mL菜籽油混合,均质3 min,立刻在底部吸取60 μL乳化液加至15 mL 0.1%SDS中,振荡混匀后在500 nm测定光吸收值,根据公式(2)计算乳化活力指数(EAI),10 min后测定光吸收值,根据公式(3)计算乳化稳定性(ESI)[20]。

(2)

(3)
式中:n,稀释倍数,250;ρ,蛋白质质量浓度,g/mL;ω,乳化液中油相体积分数(1/4);A0,0 min时吸光值;A10,10 min时吸光值;L,比色皿厚度,1 cm。
1.2.4 活性巯基测定
参照卢岩的方法[21],稍作修改。利用0.01 mol/L pH 7.0磷酸缓冲液配置2%BBPI,其余同1.2.2。1.0 mL 2%BBPI加入pH 8.0 Tris-甘氨酸溶液8.0 mL,均质后10 000 r/min离心15 min。4.5 mL上清液和0.5 mL 10 mmol/L Ellman(pH 8.0 Tris-Gly溶解)试剂反应,空白含4.5 mL Tris-Gly和0.5 mL 10 mmol/L Ellman试剂,30 min后在412和540 nm测定光吸收值。
活性巯基含量/(μmoL·g-1)= 73.53×(A412-1.693 4A540
+0.009 932)
(4)
1.2.5 总巯基测定
参照李学鹏的方法[22],稍作修改。利用0.01 mol/L pH7.0磷酸缓冲液配置2%BBPI,其余同1.2.2。1.0 mL 2%BBPI加入8.0 mL Tris-Gly溶液(含8.0 moL/L尿素),均质后10 000 r/min离心15 min。4.5 mL上清液和0.5 mL 10 mmol/L Ellman试剂反应,空白为4.5 mL Tris-Gly+0.5 mL Ellman试剂,30 min后412 nm测定光吸收值。巯基摩尔消光系数13 600 L/(mol·cm),总蛋白含量(c)测定采用凯氏定氮法。

(5)
式中:A,除去试剂空白后样品的吸光值;D,稀释倍数,9;ρ,蛋白质质量浓度,mg/mL。
1.2.6 紫外和荧光光谱
利用0.01 mol/L pH7.0磷酸缓冲液配置2.0 mg/mL BBPI,其余同1.2.2。以0.01 mol/L pH 7.0磷酸缓冲液为空白,在270~320 nm范围内进行紫外扫描,制作二阶导数谱。利用0.01 mol/L pH 7.0磷酸缓冲液配置2.0 mg/mL BBPI,其余同1.2.2。在激发波长281 nm条件下,扫描250~450 nm范围发射光谱,以波长为横坐标,荧光强度为纵坐标作图。
1.2.7 表面疏水性
参照KATO[23]法,稍作修改。利用0.01 mol/L pH7.0磷酸缓冲液配置2%BBPI,其余同1.2.2。0.02、0.04、0.06、0.08、0.10 mL上清液,用0.01 mol/L pH7.0磷酸缓冲液补至4.0 mL,加入50 μL 8.0 mmol/L ANS(0.01 mol/L pH7.0磷酸盐缓冲液溶解),混匀静置5 min。在激发波长349 nm,发射波长490 nm,夹缝均为5 nm条件下,测定荧光强度。以荧光强度对BBPI浓度作图,初始段斜率为表面疏水性指数。以时间为横坐标,表面疏水性指数为纵坐标作图。
1.2.8 电镜扫描
利用0.01 mol/L pH7.0磷酸缓冲液配置5%BBPI,调pH1.5后分别在25、37和55 ℃下水浴1.5 h后调pH 7.0,混匀8 000 r/min离心5 min,取上清液。涂片,待干后喷金扫描。
1.2.9 红外光谱分析和谱图处理
1.2.8中处理的BBPI上清液进行真空冷冻干燥。1 mg BBPI与200 mg KBr均匀混合,压片,扫描次数64次,分辨率4 cm-1,增益为1。对光谱进行水汽和二氧化碳校正,扫描范围400~4 000 cm-1,采用DTGS检测器进行红外光谱测定。采用Omnic 8.2软件在酰胺I带范围内(1 700~1 600 cm-1)进行基线校正、去卷积和二阶求导处理,并利用Peakfit 4.12软件对二阶导数曲线拟合至R2≥0.99,根据峰面积计算BBPI二级结构的百分含量。
1.2.10 数据统计
采用SPSS 16.0进行显著性分析(P<0.05),采用Origin 7.5作图。
2 结果与分析
2.1 溶解性
pH偏移结合温和热处理对BBPI溶解性的影响见图1。蛋白质溶解性取决于疏水作用力、氢键和静电力等分子间作用力,以及pH、盐种类和离子强度等外在因素。pH 1.5结合25、37和55 ℃分别处理0、1.5、3.5和5.5 h后,其时间-溶解度曲线均呈V型曲线。在0~1.5 h范围内时,各组溶解性均出现下降趋势,在1.5~5.5 h范围内时,37和55 ℃处理组溶解性明显增加(P<0.05),这是因为pH 1.5处理首先使BBPI彻底变性,疏水基团外露,分子间疏水作用迅速增强而成为主要因素,因而溶解性下降。由于BBPI等电点为4~4.2[24],继续延长处理时间,大部分BBPI带正电荷,分子间斥力逐渐成为主要因素,使BBPI与水分子间作用力增强,因此溶解性增加。与pH 7.0,25 ℃相比,各组溶解性均明显增加,且pH 1.5,55 ℃处理组溶解性最高,这是因为适度增温有利于加大分子扩散而防止聚集,但相应25和37 ℃处理组并未随时间增加呈现明显对应关系。

图1 pH偏移结合温热处理对BBPI溶解性的影响
Fig.1 Effects of pH-shifting and mild heating on solubility of BBPI
2.2 乳化性和乳化稳定性
pH偏移结合温和热处理对BBPI乳化性和乳化稳定性的影响见图2和图3。

图2 pH偏移结合温热处理对BBPI乳化性的影响
Fig.2 Effects of pH-shifting and mild heating on the emulsibility of BBPI

图3 pH偏移结合温热处理对BBPI乳化稳定性的影响
Fig.3 Effects of pH-shifting and mild heating on the emulsion stability of BBPI
当处理时间为0~3.5 h时,各组乳化性开始下降,3.5~5.5 h又逐渐增加。原因可能是经过酸处理后,BBPI形成了类似于“熔球态”结构,即其二级结构相对稳定,但其三级结构发生一定程度变化,且该变化先降低了乳化性,随后由于更多疏水氨基酸的暴露,表面活性开始逐渐增强[25]。与pH 7.0,25 ℃相比,各组乳化性几乎均出现下降,但与温度具有明显的正相关性。与pH 7.0,25 ℃相比,各组乳化稳定性均出现下降,这说明虽然pH 1.5处理可诱导BBPI空间结构逐渐展开,疏水多肽链变得更加松散,但当调节至pH 7.0时,部分展开的BBPI重新相互作用,使乳化稳定性降低[25]。pH 1.5,55 ℃处理组乳化性出现波动,原因可能是其1.5 h后少量BBPI发生聚合作用,随时间延长,界面分子柔性增加又使得乳化稳定性逐渐增强。
2.3 活性巯基和总巯基
pH偏移结合温和热处理对BBPI活性巯基和总巯基含量的影响见图4和图5。对巯基而言,在0~1.5 h范围内,各组巯基含量逐渐增加,此时BBPI内部巯基暴露速度快于新二硫键生成速度。在1.5~5.5 h范围内时,各组变化无明显规律:pH 1.5,25 ℃处理组的巯基含量增加不明显(P>0.05),这可能是分子内巯基和二硫键交换比较频繁所致,pH 1.5,37 ℃组继续增至最大值,3.5 h后开始下降,pH 1.5,55 ℃组则1.5 h后迅速下降(P<0.05),这说明适度增温(37和55 ℃)均易加速巯基氧化或巯基与二硫键交换,从而使巯基含量出现下降趋势[26]。

图4 pH偏移结合温热处理对BBPI巯基含量的影响
Fig.4 Effects of pH-shifting and mild heating on sulfhydyyl content of BBPI

图5 pH偏移结合温热处理对BBPI总巯基含量的影响
Fig.5 Effects of pH-shifting and mild heating on total sulfhydryl content of BBPI
对总巯基而言,其含量约为巯基含量10倍以上,原因是长时间极端酸性条件处理,BBPI结构充分展开使内部巯基暴露,也可能是BBPI亚基解离,二硫键断裂生成巯基所致,这与HWANG报道一致[27]。在0~3.5 h范围内,pH 1.5,25 ℃和pH 1.5,55 ℃处理组的总巯基含量变化不明显(P>0.05),随时间延长,总巯基含量开始下降。而pH 1.5,37 ℃组则在0~1.5 h范围内,总巯基含量先增加,随后明显下降,这说明25和55 ℃处理一定时间后,巯基和二硫键相互转化几乎处于平衡,而37 ℃处理则首先表现为二硫键的氧化程度超过巯基还原,随时间延长,巯基还原程度又逐渐超越二硫键的氧化,因此总巯基含量下降。
2.4 紫外二阶导数光谱
由于Phe、Tyr和Trp在280 nm处均有较强吸收,导致峰信号重叠而难以辨认,因此可利用紫外二阶导数光谱描述其对应的结构变化[28]。pH 1.5偏移结合温和热处理对BBPI紫外二阶导数光谱的影响见图6(25 ℃)、图7(37 ℃)和图8(55 ℃)。在280~300 nm范围内,未处理组BBPI出现两个正吸收峰(289 nm和295 nm)和两个负吸收峰(285 nm和291 nm)。295 nm处正吸收峰是色氨酸的贡献[29]。当pH 1.5偏移结合25 ℃处理不同时间后,BBPI在295 nm处发生1~2 nm红移。随时间延长,峰谷与峰顶距离比(r=a/b)先增加后减小,这表明,pH1.5偏移结合温和热处理后,BBPI三级结构发生一定程度包裹,原来暴露在分子表面的Trp残基重新包裹于BBPI疏水核心[30]。当pH 1.5,37 ℃处理不同时间后,BBPI在295 nm处发生1~2 nm蓝移,且峰谷与峰顶距离比增加,表明部分已暴露的Trp残基开始发生解折叠而暴露于分子表面。pH 1.5+55 ℃处理不同时间后,BBPI在295 nm处未发生明显移动,峰谷与峰顶距离比未有明显规律。

图6 pH偏移结合温热处理对BBPI紫外二阶导数光谱的影响
Fig.6 Effects of pH-shifting and mild heating processes on UV second derivative spectra of BBPI

图7 pH偏移结合温热处理对BBPI紫外二阶导数光谱的影响
Fig.7 Effects of pH-shifting and mild heating processes on UV second derivative spectra of BBPI
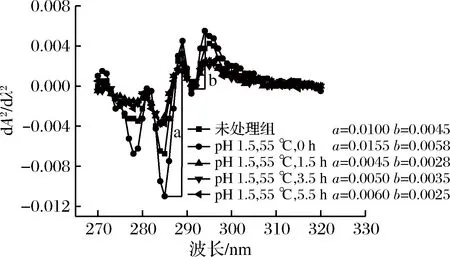
图8 pH偏移结合温热处理对BBPI紫外二阶导数光谱的影响
Fig.8 Effects of pH-shifting and mild heating processes on UV second derivative spectra of BBPI
2.5 荧光光谱
pH偏移结合温和热处理对BBPI荧光光谱的影响见图9(25 ℃)、图10(37 ℃)和图11(55 ℃)。各组内源性荧光强度均低于未处理组,这充分说明pH1.5偏移结合温和热处理不同时间后,均可使BBPI分子表面Trp等残基进一步包裹在分子内部疏水核心,即BBPI倾向于重折叠。对pH 1.5,25 ℃组,随时间延长,荧光强度先降低后增强,且发生一定程度红移,这可能是由于BBPI或其亚基在强酸性条件下,部分Trp疏水侧链首先发生暂时聚集,包裹在BBPI分子内部非极性环境中,从而导致荧光强度下降。随时间延长,其又逐渐暴露在分子表面极性环境中,但仍处于不稳定状态。这说明pH 1.5偏移结合25 ℃低温处理时,在0~5.5 h范围内,BBPI色氨酸侧链的聚集或暴露仍未达到平衡。对pH 1.5,37 ℃组,荧光强度先逐渐增加后又明显降低,且均低于未处理组;对pH 1.5,55 ℃处理组,在0~1.5 h范围内,荧光强度显著降低,随后继续增加处理时间,荧光强度降至恒值,这说明pH 1.5偏移处理时,适当提高温度可使BBPI彻底聚集,处理时间不影响荧光强度。

图9 pH偏移结合温热处理对BBPI荧光光谱的影响
Fig.9 Effects of pH-shifting and mild heating processes on fluorescence spectra of BBPI

图10 pH偏移结合温热处理对BBPI荧光光谱的影响
Fig.10 Effects of pH-shifting and mild heating processes on fluorescence spectra of BBPI

图11 pH偏移结合温热处理对BBPI荧光光谱的影响
Fig.11 Effects of pH-shifting and mild heating processes on fluorescence spectra of BBPI
2.6 表面疏水性
pH偏移结合温和热处理对BBPI表面疏水性的影响见图12。表面疏水性反映蛋白质三级结构中表面疏水基团的分布情况,可影响溶解度、吸水性、乳化性和凝胶性等其他功能性质。ANS是一种带负电荷的阴离子探针,在pH 1.5酸性条件下,不仅和蛋白质表面带正电荷氨基酸残基通过静电相互作用而结合,且可蛋白质表面暴露的疏水区域相结合,因此表面疏水性指数不仅反映的是BBPI表面疏水性,同时也反映了ANS与BBPI分子间的静电引力[31]。温度是影响BBPI结构的重要因素,长时间50 ℃以上处理,BBPI分子结构可发生重排,但不同的蛋白质,可能呈现不同规律[32]。总体分析,pH 1.5偏移处理下,BBPI表面疏水性变化较为复杂,表明为其稳定性较差[33]。在0~1.5 h范围内,各组表面疏水性均急剧增加,随时间延长,除pH 1.5,55 ℃组外,其余两组均显著降低,原因可能是当pH 1.5偏移处理后,包裹在蛋白质分子内部的疏水侧链暴露在分子表面,蛋白质疏水性增强,但随时间延长,蛋白质并非只有一种结构模式,BBPI展开后再聚集,依赖于疏水侧链间相互作用而包埋在分子内部[34-35],从而降低了表面疏水性。在3.5~5.5 h范围内,pH 1.5,55 ℃组表面疏水性反而增加,原因可能是BBPI分子中α螺旋含量较小,约为15%[36],而有证据表明α螺旋含量可能与温度对表面疏水性指数的影响有关[32]。当温度超过50 ℃时且经过3.5 h长时间处理后,β折叠作为分子间有序排列被不同程度破坏,α螺旋作为分子内有序排列而增强[37],因而表面疏水性增加。表面疏水性与溶解性几乎呈负相关性,这主要是溶解性取决于BBPI分子亲水性和疏水性的平衡,该平衡又取决于氨基酸组成,特别是分子表面氨基酸组成[34]。NAKAI[38]等研究认为,表面疏水性与乳化性成正相关,本研究结果与其一致。

图12 pH偏移结合温热处理对BBPI表面疏水性指数的影响
Fig.12 Effects of pH-shifting and mild heating on surface hydrophobicity index of BBPI
2.7 二级结构含量测定
不同pH和温和热处理对BBPI二级结构含量的影响见表1。一般情况下,1 600~1 639 cm-1和1 689~1 699 cm-1谱带归属于β-折叠,1 640~1 650 cm-1谱带归属于无规则卷曲,1 651~1 660 cm-1谱带归属于α-螺旋,1 661~1 688 cm-1谱带归属于β-转角[39]。由表1可知,BBPI各二级结构含量依次为:对pH 7.0,25 ℃处理组,β-折叠34.79%,α-螺旋50.63%,β-转角14.59%;对pH 1.5,25 ℃处理组,β-折叠53.07%,无规则卷曲8.28%,α-螺旋6.28%,β-转角32.37%;对pH 1.5,37 ℃处理组,β-折叠53.07%,无规则卷曲8.28%,α-螺旋6.29%,β-转角32.36%;对pH 1.5,55 ℃处理组,无规则卷曲58.06%,β-转角41.94%。由上述分析可知,在25~37 ℃范围内,pH 1.5偏移处理可使α-螺旋向β-折叠、β-转角和无规则卷曲转化,当增至55 ℃时,α-螺旋和β-折叠全部转化为β-转角和无规则卷曲。α-螺旋和β-折叠为BBPI的有序结构,β-转角和无规则卷曲为无序结构,随温度不断增加,BBPI的α-螺旋和β-折叠百分含量之和呈明显降低趋势,这表明BBPI稳定性逐渐降低。

表1 不同pH和温和热处理对BBPI二级结构含量的影响
2.8 电镜扫描
图13~图16分别为BBPI在pH 7.0,25 ℃、pH 1.5,25 ℃,pH 1.5,37 ℃和pH 1.5,55 ℃条件下,处理1.5 h时扫描电镜下的形貌。由图13~图16可知,不同温度处理下,BBPI均形成大小不均匀的球状体,粒径约为80~130 nm。各球状体存在团聚现象,形成“沟壑”,如A、B、C区域所示,随温度增大,团聚现象降低,可能与溶解性增强有关,但球体粒径较为接近。与pH 7.0,25 ℃处理组比较,pH 1.5,25 ℃形貌变化不大,可能是1.5 h处理时间较长,不同程度抵消了pH 1.5处理对BBPI形貌等的影响。

图13 pH 7.0,25 ℃条件下BBPI形貌
Fig.13 Morphology of BBPI at pH 7.0,25 ℃

图14 pH 1.5,25 ℃条件下BBPI形貌
Fig.14 Morphology of BBPI at pH 1.5,25 ℃

图15 pH 7.0,37 ℃条件下BBPI形貌
Fig.15 Morphology of BBPI at pH 7.0,37 ℃

图16 pH 7.0,55 ℃条件下BBPI形貌
Fig.16 Morphology of BBPI at pH 7.0,55 ℃
3 结论
(1)随时间延长,BBPI溶解性和乳化性均先降低后增加,但与pH 7.0,25 ℃处理组相比,各组溶解性均增加,乳化性几乎均下降。乳化性随温度的升高而增强,但溶解性并不完全与温度成正比。随时间延长,乳化稳定性无明显规律,但均随温度增加而逐渐增强,37和55 ℃处理组巯基含量先增加后降低,25 ℃处理组则变化不大,37 ℃处理组总巯基含量先增加后迅速下降,25和55 ℃先平稳后降低。
(2)紫外和荧光光谱表明,随时间延长,25 ℃处理组的大部分色氨酸残基包裹在分子内部疏水微环境,发生1~2 nm红移动,37 ℃处理组表现为色氨酸残基开始部分性解折叠,色氨酸残基又逐渐暴露在分子表面,发生1~2 nm蓝移,55 ℃处理组则未有明显变化。
(3)结果表明,BBPI的表面疏水性与溶解性呈负相关,与乳化性成正相关。25和37 ℃处理时,BBPI的表面疏水性先增加后降低,55 ℃处理则先增加后出现一定波动。
(4)随温度升高,BBPI二级结构中的α-螺旋和β-折叠逐渐转化为β-转角和无规则卷曲。随温度升高,BBPI电镜扫描均形成粒径约为80~130 nm的球状体,且存在团聚和“沟壑”现象,但团聚现象逐渐降低。
(5)由于未变性或完全变性的蛋白具有相对较强的热稳定性,功能特性并不十分理想,而通过pH偏移结合温和热处理改性处理,BBPI构象发生一定程度变化而形成熔球态,则有望进一步改善其起泡性、溶解性、乳化性、成胶性和成膜性等功能性质,这将有助于进一步提高BBPI的应用价值和拓展其应用范围。
