高效液相色谱电喷雾电离串联质谱法测定植物性食品中氟虫腈及其代谢物的残留
2019-01-28李敏青安文佳孙灵慧
李敏青,徐 娟,*,王 岚,安文佳,庄 嘉,孙灵慧
(1.广东检验检疫技术中心,广东广州 510623;2.广东省动植物与食品进出口技术措施研究重点实验室,广东广州 510623)
氟虫腈是一种苯基吡唑类广谱杀虫剂,可用于防治跳蚤、虱子、蟑螂、螨、蚂蚁等虫害,因此在各种农作物生产上得到非常广泛的应用。但研究表明,该药具有慢性神经毒性作用,短期摄取大量氟虫腈会对神经系统造成不良影响,长期摄取可能会损害肝脏、肾脏和甲状腺[1-2]。在正常使用下,氟虫腈代谢产物主要有MB 45950(氟虫腈硫醚)、MB 46136(氟虫腈砜)、MB 46513(氟甲腈),都具有一定毒性,有的毒性甚至高于母体[3]。国际食品法典(CAC)、中国香港、日本肯定列表中规定,氟虫腈在粮谷作物或茶叶中的最大残留限量为0.002 mg/kg;而中国台湾相关标准规定部分蔬果和谷类的氟虫腈最大残留限量为0.001 mg/kg;澳大利亚、美国、欧盟、新西兰相关标准规定,氟虫腈(含氟虫腈硫醚,氟虫腈砜和氟甲腈)在植物源食品中的最大残留限量为0.005 mg/kg[4-6]。
目前,氟虫腈的检测方法主要有气相色谱法[7]、气相色谱-质谱法[8]和液相色谱-串联质谱法[9-10],而LC/MS-MS兼具灵敏度高、选择性强的优势,广泛应用于农兽药残留的检测。基于样品基体复杂多样,且尚有的文献中关于植物性食品中氟虫腈及其代谢物残留的检测方法不全面,针对已有报道存在的不足,依据EN15662方法中对于分析农药残留的样本做出的详细规定,将植物性食品分为含水样品(含水量≥80%)、含色素样品、干性样品(谷物、茶叶)。本文选择含水样品(苹果)、含水量低样品(香蕉)、含色素样品(菠菜)、干性样品(大米、茶叶)、含油脂的干性样品(大豆)共6种代表性基质,系统优化了QuEChERS方法提取及净化步骤[11-13]。因此,本文建立了简单、快速且灵敏度高的检测方法,能够及时应对大批量植物性食品中氟虫腈的检测任务,满足目前检测的实际要求。
1 材料与方法
1.1 材料与仪器
乙腈、甲醇、乙酸乙酯、丙酮为色谱纯 美国TEDIA公司;无水硫酸镁(MgSO4)、氯化钠(NaCl)、二水合柠檬酸钠、倍半水合柠檬酸二钠 分析纯,美国Sigma-Aldrich,Missouri;C18、PSA dSPE分散剂 分析纯,迪马科技公司;固相萃取柱GCB/PSA(200 mg/200 mg,3 mL)、Carbon-GCB(250 mg,3 mL) 上海安谱公司;微孔滤膜 0.22 μm,津腾公司;实验用水为经Milli-Q纯水系统制得的超纯水(电阻率为18.2 MΩ);氟虫腈及其代谢物标准物质 纯度≥98.0%,Dr.Ehrenstorfer公司;菠菜、苹果和香蕉等实际样品 均购于广州市大型超市。
TSQ Quantiva串联三重四级杆质谱仪、Ultimate 3000液相色谱仪 美国Thermo Fisher公司;Milli-Q高纯水发生器 美国Millipore公司;Sigma-3-18K高速低温离心机 德国Sigma公司;XP205分析天平(感量0.01 g和0.0001 g) 瑞士Mettler公司;MiltiReax型涡旋振荡器 德国Heidolph公司;多样品快速浓缩仪 瑞典BiotageTurboVap®LV;Promax-2020型水平往复振荡器 德国Heidolph公司。
1.2 实验方法
1.2.1 提取 干性样品:大米、大豆称取5.0 g于50 mL离心管,茶叶称取2.5 g于50 mL离心管,干性样品预先加10 mL水,涡旋1 min,静置15 min待充分溶胀后,加入10 mL乙腈,振荡5 min,加入QuEChERS提取盐包(CEN EN-15662,内含0.5 g倍半水合柠檬酸二钠,1 g柠檬酸钠,1 g氯化钠,4 g无水硫酸镁),迅速摇匀,往复水平振荡10 min,4500 r/min离心5 min,取出待净化。
果蔬样品:称取果蔬样品10.0 g置于50 mL离心管,加入10 mL乙腈,振荡5 min,加入QuEChERS提取盐包(CEN EN-15662)迅速摇匀,往复水平振荡10 min,4500 r/min离心5 min,取出待净化。
1.2.2 净化 苹果、香蕉、大米:称取50 mg PSA(乙二胺-N-丙基硅烷)和150 mg无水硫酸镁置于高速离心管,吸取待净化上清液1 mL于其中,充分混合,12000 r/min离心5 min后吸取上清液0.5 mL于小管,加入0.5 mL实验用水定容至1 mL,涡旋混匀,过滤膜(0.22 μm),装瓶,供高效液相色谱-串联质谱仪测定。
大豆、菠菜、茶叶:吸取待净化上清液1 mL过GCB/PSA固相萃取柱,弃去流出液,再加入2 mL上清液过GCB/PSA固相萃取柱并收集滤液。吸取滤液0.5 mL于小管,加入0.5 mL实验用水定容至1 mL,涡旋混匀,过滤膜(0.22 μm),装瓶,供高效液相色谱-串联质谱仪测定。
1.3 仪器条件
1.3.1 液相色谱条件 色谱柱:Thermo Accucore aQ(2.6 μm,2.1×150 mm);柱温:40 ℃;进样量:2 μL;流速:0.3 mL/min;运行时间:10 min;流动相:A-甲醇、B-水,组成的流动相进行梯度洗脱,洗脱程序见表1。

表1 流动相梯度洗脱程序Table 1 Mobile phase composition forlinear gradient elution
1.3.2 质谱条件 电喷雾离子源(ESI);扫描方式:负离子扫描;检测方式:多反应监测模式(MRM);电喷雾电压(V):3000;鞘气(Sheath Gas):40 Arb;辅助气(Aux Gas):10 Arb;吹扫气(Sweep Gas):0 Arb;离子源温度(TEM):350 ℃;传输管温度(TEM):350 ℃。各目标物的保留时间、母离子和子离子、碰撞能量见表2。

表2 各目标化合物的质谱参数Table 2 HPLC-MS/MS parameters for quantitation and confirmation
1.4 提取溶剂的比较
根据氟虫腈是极性较强的一种物质,按照相似相溶原理,结合样品基质的特性,本文选取了常用的4种一元溶剂:乙腈、丙酮、乙酸乙酯、甲醇进行比较。按1.2.1节所述方法分别加入4种提取溶剂(所有提取溶剂均为10 mL)进行提取,4500 r/min离心5 min后吸取0.5 mL提取液于小管以吹氮浓缩仪在40 ℃下转换成乙腈溶剂(少于0.5 mL),加入0.5 mL实验用水,用乙腈定容至1 mL,涡旋摇匀后过0.22 μm滤膜,检测回收率。
1.5 提取时间的比较
在使用往复水平振荡作为提取方式下,确定最佳提取时间,以便实验操作起来高效稳定,分别比较了水平振荡5、10、15 min的提取效率。按1.2.1节所述方法加入乙腈进行提取,分别往复水平振荡5、10、15 min,离心后吸取0.5 mL提取液于小管,加入0.5 mL实验用水定容至1 mL,涡旋摇匀后过0.22 μm滤膜,检测回收率。
1.6 净化条件的比较
本实验比较了4种常见的净化方式:A.dSPE1高速离心管(每管含150 mg MgSO4和50 mg PSA);B.dSPE2高速离心管(每管含100 mg MgSO4、50 mg PSA和50 mg C18);C.Carbon-GCB SPE小柱(250 mg,3 mL);D.GCB/PSA SPE小柱(200 mg/200 mg,3 mL)。按1.2.1节所述方法进行提取,离心后需吸取1 mL乙腈提取液加入A和B方案中的d-SPE高速离心管,充分混合;吸取1 mL乙腈提取液润湿C和D方案中的SPE小柱,SPE柱润湿后弃去流出液,再加入2 mL提取液过柱并收集滤液,最后吸取0.5 mL净化液,加入0.5 mL实验用水定容至1 mL,涡旋摇匀后过0.22 μm滤膜,检测回收率。
1.7 质谱条件的确定
分别将0.5 mg/L的目标物标准溶液用蠕动泵以10 μL/min的流速连续注射进入ESI离子源,在负离子模式下进行质谱分析,确定质谱仪器采集目标物时的各目标物质谱参数和仪器条件。
1.8 液相色谱条件的比较
在质谱参数确定的相同条件下对液相条件进行优化,选用了Thermo Accucore aQ(2.6 μm,2.1×150 mm)色谱柱,比较了3组不同组成的流动相,分别为乙腈-水溶液、甲醇-水溶液、甲醇-5 mmol/L甲酸铵+0.1%甲酸水溶液,最终确定对目标物分离效果和灵敏度最优的一组流动相。
1.9 六种植物性食品中氟虫腈及其代谢物的测定
1.9.1 标准溶液配制 准确称取各物质标准品10.0 mg于10.0 mL容量瓶中,乙腈稀释至刻度,配制成各标准物质浓度为1000.0 mg/L的标准储备液,该储备液置于-18 ℃冰箱中保存,保存期两年。标准曲线的配制:本实验考察基质效应对于目标物响应值的影响,发现不同基质对于响应存在不同程度的抑制,故本实验采用空白基质配制标准曲线,以尽可能的消除基质效应的影响。采用空白基质(苹果、香蕉、大米、大豆、菠菜和茶叶),经1.2节提取净化,分别配制成一系列标准曲线(0、0.1、0.2、0.5、1和5 μg/L),现配现用。
1.9.2 基质效应 在本研究中选择了简略的标准曲线法对基质效应进行了考察,对不含待测组分的苹果、香蕉、大米、大豆、菠菜、茶叶阴性样品,经1.2节前处理后,对得到的相应基质净化液配制浓度一致的系列标准曲线,以化合物的响应值对相应浓度绘制标准曲线。
1.9.3 线性范围和检出限 本研究采用相应基质匹配标准曲线进行校准定量,配成一系列标准曲线(0、0.1、0.2、0.5、1和5 μg/L),以仪器响应峰面积对各目标化合物的质量浓度绘制基质标准曲线。
1.9.4 添加回收实验 在苹果、香蕉、大米、大豆、菠菜和茶叶6种空白样品中进行3个水平的加标回收实验,添加量为每种化合物1.0、2.0、4.0 μg/kg,每个水平均重复6次,以1.2和1.3节所述方法进行回收率实验和精密度实验。
1.9.5 实际样品测定 按照1.2和1.3节所述方法对市售的100份蔬菜、50份水果、10份粮谷、10份茶叶进行氟虫腈及其代谢物的检测。
1.10 数据处理
上述数据经由美国Thermo Fisher公司TraceFinder EFS软件和Excel统计分析所得,计算标准误差并制图。
2 结果与分析
2.1 提取溶剂的选择
在所选提取溶剂用量一致(10 mL)的情况下,结果表明,乙酸乙酯和甲醇提取氟虫腈及其代谢物的回收率均小于60%,而乙腈和丙酮的提取效率均较好,且回收率较高,但考虑到本文所选用的样品基质较为复杂多样,如果用丙酮提取,样品基质中的大量色素、蜡质及脂肪等非极性成分进入提取液,使后面的净化操作比较繁琐,而乙腈则相对不容易提取上述杂质,提取液净化操作简便[14]。其次,对于干性样品提取前需加入水使其充分浸湿溶胀,以保证提取溶剂与样品充分接触;再次,借助QuEChERS CEN EN-15662提取盐包的作用,无水硫酸镁吸水同时放热,使萃取液温度更适合农药萃取,同时离心促使了样品和乙腈提取层很好的分离效果,这样既可以提高对目标物的提取效率,又可以减少样品基质中主要干扰杂质的溶入量,对后续的净化步骤有利。鉴于上述,故本方法最终采用乙腈溶液提取,操作简单,净化效果显著,提取效率高。
2.2 提取时间的选择
综合6种植物性食品的提取时间结果表明,见图1(以茶叶为例)水平振荡15 min的提取效率并没有明显的优势,因此,本文确定往复振荡10 min足以达到较高的提取效率。
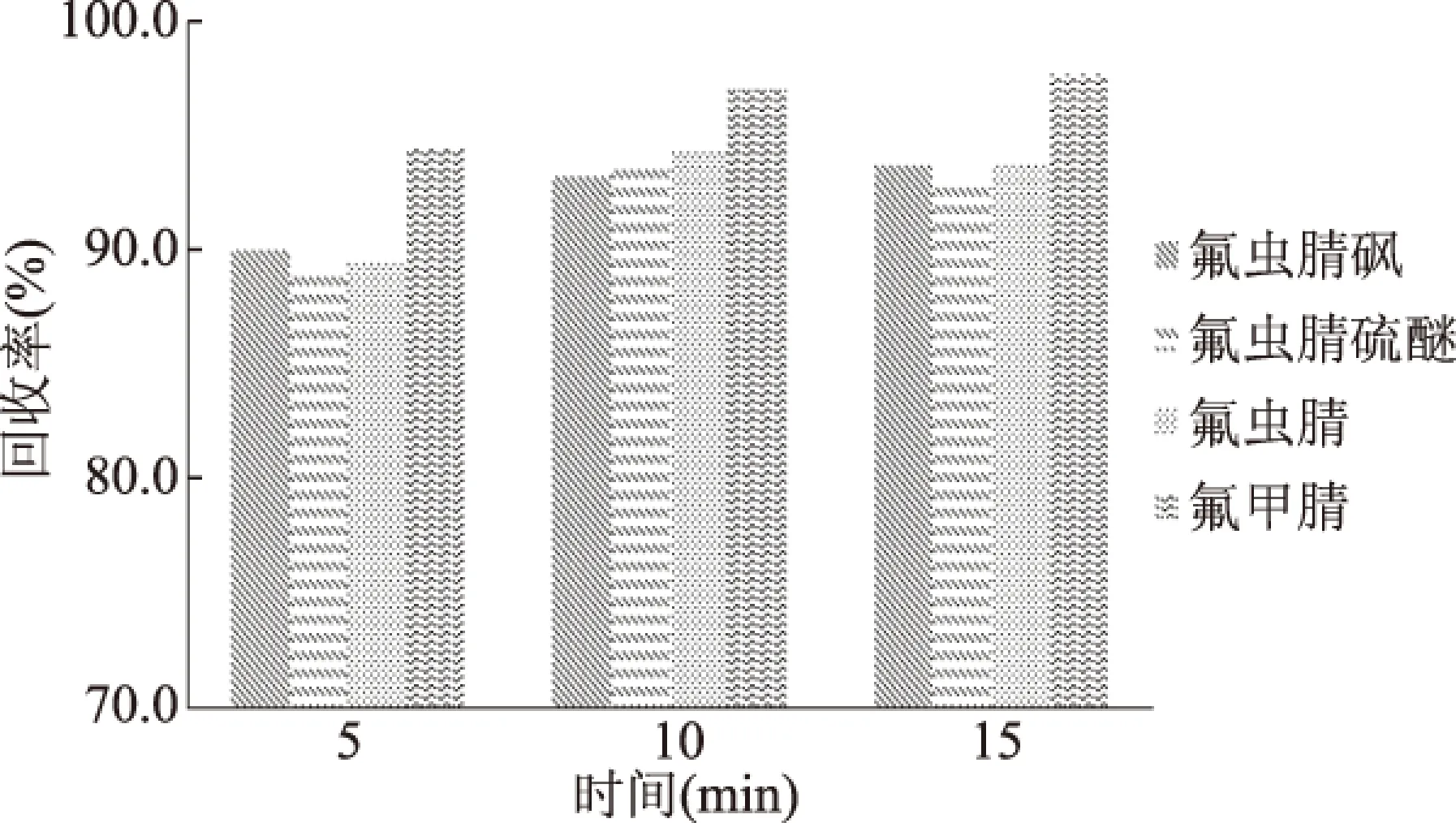
图1 不同提取时间对目标物回收率的影响(茶叶为例)Fig.1 Effect of different extraction time on target recovery rate(tea as an example)
2.3 净化条件的选择
尽管经过QuEChERS提取步骤,但仍有一些极性和中等极性的杂质也被提取到乙腈中,如有机酸、色素、维生素等,针对这些杂质的性质,实验比较了4种常见的净化方式,通过回收率数据可以发现,不同净化剂均对不同样品有不同程度的净化效果,结果如图2所示。对于苹果、香蕉、大米这三种基质,采用A方案和B方案均得到较佳的回收,综合考虑价格成本后,本文推荐选用A方案净化方式即可满足要求。但对于含色素较多的菠菜、茶叶以及含较多脂肪的大豆,则是采用GCB/PSA复合小柱的净化效果明显优于其他3种吸附剂,这是由于GCB(石墨化炭黑)对平面结构分子有很强的亲和性,对固醇、叶绿素、咖啡碱和儿茶素等杂质的去除能力较强;PSA吸附剂则是能有效除去来自样品共萃取物中的脂肪酸、某些极性亲脂性色素和糖类等。因此,本文选用GCB/PSA复合小柱作为大豆、菠菜、茶叶的净化手段。

图2 净化条件的优化实验Fig.2 Optimization of SPE-recovery
2.4 质谱条件确定
用蠕动泵以10 μL/min的流速连续注射,分别将0.5 mg/L的目标物标准溶液注入ESI离子源,在负离子模式下进行一级质谱分析(Q1扫描),得到准分子离子峰[M-H]-峰,确定母离子后,对离子源温度、去簇电压、鞘气、辅助气等参数进行优化,使其一级扫描响应达到最高。再对准分子离子峰进行二级质谱分析,得到响应较高的2个碎片离子分别作为定量离子和定性离子和各自对应的碰撞能量。
2.5 色谱条件的确定
根据氟虫腈及其代谢物的化学结构,本文比较了3组不同组成的流动相,研究表明,甲醇-水溶液体系下氟虫腈及其代谢物的分离效果和灵敏度要高于乙腈-水、甲醇-5 mmol/L甲酸铵+0.1%甲酸水溶液。故本项目采用甲醇-水溶液通过梯度洗脱,得到氟虫腈及其代谢物的MRM谱图,如图3所示。
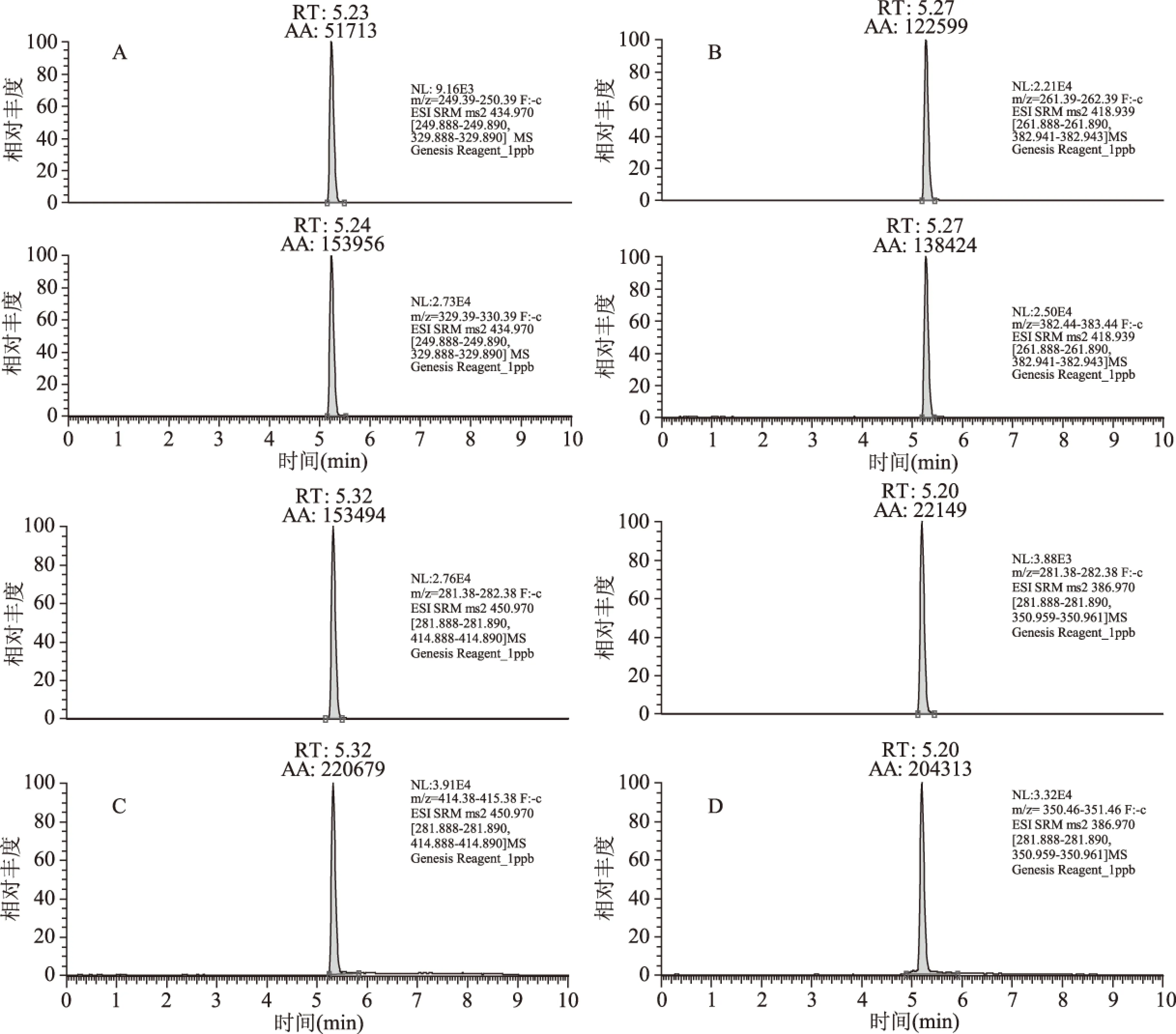
图3 4种化合物标准溶液的多反应监测(MRM)色谱图(1.0 μg/kg)Fig.3 MRM chromatograms of 4 compounds(1.0 μg/kg)注:A.氟虫腈;B.氟虫腈硫醚;C.氟虫腈砜;D.氟甲腈。
2.6 基质效应
液相色谱-电喷雾电离(ESI)-串联质谱法越来越多应用在食品安全检测领域,ESI源离子化有明显的基质效应(matrix effect,ME),即样品溶液中的基质成分对分析物的离子化有抑制或增强作用,从而影响测定结果的精密度和准确度。一般采用同一来源的空白样品配制系列标准溶液,使标准溶液和样品溶液具有同样的离子化条件从而消除基质效应给质谱定量带来的影响[14]。
通过对标准曲线斜率的比较发现(见图4),不同基质对于不同化合物的确存在基质效应,且绝大多数表现为抑制效应。实验结果表明,茶叶的基质效应最大,菠菜次之。因此有必要采用相近空白基质配制标准曲线对样品进行准确定量。

图4 液相色谱-串联质谱的基质效应考察(氟虫腈为例)Fig.4 Matrix effect of LC-MS/MS(fipronil as an example)

表3 线性方程、相关系数及加标回收率、精密度(n=6)Table 3 Linear equations,correlation coefficients,average recoveries,relative standard deviation(RSD)
2.7 线性范围和检出限
采用相应基质匹配标准曲线进行校准定量,以仪器响应峰面积对各目标化合物的质量浓度进行线性回归,线性关系良好(R2≥0.999)。依据3倍信噪比峰面积对应的4种化合物含量为定性限,10倍信噪比峰面积对应的化合物含量为定量限,经检测计算,对于4种分析物的LOD均为0.02 μg/kg,LOQ为0.1 μg/kg。当实际样品中的某化合物有检出,应当采用相应的空白基质配制标准曲线对其进行定量,若含量超过线性范围时,可适当加大样品的稀释倍数,并依据SANTE/11945/2015进行定性和定量[15]。
2.8 方法回收率和精密度
本实验依据欧盟SANTE/11945/2015进行方法验证,结果表明所建方法重复性良好,平均回收率为91.5%~101.5%,RSD为0.47%~3.88%,能够满足氟虫腈及其代谢物同时分析的要求。
2.9 实际样品测定
对市售的蔬菜、水果、粮谷、茶叶进行氟虫腈及其代谢物的检测,结果在2批次小白菜、1批次草莓中检出氟虫腈及其代谢物,按照GB2763-2016《食品安全国家标准食品中农药最大残留限量》的要求,氟虫腈及其代谢物之和以氟虫腈表示,计算后浓度范围均在0.051~0.153 mg/kg,均为不合格样品。
3 结论
本研究基于国际食品法典及我国主要贸易国和地区对植物性食品中氟虫腈及其代谢物的限量要求,建立QuEChERS净化技术结合高效液相色谱-电喷雾电离串联质谱法快速测定植物性食品中氟虫腈及其代谢物的残留量。目前,本方法已应用于日常检测工作,通过一段时间对大量样品的检测,证实了该方法的稳定有效,而且在市售样品中已检出阳性样品,对保护消费者的食品安全起到一定作用,该方法操作简单、可靠、稳定,能够满足日本、欧盟等主要贸易国和地区的限量要求,有效避免了可能发生的贸易摩擦和损失。
