屠宰猪中大肠杆菌毒力基因检测及耐药性分析
2019-01-28周陆红张鹏飞吴聪明唐晓双
周陆红,张鹏飞,张 杰,吴聪明,唐晓双,郝 丹,王 新,
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.中国农业大学动物医学院,北京 100193)
大肠杆菌(Escherichia coli)是存在于人和动物肠道的一种常见杆状细菌,属于条件致病菌,少数获得特殊毒力因子的大肠杆菌可引起人畜共患病,因此其也是食品中重要的卫生指标菌[1]。大肠杆菌依其致病机制可分为3 类:共生型、肠内致病型和肠外致病型,其中致病型大肠杆菌不仅对人体健康造成极大威胁,同时会造成严重的经济损失[2]。猪大肠杆菌病中最常见的是仔猪黄痢、仔猪白痢及水肿病,但近几年国外的研究中相继报道了肠外致病性大肠杆菌(extraintestinal pathogenic Escherichia coli,ExPEC),其可严重致病,致使不同宿主发生脑膜炎、败血症、泌尿道感染和呼吸道感染[3-5]。同时,由于在生产过程中抗生素的大量、不合理的使用,使得猪源大肠杆菌的耐药种类逐渐增多,多重耐药现象也愈加严重。现有研究已经证实,耐药菌株可以通过食品在人与动物中转移,质粒等可移动元件还可以介导耐药基因转移[6-8]。
因此,本研究从3 个省市采集的样品中分离鉴定出大肠杆菌,对其进行毒力因子检测、种群分型及药敏实验,同时得出肠外致病型大肠杆菌比例,从而为揭示大肠杆菌的致病机理提供依据,并通过其耐药性的检测来评估屠宰猪中大肠杆菌的耐药流行情况,并为其合理用药提供依据,从而保障公共健康安全。
1 材料与方法
1.1 材料与试剂
缓冲蛋白胨水、伊红美兰琼脂、麦康凯琼脂、乳糖胆盐发酵培养基、LB琼脂培养基、LB肉汤培养基、MH琼脂、IMViC实验试剂 北京陆桥技术有限责任公司;抗生素 美国Sigma公司;Taq酶、Mg2+Buffer、dNTP大连宝生物(TaKaRa)公司;引物由生工生物工程(上海)股份有限公司合成;药敏实验所用标准菌株ATCC 25922和ATCC 25923由中国食品药品检定研究院崔生辉博士惠赠。
1.2 仪器与设备
NU-425-400E超净工作台 苏州安泰空气技术有限公司;Mycircle聚合酶链式反应(polymerase chain reaction,PCR)基因扩增仪、GEL DOC XR凝胶成像系统 美国伯乐公司;Milli-Q Synthesis超纯水机德国Merck Millipore公司;微量移液枪 德国艾本德股份公司;GNP-9080隔水式恒温培养箱 上海精宏实验设备有限公司;MDF-U5411高压灭菌锅 上海申安高压仪器设备有限公司。
1.3 方法
1.3.1 样品的分离鉴定
样品来源于陕西、重庆以及河南的猪屠宰场,采用无菌棉签擦拭猪的肠外组织(肺、心血、脾等),每只猪选取1~3 个器官部位采样。采集好的棉拭子装入无菌采样袋中,将样本放入装有冰袋的采样箱中,随后直接运往西北农林科技大学进行大肠杆菌的分离鉴定。样品的分离鉴定参照Wang Xin等[9]方法,棉拭子在装有5 mL缓冲蛋白胨水肉汤的无菌试管中于37 ℃培养18~24 h。从增菌液中划线接种于麦康凯琼脂平板上,在37 ℃培养18~24 h,随后挑取1 个或2 个疑似菌株划线于伊红美兰琼脂平板进一步纯化鉴定,37 ℃培养18~24 h后,选取紫黑色带金属光泽的单菌落继续在LB平板上进行纯化。随后进行IMViC实验,结果“++――”者认定为大肠杆菌。分离出的菌株进行PCR扩增uidA基因鉴定,并将鉴定出的菌株在冻存管中于-80 ℃保存。
1.3.2 毒力基因测定
本实验采用Johnson等[10]研究中使用的5 种毒力基因:sfa/foc(S和F1C菌毛),papA和papC(P菌毛),iutA(螯铁蛋白受体),afa/dra(Dr抗原结合位点)和kpsMT II(II型荚膜多糖),进行毒力因子的检测。以上5 种毒力基因中可鉴定出2 种及以上,则可定义为ExPEC。本研究中所用的引物序列见表1。

表1 PCR引物序列Table1 Primer sequences used for PCR
1.3.3 种群分型
Clermont等[11]研究建立了一种新型种群分型方法,便捷快速。即采用PCR方法扩增可以区分不同种群大肠杆菌的3 个基因:chuA、yjaA和TspE4.C2。菌株chuA和TspE4.C2基因扩增结果均为阴性称为A群系,chuA扩增结果阴性而TspE4.C2阳性称为B1群系,chuA和yjaA均是阳性称为B2群系,chuA阳性而yjaA阴性称为D群系。而据其基因扩增结果,可将大肠杆菌分为A、B1、B2和D群系。
1.3.4 药敏性实验
参照临床实验室标准化研究所推荐的琼脂稀释法执行抗生素的药敏性实验,本研究选取常用的12 种抗生素,如表2所示。每次实验用标准菌株大肠杆菌ATCC 25922进行质控。

表2 药敏测定用抗生素及耐药折点Table2 Antibiotics and breakpoints of resistance
1.4 数据分析
采用Excel软件进行数据导入与图像处理,SPSS 20.0软件进行数据统计分析(P<0.05,差异有统计学意义)。
2 结果与分析
2.1 毒力基因鉴定结果
从屠宰猪中共分离鉴定出77 株大肠杆菌,53 株来自陕西,16 株来自重庆,8 株来自河南。其中基因iutA的检出率最高为40.26%(31/77),而sfa/foc检出率仅为1.30%(1/77),papA和afa/dra检出率均为3.90%(3/77),kpsMT II检出率为11.69%(9/77),另外有49.36%(38/77)未能检出。本研究选取的5 种毒力基因如图1所示。77 株大肠杆菌中检测到含以上毒力因子超过2 种的菌株共有9 株,因此本研究中ExPEC分离率为11.69%(9/77)。
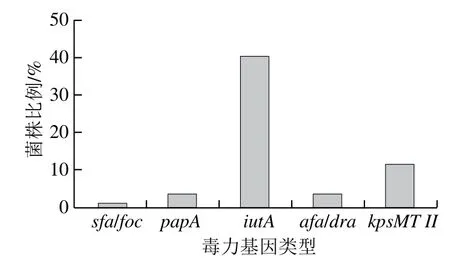
图1 毒力基因测定结果Fig.1 Detection rates of virulence genes
2.2 种群分型
77 株大肠杆菌可根据PCR扩增结果,将其分为4 种群系。其中A群系所占比例为77.92%(60/77),B1群系所占比例为5.19%(4/77),B2群系所占比例为12.99%(10/77),D群系所占比例为3.90%(3/77)。ExPEC中有66.67%(6/9)属于A群系,22.22%(2/9)属于B2群系,11.11%(1/9)属于D群系,B1群系中无ExPEC。本实验分离所得的77 株大肠杆菌的优势群系为A群系,同时A群系也是9 株ExPEC中的优势群系,见表3。表4结果表明,kspMT II与B2群系有相关性(P<0.05),50%的B2群系菌株中含有kspMT II基因。
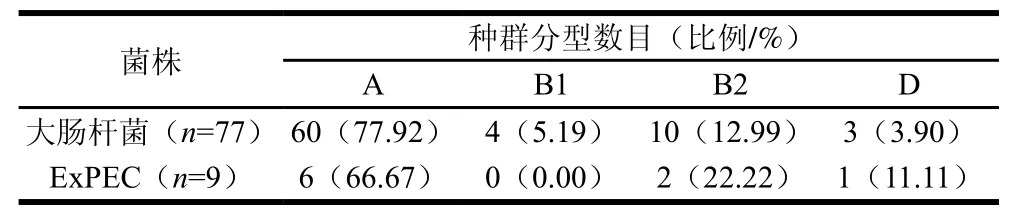
表3 大肠杆菌中的种群分型Table3 Phylogenetic groups from 77 E. coli isolates
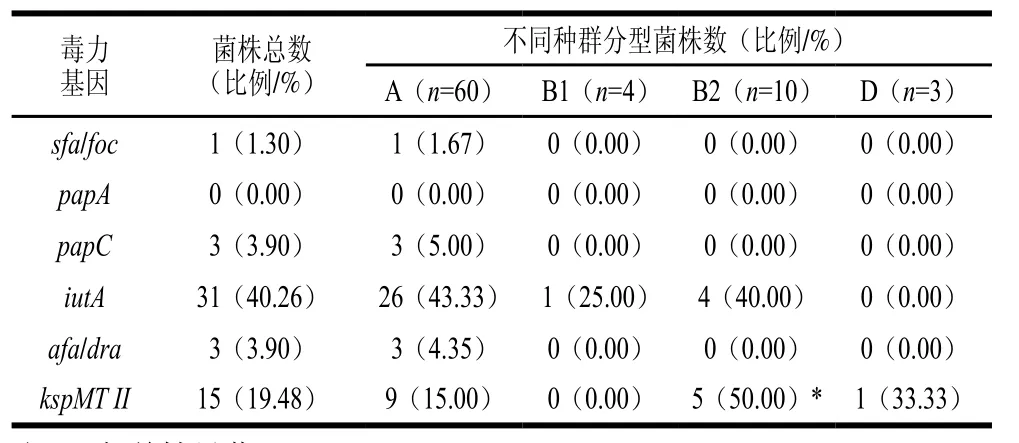
表4 大肠杆菌种群分型与毒力基因的关系Table4 Distribution of virulence factors in phylogenetic groups from 77 E. coli isolates
2.3 药敏实验结果
2.3.1 菌株的耐药率

图2 大肠杆菌耐药情况Fig.2 Antibiotic resistance rate of 77 E. coli isolates
如图2所示,不同地区大肠杆菌耐药性不同,其中,陕西省来源的菌株对四环素、甲氧苄啶/磺胺甲二唑的耐药率较高,都为92.5%,对头孢曲松、头孢西丁、头孢哌酮的耐药率较低,分别为1.9%、3.8%、17.0%;重庆市来源的菌株对四环素、甲氧苄啶/磺胺甲二唑、氨苄西林的耐药率较高,分别为87.5%、93.8%和93.8%,对阿莫西林/克拉维酸、头孢曲松、头孢西丁、头孢哌酮的敏感率均为100%,河南省来源的菌株对甲氧苄啶/磺胺甲二唑、氨苄西林、氯霉素、环丙沙星的耐药率较高,分别为100%、87.5%、87.5%、87.5%,对阿莫西林/克拉维酸、头孢曲松的敏感率均为100%。
2.3.2 菌株的多重耐药性
实验结果表明3 个地区屠宰场中分离出的77 株大肠杆菌分离株耐药情况较为严重,大多数菌株耐3~9 种药(70 株,90.91%),最高可对11 种抗生素耐药(1 株,1.30%),此菌株分离自陕西省的屠宰场。另外还分离出了1 株不耐本实验中选取的12 种抗生素的菌株,此菌株也分离自陕西省的屠宰场。其中,对6 种抗生素耐药的菌株最多,有17 株(22.08%),其次为耐5 种抗生素的菌株(15 株,19.48%),耐7 种抗生素(10 株,13.00%),耐8 种抗生素(9 株,11.69%),耐4 种抗生素(8 株,10.39%),耐9 种抗生素(6 株,7.79%),耐3 种抗生素(5 株,6.50%),耐10 种抗生素(2 株,2.60%),耐1 种抗生素(2 株,2.60%),耐2 种抗生素(1 株,1.30%)。本实验中共得出45 种耐药谱,主要耐药谱是四环素+卡那霉素+氨苄西林+庆大霉素+氯霉素+甲氧苄啶/磺胺甲二唑+阿米卡星(7 株,9.10%),图3为菌株的多重耐药结果。
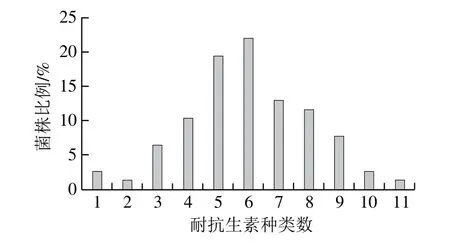
图3 77 株大肠杆菌的多重耐药情况Fig.3 Multidrug resistance of 77 E. coli isolates
3 讨论与结论
3.1 毒力因子及ExPEC分离率
本研究分离出的77 株菌株中,毒力基因的检出率并不高,有49.36%未能检出本研究选取的5 种毒力基因,其中基因iutA的检出率最高。这与Jakobsen等[12]的研究一致,其毒力基因的检测结果为kpsMT II 9%,iutA 41%,papA 6%,sfa/foc 2%,但未检出afa/dra基因。同时本实验中ExPEC分离率为11.69%,与Xia Xiaodong等[13]研究中猪肉ExPEC分离率8.3%相比略高,这可能是由于地区差异。但同时低于徐引弟等[14]研究中的分离率32.68%(149/456),这可能是由于采样地点及选材不同,参考文献中是对发生猪高热综合征猪场中的病料采样。
3.2 种群分型
在4 种群系中,本实验分离所得的77 株菌株的优势群系是A群系,其次是B2群系。ExPEC分离株中的优势群系也是A群系。之前的相关研究结果[13,15-18]显示,对人具有致病性的ExPEC主要来自B2群系,其次是D群系;而猪源ExPEC的优势群系为A和B1,其次为B2和D;另外两种大肠杆菌,共生型和肠内致病型优势群系是A和B1。这与本实验结果中ExPEC优势群系是A群系的结果相符,但在此次结果中B1群系未在ExPEC中分离出,这可能是由于地理区域不同或者由于样本数目问题。同时,有研究报道[19],A和B1群系毒力较弱,属于宿主依赖性致病,当宿主免疫力低下会引发散发感染,相较于B2和D群系,A和B1群系中呈现毒力基因较少的现象。另有研究发现,多重耐药性的大肠杆菌中多数(68.5%)属于A和B1群系[20],B1群系的菌株在另一研究中发现其致病性最强[21],因此需要重视其A和B1群系对于公共健康的影响。同时实验结果表明,kspMT II与B2群系有相关性,这与Xia Xiaodong等[13]的研究一致。
3.3 耐药性
药敏实验结果显示,虽然各地区具体的耐药情况不同,但总体看来,菌株对四环素(89.61%)、甲氧苄啶/磺胺甲二唑(93.51%)及氯霉素(75.32%)的耐药率较高。三省市的菌株耐药现象并没有明显的地域差异,说明大肠杆菌的多重耐药性现象是普遍存在的。菌株对头孢类耐药率较低,重庆和河南分离出的菌株对头孢曲松的敏感率均为100%。这与之前的研究一致:岳秀英等[22]研究表明,猪源大肠杆菌对四环素(92.32%)、氨苄西林(91.25%)耐药率较高;徐引弟等[14]的研究结果显示,其实验室分离出的菌株绝大多数对头孢类药物敏感,而对四环素、氯霉素及庆大霉素耐药率较高。这可能是由于头孢类抗生素价格较贵,临床使用较少,因此抗菌效果较理想。本实验结果与代鹏飞等[23]对于动物源性大肠杆菌耐药性的检测结果相一致,研究显示,对青霉素类、四环素类、氯霉素类等耐药率均高于70%。耐药率高的几类药物由于价格等原因易获得,加之抗菌谱广的原因在畜产品的养殖生产过程广泛被推广,从而随着时间延长耐药率升高。本实验与曾博等[24]的研究中,对环丙沙星耐药率(62.00%)、对庆大霉素耐药率(40.30%)及对阿米卡星耐药率(32.90%)的结果略微偏高,可能是由于地区及环境不同,或者使用药物频率不同而引起。此外,本实验中多重耐药情况较为严重,大多数菌株耐3~9 种药(70 株,90.91%),最高可对11 种抗生素耐药(1 株,1.30%),对6 种抗生素耐药的菌株最多,有17 株(22.08%)。邹立扣等[25]对2010年四川省猪肉源大肠杆菌进行17 种抗生素耐药性实验分析,结果显示耐3 种及3 种以上抗生素的菌株占44.05%,低于本实验结果。这可能由于地域不同以及随着时间延长大肠杆菌耐药性增强。张璇[26]选取14 种抗生素对猪源ExPEC菌株进行实验,结果有95.2%的菌株耐受5 种以上的药物,60.6%耐受10 种以上药物,还有1.9%甚至耐受所有测试抗生素。岳秀英等[22]对于15 种动物源大肠杆菌进行了15 种抗生素的耐受测试,猪源大肠杆菌多重耐药率占96.52%,其中耐受12 种抗生素的菌株最多。这也表明了大肠杆菌耐药性之广。
目前,猪源致病性大肠杆菌的研究主要集中在肠道型致病菌方面,主要引起肠道性疾病,如常见的仔猪黄痢、仔猪白痢及水肿病。但近几年,有数据显示ExPEC对人类和动物造成的病理变化无差别、对宿主的选择也无特异性[27-28],这说明动物可能是人类感染ExPEC的储存库,且极有可能是通过食物链进入人体,这应该引起重视。另外由于抗生素大量或不合理使用加剧了菌株的耐药现象,加之由于质粒等可移动元件(如携带mcr-1基因的质粒)的水平转移[29],其毒力基因和耐药基因可以进行重组,使得目前菌株的致病力及耐药状况愈加严重[30]。因此更加应该注意抗生素的合理利用,以此来指导养殖业的合理用药,减少经济损失,并保障公共健康,以防获得耐药性的菌株通过食物链进入人体造成危害。
