PlnF抗菌肽在乳酸乳球菌中的分泌表达及抑菌活性鉴定
2019-01-28任大勇朱剑威刘宏妍于寒松沈明浩
任大勇,朱剑威,刘宏妍,于寒松,沈明浩
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.吉林农业大学中药材学院,吉林 长春 130118)
金黄色葡萄球菌是一类革兰氏阳性致病菌株,属于葡萄球菌属,易于污染鱼、肉、乳制品等食品从而引发肠炎,肺炎等食源性疾病[1-2]。此外,由于金黄色葡萄球菌的耐药菌株对绝大数抗生素都具有明显的耐药性[3],这导致感染而造成的死亡事件呈现逐年上升的趋势,所以开发天然的具有抑菌金黄色葡萄球菌的物质便成为了研究的热点。
乳酸菌作为一种益生菌,因分泌通常认为无害且具有广谱抑菌效果的多肽而被广泛研究。在2011年乳酸乳球菌被我国原卫生部纳入《可食用的菌种名单》,且乳酸乳球菌符合美国食品和药物管理局的食用标准[4]。其中乳酸乳球菌表达载体pNZ8149/NZ3900是由Nisin诱导的食品级的表达载体。NZ3900菌株是一类乳糖缺陷型菌株,而质粒pNZ8149携带乳糖分解酶基因,当NZ8149正确转入NZ3900菌株后,使菌株代谢乳糖产生乳酸,pH值的下降使溴甲酚紫培养基由紫色变黄色后从而进行筛选。
本课题组在前期的实验中,从东北家庭自制的辣酱、臭豆腐、黏面子等发酵食品中通过传统抑菌实验和基因测序发现了多株含有plnF、plnE、plnN、plnJ等抗菌肽基因且具有抑菌效果的乳酸菌[5-7],并进一步将抗菌肽基因在pET28a/BL21(DE3)载体进行表达,表达产物对金黄色葡萄球菌、沙门菌、大肠埃希氏菌和蜡样芽孢杆菌有较好的抑制效果。其中只有plnF表达产物对金黄色葡萄球菌的抑制效果最好,但是由于plnF基因在pET28a等大肠表达载体中表达后,需要经过复杂的变复性和纯化处理才能被应用,所以本实验试图在usp45信号肽作用下[8],将plnF基因与pNZ8149质粒结合,转入NZ3900乳酸乳球菌表达载体[9],为抗菌肽在乳酸乳球菌表达载体中的胞外分泌提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
Pfu酶 北京天根生化科技有限公司;Ex Taq酶、dNTP、DL500 DNA Marker、DL2000 NDA Marker、DL15000 DNA Marker 大连宝生物工程有限公司;NcoI、SphI、SacI限制性内切酶,T4 DNA连接酶 NEB(北京)公司;胶回收试剂盒 美国Omega公司;质粒提取试剂盒 美国Aeygen公司;琼脂糖 法国Biowest公司;M17肉汤培养基、MRS肉汤 青岛海博生物技术有限公司;三羟甲基甲基甘氨酸-十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(tricine-sodium dodecyl sulfatepolyacrylamide gel electrophoresis,Tricine-SDS-PAGE)凝胶制备试剂盒、溴甲酚紫、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA) 北京索莱宝科技有限公司;葡萄糖、蔗糖、氯化钙、氯化镁、甘油 北京化工厂。
金黄色葡萄球菌(ATCC 6538p) 中国工业微生物菌种保藏管理中心;pNZ8149菌株、NZ3900菌株、植物乳杆菌(T4、T8)、pMG36e-S-cbhII由吉林农业大学食品科学与工程学院食品毒理与安全实验室保存。
GM17培养基:M17培养基、5 g/L葡萄糖;SGM17培养基:M17培养基、0.5 mol/L蔗糖、25 g/L甘氨酸、5 g/L葡萄糖;GM17MC恢复培养基:M17培养基、5 g/L葡萄糖、20 mmol/L MgCl2、2 mmol/L CaCl2;pNZ8149筛选培养基:M17培养基、0.04 g/L溴甲酚紫、琼脂;溶液I:0.5 mol/L蔗糖+100 mL/L甘油;溶液II:0.5 mol/L蔗糖+100 mL/L甘油+0.05 mol/L EDTA。
1.2 仪器与设备
GeneAmp 9700基因聚合酶链式反应(polymerase chain reaction,PCR)扩增仪 美国ABI公司;垂直电泳槽、水平电泳槽、DYY-11型电泳仪 北京六一仪器厂;ECM399型电转化仪 美国BTX公司;JY92-II型超声波细胞粉碎机 宁波新芝生物科技股份有限公司;Biotop SC810凝胶成像系统 上海山富科学仪器有限公司。
1.3 方法
1.3.1 菌株信息与活化
-80 ℃保存的植物乳杆菌T4、T8分别按照1%接种量接种于MRS肉汤培养基,37 ℃静置厌氧培养,金黄色葡萄球菌接种于LB培养基中,37 ℃、200 r/min活化备用;NZ3900、pMG36e-S-cbhII、pNZ8149菌株接种于M17培养基中,30 ℃厌氧条件下复苏培养后备用。
1.3.2 抗菌肽基因PCR扩增
根据NCBI中PlnF抗菌肽基因序列,为与pNZ8149质粒相连接,以T4和T8菌株为模板,PlnF上游引物添加SphI酶切位点(5’-ATAAAAGCATGCAAAAAATTTCT AGTTTTGCGTGAC-3’),下游引物添加SacI酶切位点(5’-ATAAAAGAGCTCCTATCCGTGGATGAATCCTCG GACAGC-3’)进行PCR扩增。按照如下程序进行:95 ℃预变性2 min;35 个循环(95 ℃变性30 s;65 ℃退火45 s;68 ℃延伸90 s)。在2%琼脂糖中进行电泳验证并进行DNA纯化后在-20 ℃保存。此外,以含有usp45信号肽基因的pMG36e-S-cbhII为模板,在P1和P2引物[10]上下游分别添加NcoI和SphI酶切位点等后进行PCR扩增信号肽基因。
1.3.3 感受态制备
NZ3900感受态参考Holo等[11]的方法,略作修改。第1天挑取NZ3900单菌落接种于5 mL GM17中,30 ℃厌氧培育12 h,待12 h后,在10 mL SGM17中转接入500 µL已活化12 h的菌液,30 ℃培养12 h。将10 mL培养液整体加至100 mL SGM17培养液中,30 ℃培育4 h后冰浴20 min,5 000 r/min离心10 min后弃上清液。灭菌预冷的40 mL溶液I重悬菌体,冰上静置20 min离心弃上清液,25 mL预冷溶液II重悬菌体冰上静置后离心取菌体。再用15 mL溶液I重悬菌体,冰上静置20 min后离心弃上清液。最后加入1 mL溶液I重悬菌体,80 µL分装,置于-80 ℃保存。
1.3.4 重组质粒的构建与验证
乳酸乳球菌表达载体构建如图1所示,提取的pNZ8149质粒[12-13]与plnF基因在SphI和SacI限制性内切酶作用双酶切并进行回收后,按照20 μL反应体系(0.5 μL的T4 DNA连接酶,2 μL的10×T4 DNA Buffer,载体与PCR片段按照不同比例添加)在16 ℃过夜连接,与80 μL的NZ3900感受态混匀后在电阻200 Ω、电容25 µF、电场强度10 kV/cm条件下[14]进行电转化,并将转化后复苏的菌液涂布于筛选培养基上,静置培养24 h。进一步挑取平板上黄色生长的菌株活化[15-16]并进行菌落PCR和双酶切验证,并将其送吉林省库美生物科技有限公司进行测序,测序结果在NCBI中进行比对。进一步将usp45信号肽基因按照如上步骤与重组质粒进行结合。

图1 重组表达载体的构建流程图Fig.1 Flow chart for the construction of recombinant expression vector
1.3.5 PlnF蛋白的诱导表达与抑菌活力的测定
将pNZ8149-usp45-plnF乳酸乳球菌阳性转化子进一步纯化后,接种于M17培养基中,过夜培养后再次接种于新鲜的5 mL GM17培养基中,待OD600nm至0.4左右后,加入终质量浓度为1 ng/mL的Nisin分别诱导表达3、4、5、6 h。12 000 r/min离心3 min[17],取上清液和菌体,以超低温反复冻融和超声破碎提取胞内蛋白,并经一定的透析浓缩处理后,采用牛津杯扩散法[18]测定上清液和胞内蛋白对金黄色葡萄球菌的抑菌效果。进一步使用Tricine-SDS-PAGE和纳升液相色谱-电喷雾-串联质谱(nano liquid chromatography-electrospray ionizationtandem mass spectrometry,nano LC-ESI-MS/MS)对PlnF蛋白进行分析。
1.4 数据处理和图像处理
抑菌实验均重复进行3 次,以SPSS软件对抑菌圈大小进行数据分析;DNA凝胶电泳结果均在biotop凝胶成像系统上采集。
2 结果与分析
2.1 plnF基因的扩增

图2 PCR扩增结果Fig.2 PCR amplification results
由图2可知,以植物乳杆菌T4和T8为模板对plnF基因进行PCR扩增后,在150~200 bp之间出现明显的单一条带;此外,为使ups45信号肽基因插入pNZ8149中起到胞外分泌的作用,在引物上下游添加NcoI和SphI酶切位点和保护性碱基之后,进行PCR扩增发现在100 bp上方出现了与预期一致的条带,将条带送去测序并比对后证明目标条带分别与plnF和usp45信号肽基因具有100%的相似度,表明PCR扩增过程中目标基因没有突变。
2.2 乳酸乳球菌阳性转化子的验证

图3 乳酸乳球菌阳性转化子验证Fig.3 Validation of Lactococcus lactis-positive transformants
由于NZ3900感受态是乳糖缺陷型菌株,而质粒pNZ8149携带乳糖分解酶基因,所以当重组质粒正确转入NZ3900感受态后,菌落周围会在平板上呈现为黄色。挑选黄色的阳性转化子为模板进行PCR扩增如图3A所示,3号阳性转化子在150 bp附近出现了与预期一致的条带,经进一步的测序比对验证pNZ8149-plnF重组质粒构建成功。进一步将usp45信号肽基因与pNZ8149-plnF质粒进行重组,经PCR扩增、双酶切验证(图3B、3C)、测序和显色筛选验证表明,pNZ8149-usp45-plnF乳酸乳球菌重组质粒成功,将验证正确的乳酸乳球菌阳性转化子甘油保存于-80 ℃备用。
2.3 重组乳酸乳球菌工程菌抑菌活力的鉴定
在NZ3900/pNZ8149的乳酸菌表达体系中,低剂量的Nisin可以有效诱导目标蛋白的表达,所以以终质量浓度1 ng/mL的Nisin对工程菌分别诱导3、4、5、6 h后通过牛津杯扩散法对金黄色葡萄球菌抑菌效果测定。在图4中,与空载体对比可知,仅诱导3 h的工程菌上清液中目的蛋白表达量较少,对金黄色葡萄球菌的抑菌效果不显著,仅在9 mm左右,随着Nisin诱导时间的延长,工程菌上清液对金黄色葡萄球菌的抑菌效果逐渐增强,当诱导5 h时上清液对金黄色葡萄球菌的抑菌圈增至(13.73±0.15)mm,诱导6 h的上清液抑菌圈为(14.03±0.23)mm。并且从诱导4 h开始,工程菌胞内蛋白对于致病菌也逐渐具有了一定的抑菌效果,这表明在乳酸乳球菌表达载体中起胞外表达的usp45信号肽被正确识别,目的蛋白主要以胞外可溶形式存在,且部分蛋白可能由于表达过多而积累在胞内。一系列结果表明,Nisin诱导的NZ3900/pNZ8149-usp45-plnF表达载体,诱导时间对于蛋白的表达量有影响[19]。选取具有抑菌效果的6 h的表达蛋白进行的Tricine-SDS-PAGE和nano LC-ESI-MS/MS分析。
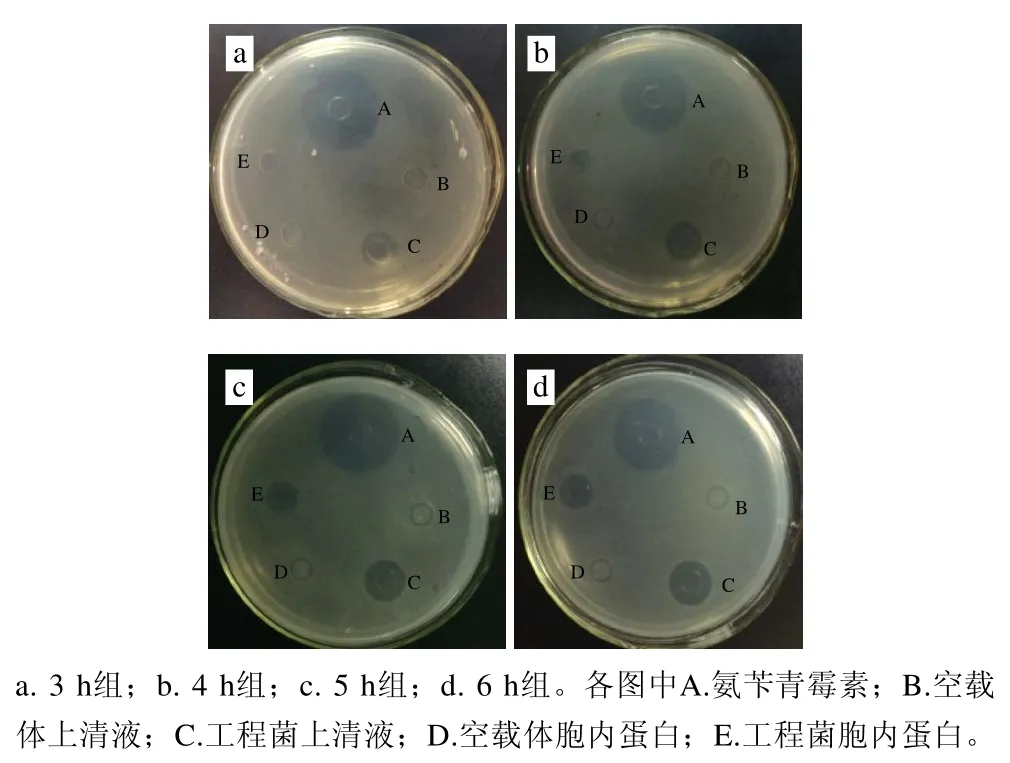
图4 表达蛋白对金黄色葡萄球菌的抑菌图Fig.4 Antimicrobial activity of the expressed protein against Staphylococcus aureus
2.4 重组质粒的Tricine-SDS-PAGE和nano LC-ESI-MS/MS分析
由抑菌实验可知,诱导表达6 h工程菌上清液和胞内蛋白对金黄色葡萄球菌都具有一定的抑菌效果,所以分别取两者进行Tricine-SDS-PAGE后,如图5所示,以pNZ8149/NZ3900为对照,工程菌上清液在5.8~7.8 kDa附近出现一条与预期5.9 kDa相近的条带。进一步通过nano LC-ESI-MS/MS分析,结果于uniprot数据库比对结果后制作如图6所示系统树[20],目的片段与PlnF抗菌肽(编号F9UU07)具有97.6%的同源性,表明工程菌以胞外表达形式正确表达了PlnF蛋白。
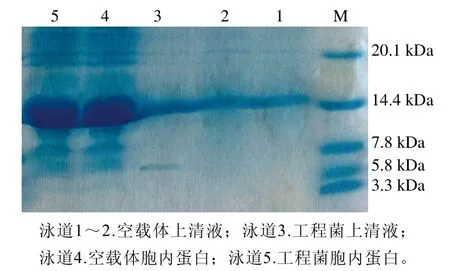
图5 pNZ8149-PlnF的Tricine-SDS-PAGE图Fig.5 The Tricine-SDS-PAGE of pNZ8149-PlnF

图6 目标蛋白的系统进化树分析Fig.6 Phylogenetic tree analysis of the target protein
3 讨 论
有研究发现,抗生素反复刺激使大肠杆菌在自身质粒中通过基因重组的方式整合了cfr耐药基因,从而形成耐药性的“超级细菌”,在临床上也有越来越多的耐药性葡萄菌属致病菌被发现[21-22],而现有的临床抗生素对这些耐药菌株的治疗效果越来越小,严重危害了人身健康,迫切需要研究开发一些安全、天然、有效抑制耐药性菌株生长的抗菌剂。抗菌肽是由20~60 个氨基酸残基构成的小于10 kDa的低分子质量、具有热稳定的多肽,从昆虫、植物、哺乳动物、微生物等天然途径提取,主要通过直接破坏微生物的膜结构从而对革兰氏阴性菌和阳性菌起到抑制生长的作用[23-24],被公认为是一类潜在的可以替代抗生素的制剂。由于抗菌肽具有选择性抑菌的特性,所以需要筛选合适的抗菌肽应用于不同适应症。例如,Joseph等[25]从筛选出的短链抗菌肽DASamP1在体外抑菌实验中可有效抑制耐甲氧西林金黄色葡萄球菌USA300;以及表达的植物细菌素Pln1[26]对金黄色葡萄球菌、表皮葡萄球菌、单核细胞性李斯特菌等革兰氏阳性菌具有较好的抑菌效果。但是抗菌肽在天然产物中含量较少,提取较为复杂,以及低产量也限制了抗菌肽的应用,所以期望以基因工程技术来大量获得抗菌肽。
本课题组前期从多种家庭自制发酵食品中筛选出多株具有抑菌效果的乳酸菌,发现有7 株菌抑制金黄色葡萄球菌效果较好。根据GenBank中乳酸菌抗菌肽基因设计合成了5 对引物,用大肠杆菌表达系统对这些基因进行克隆与表达从而验证哪一种抗菌肽对金黄色葡萄球菌具有明显的抑制作用。实验结果表明PlnF对金黄色葡萄球菌抑制效果最好。相较于大肠杆菌表达载体克隆表达的蛋白处理复杂和毕赤酵母的长时间培育[27-28],乳酸乳球菌具有培养时间短,且表达产物可直接应用于食品之中等优点[29-30],为后续开发应用提供了便捷。
本研究采用乳酸乳球菌Nisin诱导基因表达系统pNZ8149/NZ3900,首先从植物乳杆菌T4、T8中扩增plnF基因,进一步添加usp45信号肽基因以构建胞外分泌的重组质粒pNZ8149-usp45-plnF。构建成功的重组菌经1 ng/mL Nisin分别诱导3、4、5、6 h,结果表明,在3~4 h的诱导时间里,上清液对金黄色葡萄球菌抑菌效果逐渐增加,诱导至5 h后,上清液抑菌效果增加速率逐渐减缓,诱导6 h的上清液对金黄色葡萄球菌具有(14.03±0.23)mm的抑菌圈。而在构建重组质粒过程中,重组质粒对电转化效率影响较大,所以在提取pNZ8149质粒和目的基因的过程中应将其浓缩,以减少电转化时浓度不足的影响。本实验通过Nisin诱导的食品级分泌表达载体克隆表达的PlnF抗菌肽对金黄色葡萄球菌具有较好的抑菌效果,为开发新型的天然来源的抗菌剂提供了一定基础。
