双孢蘑菇转录组测序及褐变相关基因的挖掘
2019-01-28李炳娟关文强
彭 博,李炳娟,,关文强,,林 琼
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.中国农业科学院农产品加工研究所,北京 100193)
双孢蘑菇(Agaricus bisporus)又名白蘑菇、纽扣蘑菇等,是世界市场上最常见的食用栽培蘑菇,其风味鲜美、营养丰富,深受广大消费者的喜爱[1]。但是双孢蘑菇组织细嫩且菌盖无明显的保护结构,在采后贮藏和流通过程中极易发生褐变,从而影响蘑菇的质量,使商品贬值,导致一定的经济损失[2-3]。多酚氧化酶(polyphenol oxidase,PPO)被认为是引起双孢蘑菇褐变的主要酶类,包括酪氨酸酶、儿茶酚氧化酶和漆酶(laccase,LAC)。酚类底物在PPO的作用下氧化形成易聚合生成黑色素的醌类物质,加速双孢菇褐变。因此,探究双孢蘑菇在贮藏过程中PPO的调控机理对后期改良双孢蘑菇品质具有关键指导意义。
近年关于PPO的研究大多基于酶特性和基因角度进行研究。目前,已有鸭梨[4]、草莓[5]、陆地棉[6]、马铃薯[7]等多个植物PPO基因被克隆。在双孢蘑菇PPO基因研究中,Wichers等[8]通过实时荧光定量聚合酶链式反应获得cDNA片段,筛选出2 个全长为1.8 kb和1.9 kb的基因AbPPO1和AbPPO2;Li Nanyi等[2]通过同源克隆和RACE获得AbPPO3和AbPPO4,分别编码66、68 kb的蛋白;Weijn等[9]获得AbPPO5和AbPPO6的编码序列;冉欣欣[10]研究表明,在不同发育阶段,不同贮藏时期的双孢蘑菇子实体PPO基因家族成员的表达存在差异性。但由于双孢蘑菇PPO调控褐变机理相关的转录组学及基因组学信息匮乏,研究进程缓慢,因此,有必要探索双孢蘑菇基因组数据进行基因发现和功能研究。
随着新一代高通量测序技术发展,转录组测序技术因其具有通量大、低成本、高分辨率、高灵敏度、检测范围广、不需克隆且操作简单等优点成为转录组研究的主要手段[11-16]。近年来,转录组测序技术在食用菌中得到广泛应用。Tang Lihua等[17]利用高通量测序技术对3 种不同条件下生长的香菇菌丝体进行转录组测序,筛选出香菇与光诱导褐色膜形成相关的基因。易琳琳[18]通过新一代高通量测序技术对2 种不同处理方式的香菇子实体测序,筛选出15 个与细胞壁代谢相关酶相关基因。吴小梅等[19]利用转录组测序技术对3 个不同发育时期的蘑菇进行转录组测序,筛选出2 个发育关键基因和8 个与发育相关的基因。
本实验采用转录组测序技术对采后4 ℃贮藏第1、7和14天的双孢蘑菇菌盖进行测序,拟从转录组水平分析双孢蘑菇在不同贮藏时间基因的表达差异,进而对这些差异基因进行GO(Gene Ontology)功能和KEGG(Kyoto Encyclopedia of Genes and Genomes)富集分析,同时筛选与褐变相关的基因,为今后双孢蘑菇褐变的研究和品质改良等提供一定的理论研究基础。
1 材料与方法
1.1 材料与试剂
双孢蘑菇采自天津市闽中食用菌种植基地,采取新鲜健康、无开伞、色泽洁白、大小均一(直径3~4 cm)的优质蘑菇置于泡沫盒中,立即运往实验室,置于4 ℃贮藏。
Trizol®Reagent 美国Life Technologies公司;三氯甲烷(氯仿) 青岛精科仪器试剂有限公司;邻苯二酚天津市赢达稀贵化学试剂厂;无水乙醇 天津市风船化学试剂科技有限公司。
1.2 仪器与设备
TG16-WS台式高速离心机 湘仪离心机仪器有限公司;NanoPhotometer®分光光度计 美国Implen公司;2100生物分析仪 美国安捷伦公司。
1.3 方法
1.3.1 样品处理
将双孢蘑菇分装入聚乙烯包装袋中,置于(4±0.5)℃冰温库中预冷24 h后封口贮藏。以预冷后24 h的第1天设置为1 d,分别在1、7、14 d随机取3 袋,取双孢蘑菇的菌盖切碎,置于液氮速冻,分别记为Pile_C1、Pile_C7、Pile_C14。
1.3.2 褐变度的测定
参照Lei Jing等[20]的方法:准确称取2 g液氮速冻的双孢蘑菇菌盖组织,加入5 mL预冷的95%乙醇溶液,冰浴研磨成浆,于4 ℃、8 000 r/min离心10 min。取上清液,测定其410 nm波长处吸光度,即褐变度。
1.3.3 总RNA的提取与测序文库的构建

图1 cDNA文库的构建Fig.1 Construction of cDNA library
采用Trizol法[21]提取双孢菇菌盖RNA,利用NanoPhotometer®分光光度计检测RNA浓度、OD260nm/OD280nm和OD260nm/OD230nm值。利用生物分析仪精确检测RNA完整性(用RIN表示)和25S/18S值。RNA样品标准质量浓度不低于250 ng/μL,OD260nm/OD280nm值应介于1.8~2.2之间,OD260nm/OD230nm值不小于1.8,RIN不低于6.5,25S/18S值不低于1.0。样品检测合格后,由北京诺禾致源科技股份有限公司进行cDNA文库的构建(图1)及高通量测序。
1.3.4 转录组测序数据分析
1.3.4.1 序列数据质量评估及与参考基因组比对
高通量测序得到的原始图像数据文件经CASAVA碱基识别分析转化为原始测序序列,为保证信息分析质量,必须对原始序列进行过滤,得到clean reads,后续分析都基于clean reads。
选取HISAT软件将过滤后的测序序列进行基因组定位分析。HISAT能够有效地比对RNA seq测序数据中的spliced reads,是目前比对率最高且最准确的比对软件。
1.3.4.2 差异表达基因筛选及聚类分析
使用FPKM法估算基因表达水平,对read count进行标准化,然后根据模型进行假设检验概率(P值)的计算,最后进行多重假设检验校正,得到错误发现率(false discovery rate,FDR)。按照∣log2(两组样品表达量比值)∣>1且q<0.005的原则筛选DEGs。
聚类分析用于判断DEGs在不同贮藏时间下的表达模式。以不同贮藏时间的差异基因FPKM值为表达水平,做层次聚类分析,不同颜色的区域代表不同的聚类分组信息,同组内的基因表达模式相近,可能具有相似的功能或参与相同的生物学过程。
1.3.4.3 GO富集分析和Pathway富集分析
根据实验目的筛选差异基因后,富集分析研究差异基因在GO中的分布状况以期阐明实验中样本差异在基因功能上的体现。根据挑选出的差异基因计算这些差异基因同GO分类中某几个特定分支的超几何分布关系,通过假设验证得到一个特定p值,进而判断差异基因在该GO中出现富集的情况。在分析中GO富集分析采用的软件方法为GO seq[22]。
在生物体内,通过Pathway显著性富集能确定差异表达基因参与的最主要生化代谢途径和信号转导途径。作为Pathway相关的主要公共数据库[23],KEGG是进行生物体内代谢分析、代谢网络研究的强有力工具。Pathway显著性富集分析以KEGG数据库中Pathway为单位,应用超几何检验,找出在差异表达基因中显著性富集的Pathway。FDR≤0.05时,表示差异基因在该Pathway中显著富集,使用KOBAS(2.0)进行Pathway富集分析。
1.3.5 PPO活性的测定
参考Mdelosa等[24]的方法并稍作修改。准确称取1 g液氮速冻的双孢蘑菇菌盖组织研磨成粉,加入8 mL预冷的磷酸缓冲液(0.1 mol/L,pH 6.5)研磨成浆后,于4 ℃、8 000 r/min离心15 min,取上清液(即粗酶液)于4 ℃冰箱中备用。室温下,取2.9 mL磷酸盐缓冲液(0.1 mol/L,pH 6.5)、1.0 mL 0.1%邻苯二酚和1.0 mL PPO粗酶液于10 mL试管中混匀后开始计时,测量420 nm波长处吸光度的变化。以磷酸盐缓冲液(0.1 mol/L,pH 6.5)和0.1%邻苯二酚为底物,在25 ℃、pH 6.5和波长420 nm处吸光度每分钟变化0.01为1 个酶活力单位。
1.4 数据处理
利用Excel 2007、Origin 8、SPSS 16.0和PowerPoint 2007等软件对实验数据进行统计分析及图像处理。
2 结果与分析
2.1 双孢蘑菇贮藏时间褐变度的变化

图2 采后双孢蘑菇4 ℃贮藏时间褐变度的变化Fig.2 Changes in browning degree during storage of A. bisporus at 4 ℃
由图2可知,在4 ℃贮藏时间双孢蘑菇褐变度随贮藏时间的延长呈现逐渐增加的趋势。果蔬采后运输和加工过程中易产生黑色素而引起褐变,会影响果蔬的销售及其营养价值。为进一步探究双孢蘑菇褐变的机理,利用转录组测序技术对其进行后续研究。
2.2 RNA质量检测
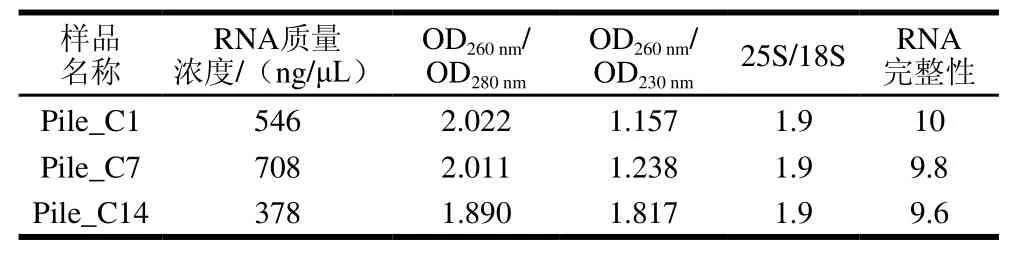
表1 双孢蘑菇3 组样品RNA质量检测Table1 Evaluation of total RNA extracted from three samples of A. bisporus
由表1可知,所提取的3 组RNA质量较好,可以进行文库构建以及后续测序分析。
2.3 转录组测序数据统计分析

表2 3 组样品数据产出质量情况Table2 Quality assessment of sequencing output data of three samples
为探究双孢蘑菇采后贮藏过程中的变化机制,对双孢蘑菇菌盖3 个贮藏时间的转录组进行测序,共获得176 329 392 个原始片段,对原始片段过滤后,获得168 607 212 个剩余片段。由表2可知,Pile_C1、Pile_C7、Pile_C14三组的Q20值分别为96.49%、96.43%和96.99%,Q30值分别为91.26%、91.12%和92.18%,GC相对含量分别为49.61%、49.67%和49.57%。综上,转录组测序数据的数量和质量较高,可用于后续分析。
由表3可知,Pile_C1、Pile_C7、Pile_C14三组转录组测序获得的clean reads中,能定位到基因组上的reads片段有135 603 695 个,占比78.89%~82.5%,在参考序列上有多个比对位置的reads片段有1 627 747 个,占比0.93%~1.04%,在参考序列上有唯一比对位置的reads片段有133 975 948 个,占比77.84%~81.58%,比对到基因组上正链的reads片段有66 778 656 个,占比38.69%~40.67%,比对到基因组上负链的reads片段有67 197 292 个,占比39.16%~40.91%。能定位到基因组上的reads片段中,分段比对到两个外显子上的reads片段有61 654 288 个,占比35.45%~37.83%,整段比对到外显子的reads片段有72 321 660 个,占比41.63%~43.74%。

表3 Reads与参考基因组比对情况Table3 Results of mapping relative to the reference genome
样品间基因表达水平相关性用皮尔逊相关系数的平方(R2)表示。相关系数R2越接近1,表明样品之间表达模式的相似度越高。由图3可知,Pile_C1与Pile_C7间的相关系数R2为0.927,Pile_C1与Pile_C14间的相关系数R2为0.845,Pile_C7与Pile_C14间的相关系数R2为0.917,说明结果可靠且样本选择合理。

图3 Pile_C1、Pile_C7、Pile_C14三组样品间相关系数Fig.3 Correlation coefficients between Pile_C, Pile_C7 and Pile_C14
2.4 差异表达基因筛选结果
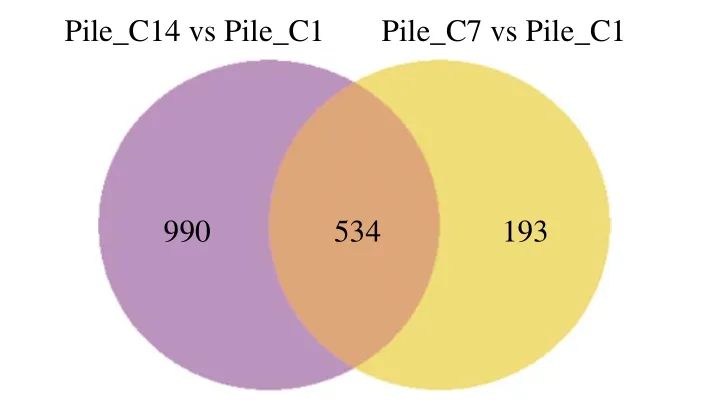
图4 差异表达基因维恩图Fig.4 Venn diagram of differentially expressed genes (DEGs)

图5 不同贮藏时间双孢蘑菇菌盖差异表达基因火山图Fig.5 Volcano diagram of DEGs in A. bisporus pilei at different storage periods
由图4、5可知,Pile_C7与Pile_C1比较,共筛选出727 个差异表达的基因,其中Pile_C7组相对于Pile_C1组上调基因354 个,占总差异表达48.7%,下调基因373 个,占总差异表达51.3%。Pile_C14与Pile_C1比较,共筛选出1 524 个差异表达的基因,其中Pile_C14组相对于Pile_C1组上调基因768 个,占总差异表达50.4%,下调756 个,占总差异表达49.6%。
为判断差异基因在不同实验条件下的表达模式,筛选了95 个差异基因采用热图形式对其进行聚类分析。图6显示了95 个基因的聚类相关性,其中,38 个基因在贮藏过程中表达量呈下降趋势;3 个基因在贮藏1 d有较低表达,7 d表达量较高,14 d显著降低;11 个基因在贮藏1 d表达量较低,7 d和14 d表达量较高;6 个基因在贮藏7 d表达量较低,14 d表达量显著升高;14 个基因在贮藏过程中表达量逐渐升高;14 个基因在贮藏1 d和7 d表达量较低,14 d表达量较高。
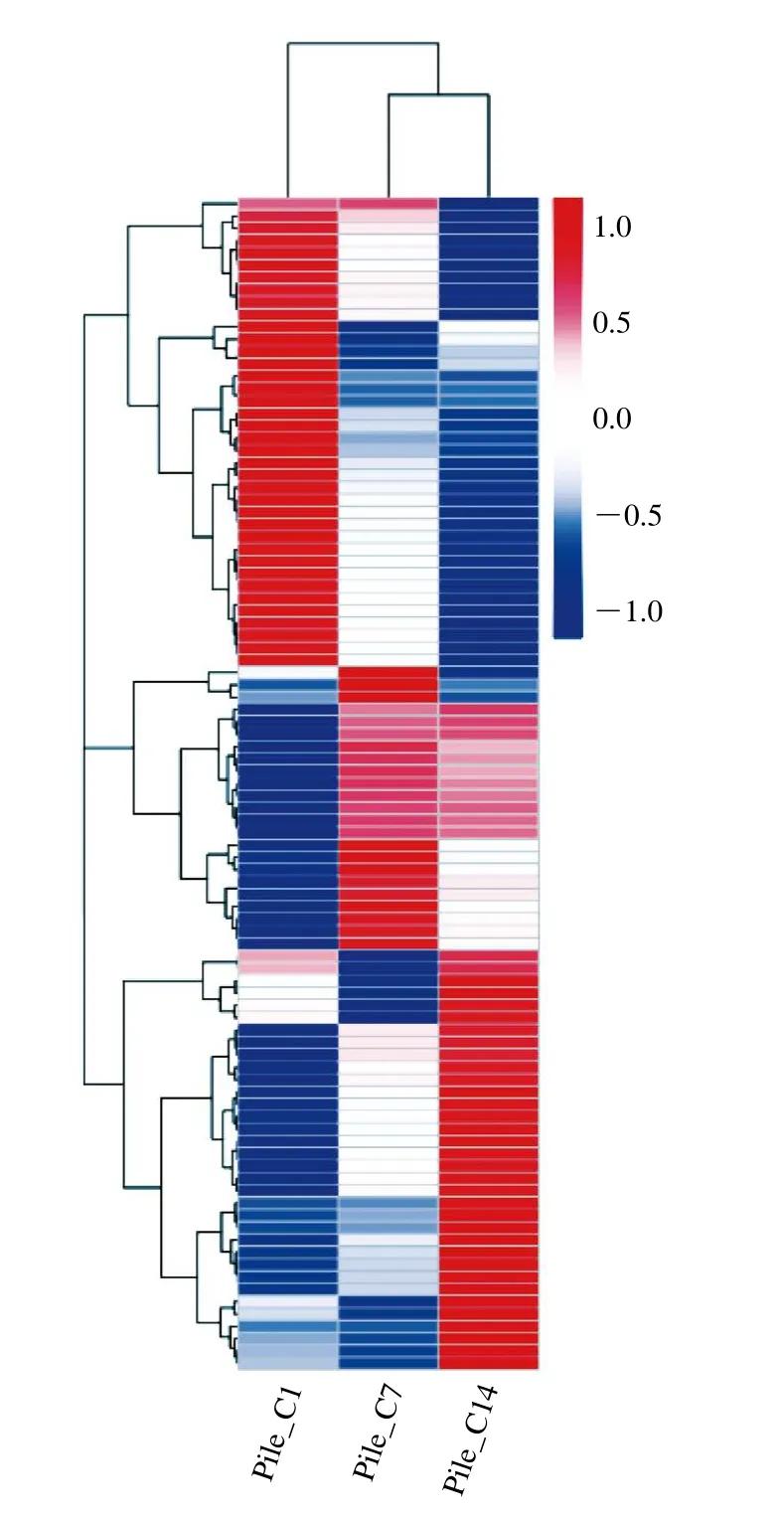
图6 双孢蘑菇菌盖差异表达基因聚类图Fig.6 Clustering analysis of DEGs in A. bisporus pilei
2.5 差异表达基因GO富集分析
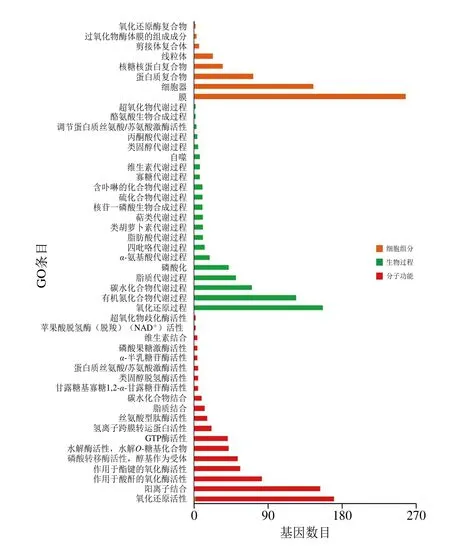
图8 双孢蘑菇Pile_C14 vs Pile_C1差异基因GO富集结果Fig.8 GO function of DEGs of A. bisporus in Pile_C14 vs Pile_C1
对不同贮藏时间的双孢蘑菇菌盖DEGs进行GO富集分析,鉴于差异表达基因数目较多,本研究仅对GO三大功能类别靠前的条目进行富集分析。由图7可知,对Pile_C7和Pile_C1组进行显著富集,细胞组分、生物过程和分子功能三大功能类别分别包含了4、16 个和23 个功能分类。细胞组分类别中,富集到胞质的差异基因较多;生物过程类别中,富集到氧化还原过程、磷代谢过程和糖代谢的差异基因较多;分子功能中,富集到水解酶活性、核苷酸结合、核苷磷酸结合和阳离子结合的差异基因较多。对Pile_C14和Pile_C1组进行显著富集,由图8可知,细胞组分、生物过程和分子功能三大功能类别分别包含了8、21 个和19 个功能分类。细胞组分类别中,富集到膜和细胞器的差异基因较多;生物过程类别中,富集到氧化还原过程和有机氮化合物代谢;分子功能中,富集到氧化还原活性和阳离子结合的差异基因较多。
2.6 差异表达基因Pathway显著性富集分析
双孢蘑菇Pile_C7组与Pile_C1组差异表达基因中共有459 个基因被注释到83 条KEGG代谢通路中;Pile_C14组与Pile_C1组差异表达基因中共有876 个基因被注释到97 条KEGG代谢通路中,其中包含10 条显著性富集代谢通路,分别是类固醇生物合成、氨酰-tRNA生物合成、抗生素生物合成、精氨酸和脯氨酸代谢、果糖和甘露糖代谢、氧化磷酸化、半乳糖代谢、甘油脂代谢、磷酸戊糖途径和次生代谢产物的生物合成,这些途径大都与双孢蘑菇生理代谢相关。
2.7 褐变相关差异表达基因筛选

图9 褐变相关基因筛选结果Fig.9 Screening of browning-related genes
由图9可知,从3 组双孢蘑菇菌盖在不同贮藏时间的差异表达基因中筛选出与多酚氧化酶相关的基因有5 个,这些基因包括多酚氧化酶基因和漆酶基因。其中,PPO3(18 085 507)在贮藏第7天时表达量最低,在贮藏第14天时基因表达量上调,这与Li[2]和Lei Jing[20]等的研究结果一致。PPO1(18 082 695)在贮藏时间表达量下调。LAC4(18 085 498)、PPO5(18 078 406)和LAC1(18 080 537)3 个基因表达量在贮藏期间呈上调趋势,且在第7天和第14天期间基因表达量显著上调。
基因表达分析结果表明,在双孢蘑菇不同贮藏时间PPO家族成员的表达具有差异性,漆酶基因LAC1和LAC4在贮藏时间表达量呈上升趋势。吴小梅[19]的研究结果表明漆酶基因在纽扣期至成熟早期表达量稳步增加,在成熟期表达量达到最高,与本研究结果一致。吴光美等[25]的研究表明fv-lac4基因随着原基出现表达量开始增加,且菌盖中表达量低于菌柄,这一研究结果也表明该基因可能与双孢蘑菇褐变无关。卓睿等[26]研究表明糙皮侧耳漆酶基因lacc4在原基分化期高表达,推测其可能与原基分化相关。
2.8 双孢蘑菇贮藏时间PPO活性变化

图10 采后双孢蘑菇4 ℃贮藏时间PPO活性的变化Fig.10 Changes in PPO activity during storage of A. bisporus at 4 ℃
从图10可以看出,双孢蘑菇PPO活性随贮藏时间的延长逐渐增强。Lei Jing等[20]研究结果表明AbPPO1基因表达的影响模式与其对褐变度和PPO活性的影响模式不一致,而AbPPO3基因与褐变度和PPO活性的影响模式一致,认为AbPPO1基因可能不参与双孢蘑菇褐变的形成,AbPPO3参与双孢蘑菇的褐变。PPO是引起双孢蘑菇褐变的主要酶,其主要通过将酚类物质氧化为醌,进一步产生黑色素,从而导致双孢蘑菇褐变的发生。将PPO活性与PPO3基因表达做Pearson相关性分析得到系数为-0.777,表明两者具有一定的相关性,与转录组测序结果具有一致性。Van Leeuwen等[27]研究表明,双孢蘑菇菌盖皮层褐变程度与PPO活性呈正相关关系,与本实验研究结果一致。
3 结 论
4 ℃贮藏时间双孢蘑菇褐变度随贮藏时间的延长呈现逐渐增加的趋势,并对此条件下的双孢蘑菇菌盖转录组进行Illumina HiSeqTM高通量测序,共获得176 329 392 个raw reads,168 607 212 个高质量的clean reads。按照︱log2(两组样品表达量比值)︱>1且q<0.005的原则,Pile_C7与Pile_C1组共筛选出727 个差异表达基因,Pile_C14与Pile_C1组共筛选出1 524 个差异表达基因。GO功能富集结果显示,Pile_C7与Pile_C1组中,胞质、氧化还原过程和水解酶活性分别是细胞组分、生物过程和分子功能富集最多的条目;Pile_C14与Pile_C1组中,膜、氧化还原过程和氧化还原活性分别是细胞组分、生物过程和分子功能富集最多的条目。Pathway富集分析发现,Pile_C7与Pile_C1组中459 个差异表达基因被成功注释到83 条KEGG代谢通路中;Pile_C14与Pile_C1组中876 个差异表达基因被成功注释到97 条KEGG代谢通路中,其中10 条为显著富集通路(P<0.05)。从获得的差异表达基因中筛选得到5 个多酚氧化酶相关基因,PPO3、PPO1、PPO5、LAC1和LAC4。双孢蘑菇多酚氧化酶活性随贮藏时间的延长逐渐增强,与转录组测序结果有一致性。研究结果为进一步分析差异基因与褐变的调控关系,及为双孢蘑菇品种改良提供科学依据。
