自然发酵锦州小菜中乳酸菌的分离筛选
2019-01-28孙慧君解梦汐乌日娜武俊瑞
刘 境,孙慧君,2,李 默,解梦汐,乌日娜,武俊瑞,
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.辽宁省农业发展服务中心,辽宁 沈阳 110000)
自然发酵锦州小菜是以黄瓜、青椒、小茄子、蒜等10 种新鲜蔬菜配制优质虾油在自然条件下腌制而成的,首先将腌制蔬菜洗净、淋干后,装入缸中,再向其中加入虾油、食盐、汤汁经过腌制3~6 h后,洗净盐卤再加入虾油腌制7 d而成。小菜具有独特的风味特征,是锦州的特色美食之一[1-2]。曲玲童等[3]从锦州腌渍小菜中筛选出28 株耐盐乳酸菌,并对其在不同盐浓度条件下菌种产酸能力进行分析,得到1 株高产耐盐乳酸菌菌株L7。孙慧君等[4]利用变性梯度凝胶电泳方法从10 份采自不同地区的传统发酵锦州小菜的样品中鉴定出8 种微生物,其中细菌属5 种,真菌属3 种,证实自然发酵锦州小菜含有丰富的乳酸菌资源,是挖掘乳酸菌的宝库[5-6]。目前普遍认为,小菜在腌制过程中最主要的发酵作用是乳酸菌引起的乳酸发酵,乳酸的产生不仅降低发酵蔬菜的酸度,抑制杂菌的生长,而且样品会形成自身独特的风味特征[7]。
本实验对27 份自然发酵锦州小菜的总酸含量、氨基酸态氮含量、亚硝酸盐含量、NaCl含量及菌落总数进行测定,由于发酵的地点、条件和工艺的不同,导致不同样品间的成分含量存在差异[6]。氨基酸态氮又称为氨基氮,是酱油中的重要组成成分,是酱油调味品鲜味的主要来源,为发酵小菜呈现鲜味特征。有些乳酸菌在发酵过程中可以降低亚硝酸盐、NaCl和总酸含量,提高产品的营养质量和风味质量,从而发现样品风味特征变化与小菜发酵过程中微生物之间的关系[8-10]。选择7 份在样品风味特征中具有代表性的自然发酵锦州小菜进行乳酸菌分离筛选,采用16S rDNA序列对比分析,进行菌种的鉴定,探究自然发酵锦州小菜中乳酸菌的构成[11-16]。将自然发酵锦州小菜中成分含量的变化与发酵期间微生物多样性联系起来有助于合适发酵剂的选择,并为工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
选取常见的锦州自然发酵制作的特色小菜作为研究材料,样品于同一日上午采集于辽宁锦州市内3 区的5 个地点,次日上午采集沈阳皇姑区早市样品,共计6 个地点。共采集27 份自然发酵小菜,每份样品平行采集3 次。
MRS培养基:蛋白胨 10 g、无水乙酸钠3 g、K2HPO42 g、MgSO4·7H2O 0.575 g、MnSO4·H2O 0.25 g、葡萄糖20 g、柠檬酸三钠2.42 g、酵母粉4 g、牛肉浸膏8 g、吐温80 1 g、琼脂(半固体)1.75 g、琼脂(固体)20 g。不添加琼脂为MRS液体培养基。试剂均购自国药集团化学试剂有限公司。
20 mg/mL蛋白酶K、dNTP、loading buffer、Marker 2000、溴化乙锭染色液、Taq DNA聚合酶沈阳森宇生物技术有限公司;正向引物2 7 F(5’-AGAGTTTGATCCTGGCTCAG-3’)、反向引物1495R(5’-CTACGGCTACCTTGTTACGA-3’) 上海派森诺生物技术有限公司;琼脂糖 北京沃比森公司;十六烷基三甲基溴化铵(cetyltrimethylammonium ammonium bromide,CTAB)法提取细菌DNA试剂、含量测定所用试剂(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
SH2100 pH计 奥豪斯仪器(常州)有限公司;电热恒温水浴锅、电热恒温培养箱 上海精宏实验设备有限公司;ZHJH-C1112C无菌操作台 北京瑞尔欣德科技有限公司;KDN-04A凯氏定氮仪 浙江托普仪器有限公司;GMSX-280手提式压力蒸汽灭菌锅 北京永光明医疗仪器有限公司;TGL-168高速台式离心机、微量紫外分光光度计、New Brunswick超低温冰箱德国Eppendorf公司; 聚合酶链式反应(polymerase chain reaction,PCR)扩增仪、凝胶成像系统 美国伯乐公司;DYY-6C电泳仪 北京六一仪器厂;真空冷冻干燥机 美国基因有限公司。
1.3 方法
1.3.1 样品的采集
从自然发酵锦州小菜6 个地点采集的27 份不同样品采集情况见表1。

表1 样品采集Table1 Details of naturally fermented pickle samples collected in this study
1.3.2 总酸含量测定
取样品捣碎后,称取20 g样品置于250 mL容量瓶中,加入50 mL H2O混合均匀后补全溶液。用3 层滤布去除小菜固体。量取50 mL滤液于锥形瓶中,加入2 滴酚酞指示剂,用0.1 mol/L NaOH标准溶液滴定至红色终点,结果取3 次平均值[17]。
1.3.3 氨基酸态氮含量测定
称取捣碎样品0.5 g,加入50 mL H2O,混匀后,移入100 mL容量瓶中,加水至刻线摇匀,弃去初滤液。量取20 mL样品稀释液倒入200 mL烧杯中,加入60 mL H2O,再用0.05 mol/L NaOH标准溶液滴定至pH 8.2。向其中加入10 mL 36%的甲醛试剂,混匀后再用NaOH标准溶液(0.05 mol/L)继续滴定,此溶液pH 9.2时终止滴定[18]。
1.3.4 亚硝酸盐含量测定
样品经预处理后,吸取40 mL滤液于50 mL带塞比色管中,另取0.00、0.20、0.40、0.60、0.80、1.00、1.50、2.00、2.50 mL亚硝酸钠标准使用液分别置于50 mL带塞比色管中。于标准管与试样管中分别加入2 mL 4 g/L对氨基苯磺酸溶液,混匀,静置3~5 min后分别加入1 mL 2 g/L盐酸萘乙二胺溶液,加水至刻线,混匀,静置15 min,用2 cm比色皿,在538 nm波长处测定吸光度,以标准液调零。每个样品测3 次数值,计算平均值,绘制标准曲线[19]。
1.3.5 NaCl含量测定
称取捣碎样品5.0 g,置于150 mL烧杯中加入80 mL H2O,煮沸30 min,待冷却后移至100 mL容量瓶中,定容,滤纸过滤,留滤液备用。吸取5 mL滤液,置于100 mL锥形瓶中,滴加1 mL铬酸钾溶液。用AgNO3标准溶液滴定,滴定至橙红色为滴定终点,用5 mL H2O作为空白对照,结果取3 次平均值[20]。
1.3.6 菌落总数测定
称取25 g小菜置于225 mL灭菌的生理盐水中,振荡混匀,进行10 倍系列梯度稀释。选择2~3 个适宜稀释度的匀液,分别取1 mL匀液涂平板,每个稀释梯度做3 个平行实验,取平均值[21]。
1.3.7 乳酸菌分离筛选
1.3.7.1 乳酸菌的分离纯化
取1 mL自然发酵锦州小菜发酵液置于10 倍系列梯度稀释的灭菌生理盐水中,将5~8 个梯度稀释液接种到含有2%碳酸钙的MRS固体培养基中,在37 ℃厌氧条件下培养48 h,挑选有钙圈的菌落,划线进行分离纯化出单菌落,经革兰氏染色后进行镜检观察,将革兰氏阳性菌进行甘油保藏。同时进行过氧化氢酶生理生化实验,确认纯菌种,过氧化氢酶阴性的无芽孢杆菌为乳酸菌[22-26]。
1.3.7.2 16S rDNA序列分析
利用CTAB法提取细菌基因组乳酸菌疑似菌株的DNA,采用16S rDNA进行PCR扩增。正向引物为27F(对应于Escherichia coil 8~27位碱基):5’-AGAGTTTGATCCTGGCTCAG-3’;反向引物为1495R(对应于E. coil 1 495~1 515位碱基):5’-CTACGGCTACCTTGTTACGA-3’,由上海派森诺生物技术有限公司合成。1%琼脂糖凝胶电泳进行扩增产物的检测,若PCR扩增成功,约在1 500 bp处可见到明亮条带,测序由上海派森诺生物技术有限公司完成[27-29]。
1.3.7.3 16S rDNA序列同源性分析
将PCR扩增产物送到上海派森诺生物技术有限公司进行测序,将测序结果输入GenBank数据库中,与数据库中已测出的基因序列进行BLAST同源性比对分析。以16S rDNA的序列同源性大于99%为标准进行种属归类[30]。
1.4 数据处理
采用Excel 2003和SPSS软件进行各指标数据的分析处理。
2 结果与分析
2.1 成分含量测定
2.1.1 样品总酸含量分析
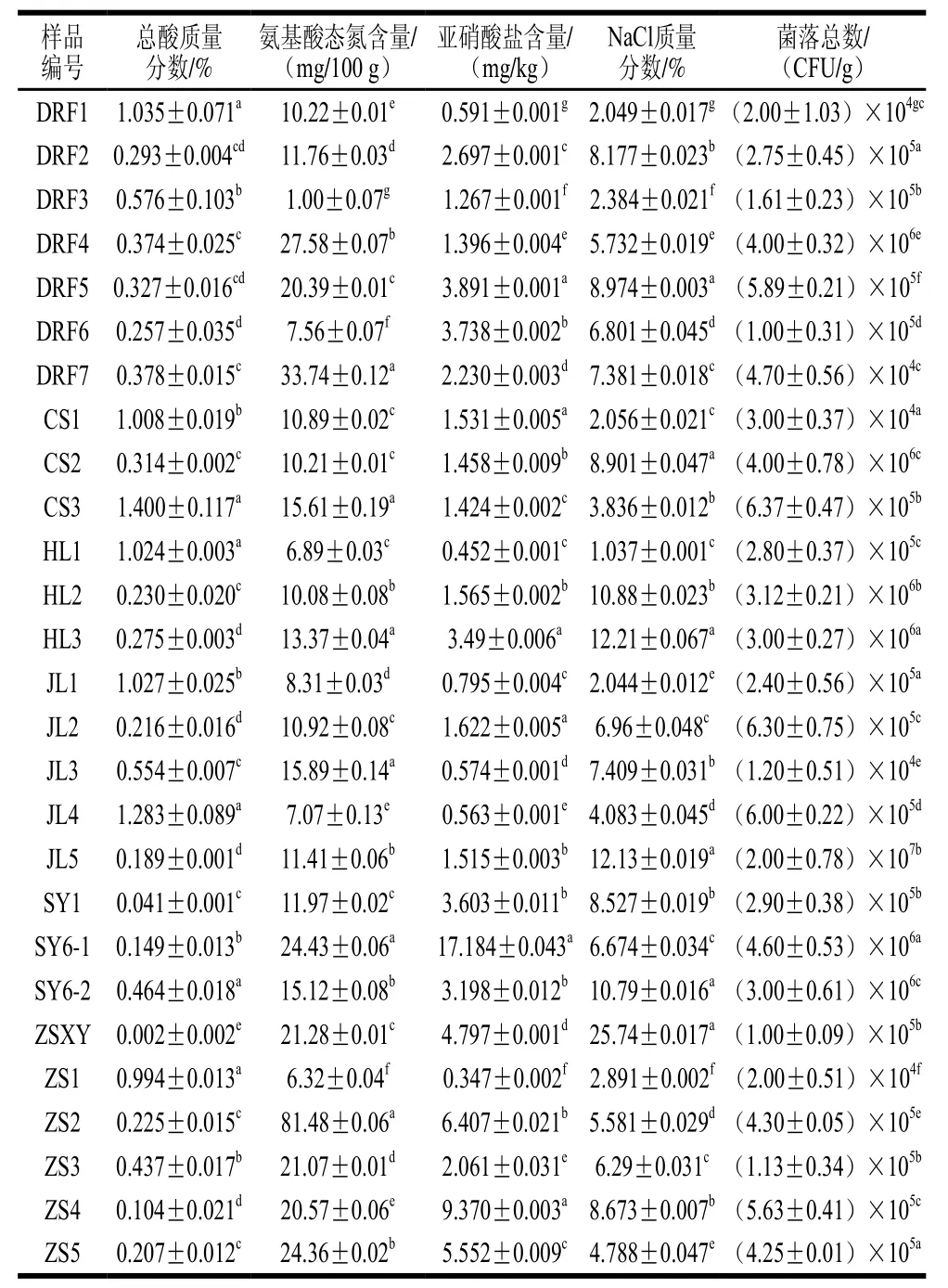
表2 自然发酵锦州小菜理化品质检验结果Table2 Chemical and microbial measurements of naturally fermented Jinzhou pickle
如表2所示,在27 份样品中CS3的总酸质量分数最高,为(1.400±0.117)%,样品SY1的总酸质量分数最低,为(0.041±0.001)%,各样品之间的差值较大,极差为1.359%。根据商务部标准SB/T 10439—2007《酱腌菜》中的盐水渍菜和农业部标准NY/T 437—2000《绿色食品酱腌菜》中的发酵性咸菜相关标准不大于1.0%或不大于1.5%[31-32],即样品符合标准要求。根据27 份样品的采集地点进行差异性分析,样品DRF2、DRF4、DRF5和DRF7之间差异不显著(P>0.05),样品DRF2、DRF5和DRF6之间差异不显著(P>0.05),其他样品之间差异显著(P<0.05),这与发酵环境(温度、时间、pH值)有关,在发酵过程中优势菌群和微生物的变化不同,生产出不同风味质量的发酵小菜。
2.1.2 样品氨基酸态氮含量分析
如表2所示,采用甲醛滴定法对自然发酵锦州小菜中含有的氨基酸态氮进行检测,含量范围在1.00~81.48 mg/100 g,极差为80.48 mg/100 g。样品ZS2氨基酸态氮含量最高,为81.48 mg/100 g,样品DRF3氨基酸态氮含量最低,为1.00 mg/100 g。这可能由于黄瓜在腌制的过程中添加了红油调味品,使得样品DRF7的氨基酸态氮含量大大增加。根据27 份样品的采集地点进行差异性分析,发现各样品之间差异显著(P<0.05)。样品ZSXY、ZS5、DRF4氨基酸态氮的含量为21.28、24.36、27.58 mg/100 g,说明虾油中含有的鲜味物质成分较高,是虾油以及虾油黄瓜类小菜味道鲜美的主要原因,并且赋予其较高的氨基酸态氮含量。
2.1.3 样品亚硝酸盐含量分析
如表2所示,根据27 份样品的采集地点进行差异性分析,发现各样品之间差异显著(P<0.05)。SY6-1样品的亚硝酸盐含量最高,为(17.184±0.043)mg/kg,ZS1样品的亚硝酸盐含量最低,为(0.347±0.002)mg/kg。Z S 4、Z S 5样品的亚硝酸盐含量较高,分别为(9.370±0.003)、(5.552±0.009) mg/kg。因为ZS4、ZS5样品具有较长的发酵腌制时间,亚硝酸盐的含量随着发酵时间的延长而升高。
与总酸含量相比,总酸含量较高的JL4、DRF1、JL1所含的亚硝酸盐含量较低。由此可知,酸对亚硝酸盐具有一定的清除能力。根据联合国粮农组织及世界卫生组织中委员会建议每日摄取亚硝酸盐的量要小于0.07 mg/kg,并将标准人体质量按60 kg计,每人每日摄入亚硝酸盐量最多为4.2 mg/kg。这就需要生产者严格控制食品加工工艺,防止亚硝酸盐含量的超标,确保质量符合食品规范要求[33-34]。
2.1.4 样品NaCl含量分析
采用亚硝酸银方法对27 份自然发酵锦州小菜的NaCl含量进行测定,由表2可知,其数值范围在1.037%~25.74%之间,ZSXY的NaCl含量比较高,ZSXY(虾油黄瓜)经过鲜虾腌制而成,所有NaCl含量比较高,SY6-2、HL2、HL3的NaCl含量较其他小菜的NaCl含量较高。其余的小菜NaCl质量分数均在2.044%~8.974%之间。采用SPSS软件根据27 份样品的采集地点进行差异分析,各样品之间差异显著(P<0.05)。
2.1.5 样品菌落总数分析
按GB/T 4789.2—2010《食品微生物学检验 菌落总数测定》方法,如表2所示,自然发酵小菜本身存在微生物活动,因此,国家对于酱腌菜中的细菌总数并未做出严格的卫生标准。对27 份自然发酵的锦州小菜进行菌落计数,并根据样品的不同采集地点进行差异性分析,各样品之间差异显著(P<0.05)。DRF1、DRF7、CS1、JL3、ZS1菌落数均在104CFU/g,其他几种样品菌落数均在105~106CFU/g之间,与样品DRF1、DRF7、CS1、JL3和ZS1相比差异显著(P<0.05)。在腌制过程中添加食醋可以抑制有害细菌的滋生,从而确保酱腌菜的质量状况较好。菌落数在105~106CFU/g之间有可能是露天腌制的小菜,导致其菌落数增加。
2.2 乳酸的分离与鉴定
2.2.1 乳酸菌的分离和初步鉴定
根据乳酸菌的形态学特征,从7 份样品(DRF2、CS1、HL1、JL3、SY1、ZSXY和ZS1)中分离出24 株乳酸菌,经过革兰氏染色和过氧化氢酶阴性反应,24 株菌均为革兰氏阳性菌株,过氧化氢酶为阴性。初步分离出10 株杆菌和14株球菌为乳酸菌疑似菌株。部分乳酸菌菌株的镜检结果如图1所示。
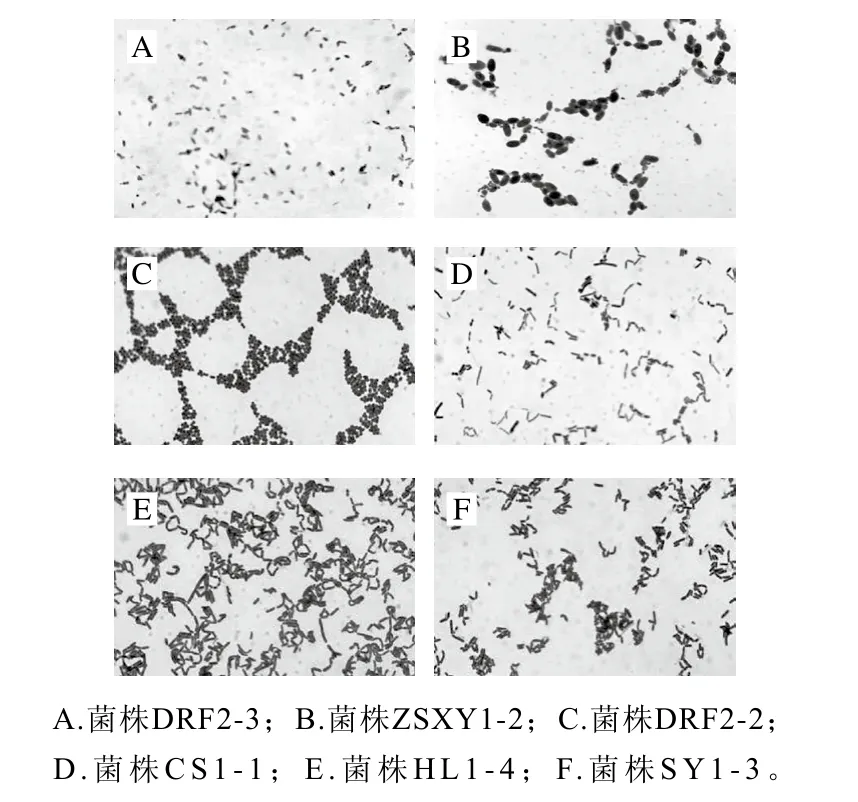
图1 乳酸菌部分菌株镜检结果(×100)Fig.1 Microscopic images of selected isolates from seven pickle samples ( × 100)
2.2.2 PCR扩增结果
以分离菌株提取的基因组DNA为模板,进行PCR扩增,采用1%琼脂糖凝胶泳对其进行检测。若所扩增的产物在1 500 bp左右处有明显条带,说明PCR扩增成功,可以进行变性梯度凝胶电泳。乳酸菌疑似菌的DNA的PCR扩增产物的结果如图2所示。

图2 PCR产物检测电泳图Fig.2 Electrophoresis of PCR amplified 16S rDNA sequence
2.2.3 乳酸菌16S rDNA同源性比对结果

表3 16S rDNA同源性比对结果Table3 Homology analysis of lactic acid bacteria by 16S rDNA sequence
根据表3序列比对结果可知,乳杆菌属(Lactobacillus)的菌株为:ZSXY1-1和SY1-3为干酪乳杆菌(L. casei),CS1-2和HL1-4为弯曲乳杆菌(L. curvatus),ZS1-1为类植物乳杆菌(L.paraplantarum),ZS1-3、HL1-1和CS1-1为植物乳杆菌(L. plantarum),CS1-4和HL1-3为戊糖乳杆菌(L.pentosus);肠球菌属(Enterococcus)的菌株为:HL1-2为Enterococcus sp. Y12,ZS1-2为Enterococcus sp. M7,DRF2-2为粪链球菌(E. lactis),ZSXY1-2、JL3-1和SY1-1为屎肠球菌(E. faecium),SY1-2和JL3-2为明串珠菌(L. lactis);链球菌属(Streptococcus)的菌株:JL3-3和CS1-3为Streptococcus sp.;气球菌属(Aerococcus)的菌株为:DRF2-4为Aerococcus sp.;魏斯氏菌属(Weissella)的菌株为:DRF2-3为微小魏斯氏菌(W. minor);DRF2-1和SY1-4为绿色魏斯氏菌属(W. viridescens)。
3 讨论与结论
由于实验采集的样品发酵液来自不同的地点、条件和工艺,因此导致成分含量和乳酸菌构成产生差异。对27 份样品的理化指标根据采样地点的不同进行差异显著性分析,发酵液当中亚硝酸盐含量、NaCl含量和氨基酸态氮含量出现显著差异(P<0.05),然而部分样品总酸含量和菌落总数并没有明显的差异(P>0.05),但多数存在显著差异(P<0.05)。从7 份在样品风味特征中具有代表性的自然发酵锦州小菜进行乳酸菌分离筛选,DRF2和SY1两种样品的总酸含量较低,发现样品中均有W. viridescens的存在,能够起到降酸作用。CS1、HL1和ZS1三种样品的亚硝酸含量较低,其中ZS1样品的亚硝酸含量较HL1和CS2低,原因是ZS1样品中的L. plantarum能够发酵产酸、醛、酯类物质,小菜经过一段时间发酵后,碳水化物和蛋白质发生水解,有利于人体的消化吸收,其酸类物质及代谢产物会抑制亚硝酸盐含量的生成。DRF2样品中含有W. minor,研究表明,在8% NaCl质量分数时生长较快,在其他NaCl质量分数的条件下生长可能会受到抑制,尤其在10% NaCl条件下W. minor会受到明显的抑制作用。
自然发酵性食品中蕴藏着丰富的乳酸菌资源,国内外学者从自然发酵性蔬菜制品中分离出不同种类的乳酸菌资源,证明乳酸菌是自然发酵蔬菜制品中的优势菌群,在发酵过程中起着至关重要的作用。锦州小菜是东北辽宁省发酵性食品的代表。在自然发酵锦州小菜中分离筛选出的乳酸菌中发现,乳杆菌属(Lactobacillus)数量明显多于魏斯氏菌属(Weissella),泡菜等发酵食品中的魏斯氏菌(Weissella)在发酵初期为优势菌种,在发酵后期被乳酸杆菌(Lactobacillus)代替。对7 份自然发酵小菜样品进行乳酸菌分离,共分离出24 株乳酸菌。其中不但分离出L. casei、E. faecium、L. curvatus、L. pentosus、Streptococcus sp.、Enterococcus sp.、L. lactis、Aerococcus sp.等常见的乳酸菌,同时还有W. viridescens、W. minor,这是其他文献鲜有报道的。
通过本研究可知,自然发酵的锦州小菜中蕴含丰富的乳酸菌资源,与其他的泡菜等发酵性食品相比,自然发酵的锦州小菜有独特的乳酸菌种类、组成,并且具有区域性发酵食品的代表特点。从锦州小菜中分离筛选出优势乳酸菌进行纯种发酵,为自然发酵锦州小菜的工艺改进及产品的研发提供参考,也为探究自然发酵锦州小菜的风味特征与微生物之间的联系和工业化生产提供了参考。
