酸性染料比色法测定燕麦中总生物碱含量条件优化
2019-01-26王晶晶宋诗清姚凌云
王晶晶,孙 敏,宋诗清,冯 涛,姚凌云
(上海应用技术大学香料香精技术与工程学院,上海201418)
燕麦(Avena sativa L.)是目前唯一的全谷物进食、有益健康的食品[1]。燕麦的高营养价值不仅表现在其富含蛋白质、油脂、膳食纤维等营养成分,更重要的是富含多种抗氧化、降血脂等作用的生物活性物质[2-4]。其中,燕麦生物碱(Avenanthramides) 是一类独特的含氮酚酸类衍生物[5-6],兼有抗炎、抗增殖和止痒等生物活性[7-10],在食品、药物和化妆品等行业具有广泛应用[1,11-12]。因此,建立燕麦总生物碱的检测方法十分有必要。
目前,国内外在燕麦生物碱的提取、分离及生物活性方面已有大量研究,而燕麦中总生物碱含量的测定方法鲜见报道。文献中对于燕麦生物碱含量的检测,主要采用 HPLC 法[13-16],即通过与合成的燕麦生物碱标准品比对,对燕麦生物碱进行分析鉴定。HPLC虽有分离效果好、精密度高等优点,但所需标准样品的单体复杂不易得,目前尚未有商业化的标准品,因此该法的广泛应用受到限制。酸性染料比色法具有较好的专属性和精密度,灵敏度高,简便易行,是测定总生物碱含量的经典方法之一,近年来在生物碱的检测中应用较多。曾王旻等[9]采用了中国药典中测定总生物碱的通用方法来测定燕麦总生物碱含量,该法以小檗碱作为对照,其与蒽酰胺的结构差距较大,可能会导致测定结果不够精确,同时未优化燕麦生物碱的测定条件。
曲尼司特(Tranilast)具有与燕麦生物碱相似的化学结构和紫外吸收特征,可作为一个较好的对照品用于燕麦蒽酰胺类物质的定量测定[17]。本研究以曲尼司特为标准品对照,采用酸性染料比色法针对性地测定燕麦总生物碱含量。通过对酸性染料比色法的染料种类、缓冲溶液种类和酸性染料用量的系统考察,建立了燕麦中总生物碱含量的测定方法。
1 材料与方法
1.1 材料与仪器
燕麦 上海谷子地生物技术有限公司提供;曲尼斯特 阿拉丁试剂有限公司。
DHG-9140电热鼓风干燥箱 上海一恒科技有限公司;ML 104/02电子天平 上海梅特勒-托利多仪器有限公司;FE20 Plus实验室p H计 上海梅特勒-托利多仪器有限公司;SK5200BT超声波清洗器 上海科导超声仪器有限公司;UV2350型紫外可见分光光度计 上海尤尼柯仪器有限公司;TGL-16M台式高速冷冻离心机 长沙高新技术开发区湘仪离心机仪器有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 试验溶液的制备
1.2.1.1 对照品的选择 由于燕麦生物碱的结构与临床抗组胺及抗炎药物曲尼司特(Tranilast)的结构非常相似(见图1),因此选曲尼司特作为对照品[17]。
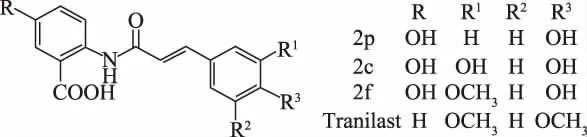
图1 三种主要燕麦生物碱及曲尼司特结构Fig.1 Structure of the three major avenanthramides and Tranilast
1.2.1.2 燕麦总生物碱供试品溶液的制备 将燕麦颗粒用粉碎机粉碎后过80目筛,备用。取粉碎过筛后的燕麦粉末10 g,加入80%的乙醇溶液350 mL置于超声装置(480 W,60℃)中提取两次,每次30 min,提取之后过滤,合并滤液,于旋转蒸发器中真空浓缩(-0.1 MPa,45℃)定容至50 mL容量瓶中,即得供试品溶液。
1.2.2 酸性染料比色法试验条件的确定
1.2.2.1 酸性染料比色法最大吸收波长的扫描 精密吸取15.3 mg/L曲尼斯特溶液2.0 mL,置于分液漏斗中,加入5.0 mL p H为5.4的乙酸-乙酸钠缓冲溶液,再加入溴甲酚紫染料2.5 mL,摇匀,加入5.0 mL二氯甲烷溶液进行萃取,振摇3 min,静置30 min,重复萃取三次,直至二氯甲烷层无色,合并二氯甲烷溶液并加入0.5 g无水硫酸钠,放置30 min,作为离子对提取溶液,以二氯甲烷溶液为空白对照,在200~500 nm波长范围内进行全波长扫描。
1.2.2.2 酸性染料种类的选择 精密吸取2.0 mL供试品溶液置于分液漏斗中,加入5.0 mL pH为5.4的乙酸-乙酸钠缓冲溶液,各取溴甲酚绿、溴甲酚紫、溴百里香酚蓝酸性染料溶液2.5 mL,摇匀,加入5.0 mL二氯甲烷进行萃取,振摇3 min,静置30 min,重复萃取三次,直至二氯甲烷层无色,合并二氯甲烷溶液并加入0.5 g无水硫酸钠,放置30 min,作为离子对提取溶液组,以二氯甲烷溶液作为空白对照,在340 nm进行吸光度测定。
1.2.2.3 缓冲溶液的选择 精密吸取2.0 mL供试品溶液置于分液漏斗中,加入5.0 mL pH为5.4的乙酸-乙酸钠、磷酸二氢钠-氢氧化钠、邻苯二甲酸氢钾-氢氧化钠缓冲溶液,再加入溴甲酚紫溶液2.5 mL,摇匀,加入5.0 mL二氯甲烷进行萃取,振摇3 min,静置30 min,重复萃取三次,直至二氯甲烷层无色,合并二氯甲烷溶液并加入0.5 g无水硫酸钠,放置30 min,作为离子对提取溶液组,以二氯甲烷溶液作为空白对照,在340 nm处进行吸光度测定。
1.2.2.4 酸性染料用量的选择 精密吸取2.0 mL供试品溶液置于分液漏斗中,加入5.0 mL pH为5.4的磷酸二氢钠-氢氧化钠缓冲溶液,再加入溴甲酚紫溶液2.5 mL,摇匀,加入5.0 mL二氯甲烷进行萃取,振摇3 min,静置30 min,重复萃取三次,直至二氯甲烷层无色,合并二氯甲烷溶液并加入0.5 g无水硫酸钠,放置30 min,作为离子对提取溶液组,以二氯甲烷溶液作为空白对照,在340 nm处进行吸光度测定。同方法测定溴甲酚紫染料用量为1.5、2.0、3.0、3.5、4.0 mL时的吸光值。
1.2.3 酸性染料比色法的方法学考察
1.2.3.1 标准曲线的绘制 取153 mg/L的曲尼司特溶液,采用无水乙醇稀释成浓度为0.306、1.53、3.06、4.59、6.12、15.3、30.6、45.9 mg/L 的稀释液,各稀释液均加入p H为5.4的磷酸二氢钠-氢氧化钠缓冲溶液5.0 mL,再加入溴甲酚紫3.0 mL,摇匀,加入二氯甲烷5 mL,振摇3 min,静置30 min,重复萃取三次,直至二氯甲烷层无色,合并二氯甲烷溶液并加入0.5 g无水硫酸钠,放置30 min,以二氯甲烷溶液作为空白对照,于340 nm处测定吸光度。以曲尼斯特浓度为横坐标,吸光度为纵坐标绘制标准曲线。
1.2.3.2 燕麦总生物碱的测定 精密吸取一定体积提取液,利用标准曲线绘制法测定吸光度,然后由标准曲线可得燕麦生物碱质量浓度c(mg/L),则燕麦生物碱得率为:
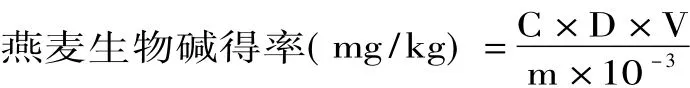
式中:c-根据标准曲线方程计算出的燕麦生物碱的质量浓度(mg/L);D-稀释倍数;V-原提取液的体积(L);m-燕麦粉末质量(g)。
1.2.3.3 精密度试验 精密吸取15.3 mg/L曲尼司特标准品溶液2.0 mL置于分液漏斗中,其余步骤按“1.2.3.1”法操作,连续测定6次,记录吸光度。
1.2.3.4 稳定性试验 精密吸取同一燕麦总生物碱提取液 2.0 mL,分别在 0.0、0.5、1.0、1.5、2.0、2.5、3.0 h按“1.2.3.1”法于340 nm处测定吸光度,记录吸光度。
1.2.3.5 重现性试验 取同一批次的燕麦粉末6份,每份10 g,均按照供试品制备项下方法制备,精密吸取供试液2.0 mL置于分液漏斗中,其余步骤按“1.2.3.1”法操作,平行测定6次吸光度值,记录吸光度。
1.2.3.6 加样回收率试验 精密吸取6份已知浓度的供试品溶液1.0 mL(10.8347 mg/L),分别加入不同浓度的曲尼司特溶液1.0 mL(表1),混匀,其余步骤按“1.2.3.1”法操作,并于340 nm下测定吸光度,根据回归方程计算加样回收率:
加样回收率(%)=(加标试样测定值-试样测定值)×100/加标量
1.3 数据与处理
采用ChemDraw软件绘制化学结构图。若无特别说明,实验数据为3次平行实验的平均值,试验结果以平均值±标准差(means±SD)表示,所得数据利用Origin 9.0绘制各个因素的动力学曲线。
2 结果与分析
2.1 酸性染料比色法测定条件的选择
2.1.1 最大吸收波长的确定 试验结果如图2所示,酸性染料与曲尼司特溶液在340 nm处形成最大吸收波长的稳定络合物,该结果与文献报道结果类似[17],因此选择340 nm作为生物碱测定的检测波长。
2.1.2 酸性染料种类的确定 不同酸性染料与燕麦生物碱结合的最大吸光度有所不同(图3)。其中,溴甲酚紫与供试品溶液形成的离子对在340 nm处有最大吸光度值,其次为溴百里香酚蓝和溴甲酚绿。溴百里香酚蓝在300~500 nm范围内有紫外吸收,会对检测造成较大干扰[18]。本试验中溴百里香酚蓝乙醇溶液紫外扫描结果与文献[18]报道一致,其波峰和波谷分别在370 nm和335 nm(图4),波谷位置与曲尼司特的波峰340 nm(图2)接近,这可能会导致曲尼司特和溴百里香酚蓝形成络合后紫外吸收的下降(图3),因而不宜用作燕麦生物碱测定的染料。另外,溴甲酚紫比溴甲酚绿更加经济实惠,因此综合考虑,将酸性染料确定为溴甲酚紫。
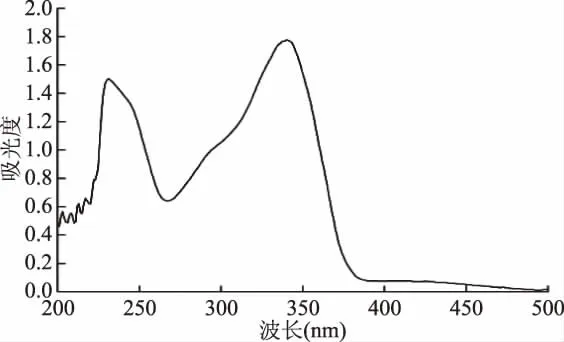
图2 对照品溶液的紫外-可见吸收图谱Fig.2 UV-visible absorption spectra of reference solution
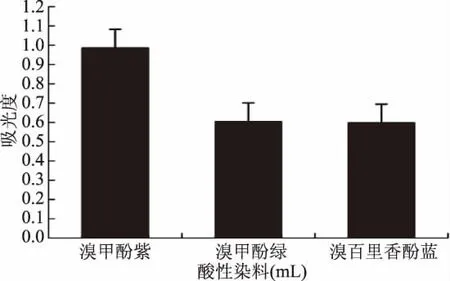
图3 不同酸性染料对燕麦生物碱溶液吸光度的影响Fig.3 Effect of different acid dyes on absorbance of total avenanthramides solution
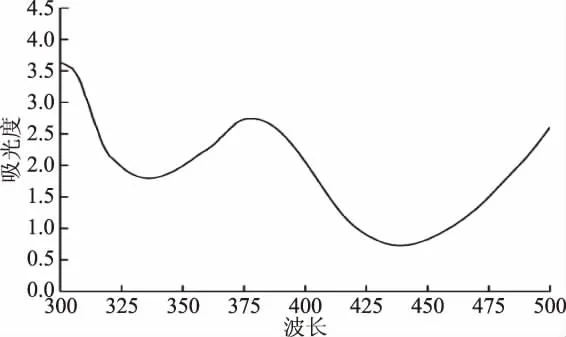
图4 溴百里香酚蓝紫外-可见吸收图谱Fig.4 UV Vis absorption spectra of bromothymol blue
2.1.3 缓冲溶液的确定 不同缓冲体系对燕麦总生物碱含量测定的吸光度有所影响,但磷酸二氢钠-氢氧化钠缓冲溶液的离子对吸光度最大(图5),因此选择磷酸二氢钠-氢氧化钠溶液作为后续实验的缓冲溶液。

图5 不同缓冲溶液对燕麦总生物碱溶液吸光度的影响Fig.5 Effect of different buffer solutions on absorbance of total avenanthramides solution
2.1.4 酸性染料用量的确定 试验所用酸性染料的用量对结果具有一定的影响,不同的酸性染料用量,具有不同的吸光度值(图6)。在1.5~3.0 mL范围内增加酸性染料用量时,吸光度值逐渐增大,之后再增加酸性染料用量,吸光度值反而减小。这可能是因为酸性染料用量约为3.0 mL时已经与燕麦生物碱完全结合,生物碱被充分萃取,吸光度达到最大。继续增加酸性染料用量时,空白溶液颜色呈加深现象,这可能对测量结果造成一定的干扰,使吸光度下降(图6)。因此最佳的酸性染料用量选择3.0 mL。
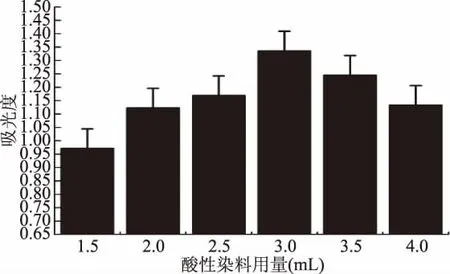
图6 缓冲溶液的不同用量对燕麦总生物碱吸光度的影响Fig.6 Effect of different dosage of buffer solution on absorbance of total avenanthramides solution
2.2 标准曲线绘制与燕麦总生物碱的检测
2.2.1 曲尼司特标准曲线 试验结果如图7所示,经试验数据处理,得曲尼司特标准品溶液的吸光度与浓度之间的回归方程为y=0.04837x+0.00822(x表示溶液浓度,y表示吸光度值),R2=0.9994。结果表明,燕麦生物碱含量在0.306~45.9 mg/L范围内与吸光度呈良好的线性关系。
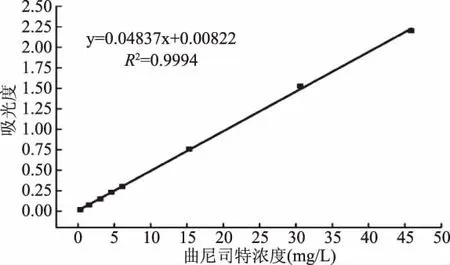
图7 曲尼司特标准曲线Fig.7 Standard curve of tranilast
2.2.2 燕麦总生物碱的测定 根据以上筛选的结果,供试品(2 mL)中总生物碱的测定条件为:染料溴甲酚紫(3 mL),p H5.4的磷酸二氢钠-氢氧化钠缓冲溶液,检测波长340 nm。在此条件下,采用标准曲线绘制法测定出供试品的吸光度并计算燕麦生物碱质量浓度c(mg/L)。燕麦生物碱的得率按照“1.2.3.2”中的公式计算,最终结果为(48.63±1.02)mg/kg(n=3)。
2.3 精密度试验
精密吸取15.3 mg/L曲尼司特对照品溶液2.0 mL置于分液漏斗中,其余步骤按“1.2.3.1”法操作,连续测定6次,测得RSD=0.12%,小于2%,表明精密度符合要求。
2.4 稳定性试验
精密吸取同一燕麦总生物碱提取液2.0 mL,分别在0.0、0.5、1.0、1.5、2.0、2.5、3.0 h 按“1.2.3.1”法于340 nm处测定吸光度,结果RSD=1.26%,表明供试品溶液在3.0 h内基本稳定(注意保持装置的气密性良好)。
2.5 重现性试验
取同一批次的燕麦粉末6份,每份10 g,均按照供试品制备项下方法制备,精密吸取供试液2.0 mL置于分液漏斗中,其余步骤按“1.2.3.1”法操作,平行测定6次吸光度值,RSD=0.031%,表明实验方法重现性良好,符合含量测定要求。
2.6 加样回收率试验
精密吸取6份已知浓度的供试品溶液1 mL(10.8347 mg/L),分别精密加入一定量的曲尼司特溶液(表1),混匀,其余步骤按“1.2.3.1”法操作,并于340 nm下测定吸光度,根据回归方程计算回收率,结果见表1,该方法回收率在92.28%~96.53%之间,其平均回收率为94.22%,RSD=1.79%(n=6),说明该方法具有比较良好的回收率。
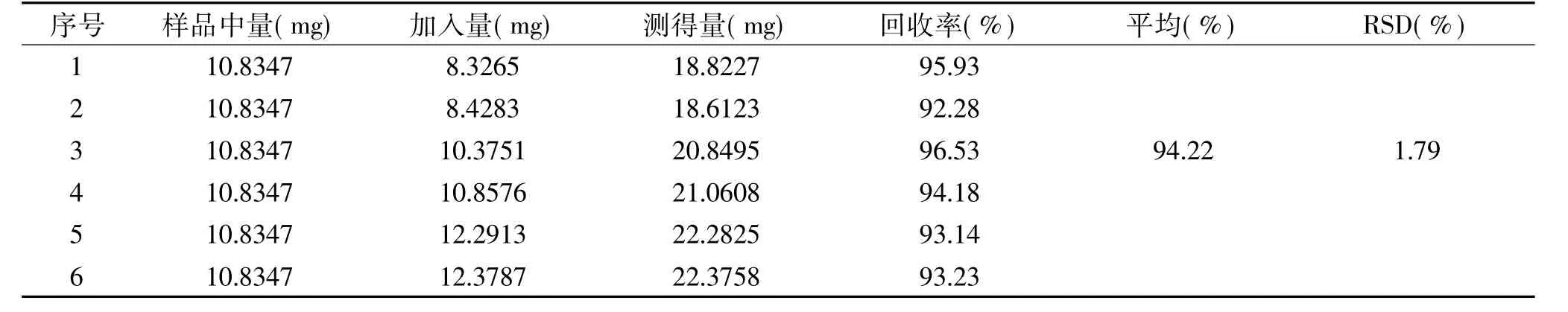
表1 加样回收率实验结果Table 1 Result of the recovery test
3 结论与讨论
本试验采用酸性染料比色法检测燕麦总生物碱含量,研究了影响酸性染料比色的几个因素,最终确定了最佳条件:酸性染料为溴甲酚紫,缓冲溶液为p H为5.4的磷酸二氢钠-氢氧化钠,酸性染料用量为3 mL。试验结果表明,该方法具有较好的专属性和精密度,灵敏度高,简便易行,是测定燕麦总生物碱含量的一种方法。本方法与曾王旻等[19]的滴定法测燕麦总生物碱含量相比,最终的测定结果比较接近,但采用滴定法的文献中没有对结果的准确性进行验证。滴定法操作较繁琐,终点确定往往难以准确判断,而且该法对含有一定色素的生物碱含量测定欠缺准确性[20]。作者在前期考察滴定法测定燕麦总生物碱含量的试验中,发现存在误差较大,重复性不好(RSD>10%)等问题(实验数据未显示),很可能是受终点判断的影响。黄建明等[21]曾采用容量法(硫酸回滴法)与酸性染料比色法测定草乌中总生物碱含量,得出二者均能准确测定总生物碱含量,其中酸性染料比色法灵敏度较高,这与本研究的结果一致。
燕麦醇提物中除含有生物碱之外,还存在多酚、黄酮、皂苷等物质,复杂的多组分体系可能会对生物碱的测定造成一定干扰。根据文献报道[13,17],燕麦生物碱的紫外吸收特征与曲尼司特(图2)相似,在240和340 nm处有最大吸收峰。对于燕麦黄酮,其紫外最大吸收波长在270和420 nm附近[22],与燕麦生物碱存在一定差异,而燕麦皂苷和多酚分别在560 nm[23]和 760 nm[24]有最大吸收,与燕麦生物碱差异较大。因此,在燕麦提取物中,采用本方法对燕麦生物碱的含量进行测定时受其他物质干扰的影响较小,对于经过富集、除杂过程的生物碱测定可能会具有更好的适用性。但是,对于更复杂的体系组分,如含燕麦的混合原料中生物碱含量的测定,本方法的可行性则需要进一步的验证。燕麦总生物碱含量受燕麦品种、生长环境、栽培条件等因素的影响,不同研究者在燕麦中检测到的总生物碱含量分布为25.21~347.55 mg/kg[25]。本研究中,测得燕麦中总生物碱含量均值为48.63 mg/kg,符合文献报道的生物碱含量范围,与Maliarova等[7]报道的含量较接近,结果具有较好的准确度。因此,酸性染料比色法是测定燕麦总生物碱含量的一种简便、可信的检测方法,可为燕麦总生物碱的分析检测提供科学的依据和参考。
