羟自由基氧化体系对大黄鱼肌原纤维蛋白结构的影响
2019-01-26雷叶斯杨巨鹏吕春霞陈世达张慧恩
雷叶斯,杨巨鹏,吕春霞,陈世达,张慧恩,杨 华
(浙江万里学院,浙江宁波315100)
大黄鱼(Pseudosciaena crocea),又称石首鱼,是中国近海主要的经济鱼类之一[1],在我国海洋渔业中占有重要的地位[2]。我国大黄鱼养殖产量占世界养殖总产量的70%以上,我国也是唯一一个大黄鱼养殖量超过捕捞量的国家[3]。但是中国的水产品加工率只有30%,而发达国家已经超过了80%[4]。因此鱼类的深加工有着巨大的发展前景。目前我国已经研究出多种大黄鱼干制方法,近年来也开发了一些休闲小零食产品,但仍有很大一部分大黄鱼积压、养殖户亏损等现象,因此研究开发大黄鱼加工产品具有重要意义[5-6]。
脂质氧化、微生物和酶的作用是食物腐败变质的主要原因,而蛋白质氧化所引起的食物品质劣变的研究较少[7]。研究发现,蛋白质氧化对肉品的肉色、嫩度有很大的影响[8]。蛋白质氧化是指蛋白质分子在活性氧(Reactive oxygen species,ROS)的直接作用下,或者是通过氢过氧化物和活性醛类等次生氧化产物但不直接作用于蛋白质,引起的蛋白质空间方面和功能性质的变化[9]。羟基自由基氧化体系主要由抗坏血酸钠、过氧化氢(H2O2)和三氯化铁(FeCl3)发生氧化还原反应产生自由基。Park等[10]研究了模拟氧化体系对猪肌原纤维蛋白质的影响,发现其蛋白质羰基含量、硫代巴比妥酸含量及Ca2+-ATPase活性发生改变。李学鹏等[11]研究了模拟氧化体系对六线鱼蛋白质的影响,认为·OH会对其鱼肉蛋白质的羰基、总巯基、游离氨基酸含量产生影响。Xiong等[12]发现在猪腹部肌肉中羟自由基攻击肌球蛋白的头部和尾部。
本实验采用羟自由基氧化体系,研究养殖大黄鱼肌原纤维蛋白的羰基含量、表面疏水性、活性疏基含量、溶解度、SDS-PAGE凝胶电泳和持水性的变化,探索羟自由基氧化对养殖大黄鱼肌原纤维蛋白的影响,以期为控制养殖大黄鱼贮存和加工过程中鱼肉品质发生变化提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜养殖大黄鱼(0.5~1.0 kg) 宁波市水产市场;抗坏血酸、盐酸胍、2,4-二硝基苯肼(DNPH)、甘氨酸、三氧化铁、过氧化氢、BHT、磷酸缓冲液、乙酸乙酯、乙醇、溴酚蓝、三氯乙酸 均为分析纯,国药集团化学试剂有限公司;三羟甲基氨基甲烷、2-硝基苯甲酸试剂、双缩脲试剂、十二烷基磺酸钠-聚丙烯酰胺凝胶电泳标准蛋白(12~120 kDa) 北京索莱宝有限公司。
FC型酶标仪 赛默飞世尔仪器有限公司;uv2000紫外分光仪 上海舜宇恒平科学仪器有限公司;Gene Navigator电泳仪 美国 Amershaw公司;FSH-2A高速匀浆机 上海维城仪器有限公司;J-26XP高速冷冻离心机 美国贝克曼库尔特;F-80高速粉碎机 姜堰市新康医疗器械有限公司。
1.2 实验方法
1.2.1 大黄鱼肌原纤维蛋白的提取 参照李艳青[13]的方法提取养殖大黄鱼肌原纤维蛋白。将鱼肉用搅拌机搅碎,加入4倍鱼肉体积的20 mmol/L冰磷酸缓冲液(pH7.0)进行2次均质,每次时间为30 s,时间间隔为30 s,4℃条件下离心10 min(7300 r/min),除去上清液。用4倍体积冰洗液(0.1 mol/L NaCl溶液)清洗,重复清洗2次,最后用医用脱脂纱布过滤后离心10 min(7000 r/min,4℃),得到的沉淀为养殖大黄鱼肌原纤维蛋白,用双缩脲试剂盒测定蛋白含量,称重后置于4℃下密闭瓶中保存。
1.2.2 羟自由基氧化体系模拟强氧化过程 参照Oliver等[14]的方法,采用·OH 产生氧化系统,即产生一种活性氧就是羟自由基,它主要是由铁的氧化还原反应而产生的,系统采用的是三氧化铁、抗坏血酸钠和过氧化氢。保持三氯化铁浓度为0.1 mmol/L,抗坏血酸浓度为0.1 mmol/L,使 H2O2浓度分别为0、0.1、1、5、10、20 mmol/L。
将提取到的肌原纤维蛋白用50 mmol/L磷酸缓冲液(pH6.0)溶解,使其质量浓度为20 mg/mL。然后将蛋白液和氧化体系以2∶1的体积比混合,将混合液于4℃下避光分别氧化1、3、5 h,目的是使鱼的肌原纤维蛋白发生不同程度的氧化。最后添加BHT(使其最终含量为0.02%)使反应终止。氧化最后的产物用磷酸缓冲液(pH6.0)进行洗涤,然后在8000 r/min下离心5 min,弃上清,分装,于-80℃保存待用[15]。
1.2.3 羰基含量的测定 参考Oliver等[14]测定肌原纤维蛋白中羰基的方法,稍做调整。取1.2.1中提取的肌原纤维蛋白,溶于50 mmol/L磷酸缓冲液(p H6.0)中,调整浓度为2 mg/mL,取1 mL于离心管中,再加入10 mmol/L 2,4-二硝基苯肼溶液1 mL,静置1 h,加入1 mL 20%的三氯乙酸,离心 5 min(10000 r/min),去上清液,用1 mL乙酸乙酯-乙醇(体积比1∶1)清洗沉淀3次,再加入6 mol/L盐酸胍溶液3 mL,37℃下水浴15 min,除去不溶物。取上清液离心3 min(10000 r/min),所得到的溶液在370 nm 下测得吸光度[12]。
1.2.4 表面疏水性的测定 参照Chelh等[16]的方法。配制5 mg/mL的蛋白溶液。取1 mL蛋白溶液于离心管中,加入1 mg/mL溴酚蓝200μL。离心15 min(6000 r/min),将上清液稀释10倍后于595 nm下测定吸光度A。空白组为不加蛋白的溶液。表面疏水性的计算公式为:
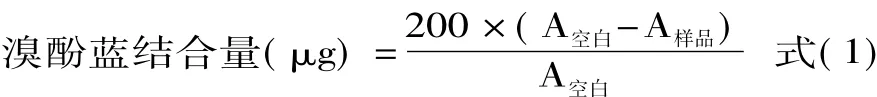
1.2.5 活性巯基含量的测定 参照李艳青等[17]的方法。取浓度为2%的蛋白溶液1 mL加入Tris-甘氨酸溶液8 mL,接着均质和离心15 min(10000 r/min),除去不溶性的蛋白。取4.5 mL上清液和0.5 mL Ellman试剂进行反应,30 min后分别测定在540、412 nm波长处的吸光度。未氧化的蛋白溶液为对照组,其中有4.5 mL Tris-甘氨酸和0.5 mL Ellman试剂。
活性巯基含量(μmol·g-1MPI)=73.53 × (A412nm-1.6934×A540nm+0.009923) 式(2)1.2.6 溶解度的测定 参照Santelhoutellier等[18]的方法并做适当修改。称取养殖大黄鱼样品0.5 g,溶解在9 mL 0.6 mol/L氯化钾溶液中,混合匀浆30 s,4℃下离心10 min(7500 r/min)。取5 mL上清液,在4℃下加入500 g/L三氯乙酸中,使得蛋白溶液体积分数为10%。10%的三氯乙酸清洗沉淀物,用0.5 mol/L氯化钠溶液溶解。双缩脲试剂盒测定蛋白含量。按下面的公式(3)计算蛋白中的溶解度。

1.2.7 SDS-PAGE凝胶电泳 参考李学鹏等[15]的方法并做适当修改。配制蛋白溶液使浓度为1 mg/mL,用振荡仪将蛋白混合1 min,在100℃下水浴3 min。开始电泳时电流为80 V,等到溴酚蓝到达浓缩胶和分离胶的界面时,电压调到120 V;当溴酚蓝迁移到凝胶的最下面接近1 cm时,关闭电泳仪;取出后的凝胶用考马斯亮蓝染色2 h,并用甲醇-冰醋酸脱色液脱色,不断更换脱色液,直至呈现清晰的条带为止。
1.2.8 持水性的测定 参考李强[19]的方法并做了适当修改。准确称取0.5 g蛋白样品于离心管中,用玻璃棒把蛋白搅拌均匀,缓慢加水进去直到样品黏糊;然后在3000 r/min下离心10 min,弃上清,称重;根据离心前后的离心管的重量对蛋白质的持水性进行计算,计算公式为:
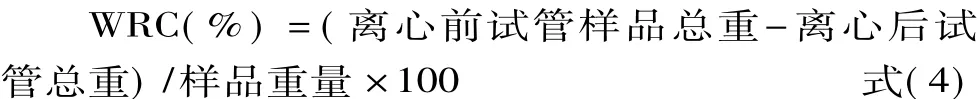
1.3 数据统计分析
本实验采用Excel及SPSS进行数据统计分析,重复3次实验。
2 结果与分析
2.1 养殖大黄鱼肌原纤维蛋白羰基含量的变化
羰基的形成是蛋白质氧化后最明显的变化之一[10]。有4种途径产生羰基:氨基酸侧链直接被氧化;肽主链断裂;与还原糖发生反应;结合非蛋白羰基化合物[10]。侧链上带有NH-或NH2-的氨基酸会被羟自由基攻击,被转化成NH3和相应的羰基衍生物[15]。由图1可知,经过H2O2处理的羰基含量均比未处理前显著升高(p<0.05)。在相同的氧化时间下,羰基的含量会随着H2O2浓度的升高呈升高趋势;氧化时间1、3 h时,羰基含量随浓度是先增加后降低再增加的趋势,氧化时间为5 h时,羰基含量呈增加趋势;0~1 mmol/L H2O2处理时,羰基含量呈不断升高趋势,这说明,H2O2浓度对蛋白质的氧化程度有较大影响。
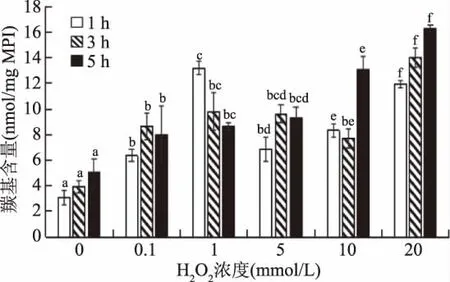
图1 自由基氧化体系对养殖大黄鱼MPI羰基含量的影响Fig.1 Effect of free radical oxidation system on carbonyl content of MPI in cultured Pseudosciaena crocea注:不同小写字母表示具有显著性差异(p<0.05);图2~图4,图6 同。
由此可知,经过羟自由基氧化体系氧化后,羰基含量有一定程度的增加。这和Park等[10]研究的猪肉MPI所得出的结果是一致的,Park指出在高浓度的三氧化铁体系中,蛋白羰基含量在改变过氧化氢浓度以后会发生明显的增长。
2.2 养殖大黄鱼肌原纤维蛋白活性巯基含量的变化
一般而言,蛋白质氧化会使巯基变成二硫键,活性巯基含量可以作为蛋白氧化的重要指标之一[16]。Lund等[20]提出,蛋白氧化的程度在一定范围内可以用巯基含量的下降来表示。Dean等[21]也指出,巯基变成二硫键是最初期的氧化反应产物,二硫键的形成会导致蛋白结构表面巯基含量的下降,也可能是进一步的被氧化成磺酸类或者是其他氧化产物而导致的[18]。由图2可知,大黄鱼肌原蛋白的活性巯基含量在不同的氧化时间和不同的H2O2浓度下有明显的不同。在0~5 mmol/L浓度范围内,H2O2浓度不变时,随着氧化时间的延长,巯基含量降低,在5 mmol/L浓度下,氧化时间不同时,1 h氧化时间的活性巯基含量最高为7.05μmol/g MPI,3 h氧化时间的活性巯基含量次之,为5.41μmol/g MPI,5 h氧化时间的活性巯基含量最低,为4.80μmol/g MPI。氧化时间不变(1 h)时,随着H2O2浓度的增加,活性巯基含量呈降低趋势。在H2O2浓度为20 mmol/L时,活性巯基含量几乎不随时间的增加而增大。可能的原因是,巯基在高浓度的自由基氧化下,形成了多种氧化产物,如次磺酸基等,随着氧化的加剧,蛋白质断裂成一些小分子硫化物[17]。

图2 自由基氧化体系对养殖大黄鱼MPI活性巯基含量的影响Fig.2 Effect of free radical oxidation system on the active thiol content of MPI in cultured Pseudosciaena crocea
2.3 养殖大黄鱼肌原纤维蛋白表面疏水性的变化
蛋白的表面疏水性是用来衡量蛋白变性程度的,它能够反应蛋白位点在化学上或物理上的微妙变化,同时可以体现出蛋白表面疏水性氨基酸的相对含量[12]。表面疏水性在蛋白结构研究中是一个普遍的指标。一般认为,由于氧化使得埋藏在蛋白天然构像内部的疏水性氨基酸残基暴露出来,从而提高了蛋白表面的疏水性。
由图3可知,在相同的氧化时间下,蛋白的表面疏水性随着H2O2浓度的升高呈升高趋势,氧化时间1 h时,0 mmol/L H2O2浓度的大黄鱼肌原纤维蛋白的溴酚结合量最低,为43.46μg,20 mmol/L H2O2浓度的蛋白的溴酚蓝结合量最高,为47.33μg。而在相同H2O2浓度下,蛋白的表面疏水性随着氧化时间的增加呈升高趋势,在5 mmol/L H2O2浓度下,经过1 h的氧化表面疏水性最低,5 h氧化的表面疏水性最高。短时间的氧化使肌原纤维蛋白质发生较低的变性程度,分子结构变化不大、暴露少量的疏水基团,表面疏水性低;经过较长氧化以后,肌原纤维蛋白的结构会遭到破坏,暴露出分子内部的基团,增加蛋白的表面疏水性[12,17]。

图3 自由基氧化体系对养殖大黄鱼MPI表面疏水性的影响Fig.3 Effect of free radical oxidation system on surface hydrophobicity of MPI in cultured Pseudosciaena crocea
2.4 养殖大黄鱼肌原纤维蛋白溶解度的变化
影响蛋白质溶解度的因素分为内部和外部两种。内部主要是氨基酸组成、分子结构性;外部主要是温度、p H、离子种类、其他食品成分等[14]。蛋白质-蛋白质和蛋白质-水之间相互作用会影响蛋白质的溶解度[12]。由图4可以看出,氧化时间为1、3 h时,经H2O2处理后,溶解度明显呈下降趋势。在5 h时,其溶解度呈先上升后下降的趋势,在浓度达到5 mol/L时,其溶解度为42.52%,之后又开始下降。蛋白溶解度降低程度是和氧化程度是正相关的,氧化会引起蛋白的交联反应,使蛋白发生聚集和沉淀,导致溶解度降低,不同过氧化氢浓度和氧化时间使蛋白质的溶解度不同是由于其引起蛋白质聚集程度不同。
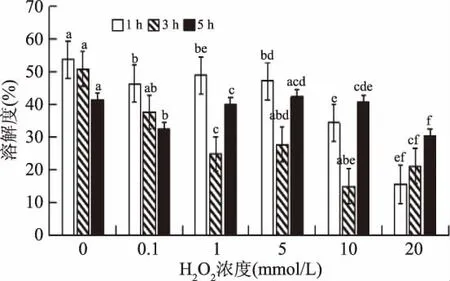
图4 自由基氧化体系对养殖大黄鱼MPI溶解度的影响Fig.4 Effect of free radical oxidation system on solubility of MPI in cultured Pseudosciaena crocea
2.5 SDS-PAGE凝胶电泳
肌原纤维蛋白在经过不同羟自由基浓度氧化后,分子量发生变化的情况可以通过SDS-PAGE凝胶电泳表现出来[19]。由图5可知,条带的颜色有些浅,这可能因为是蛋白浓度较小。40~20 kDa之间的条带肌动蛋白和原肌球蛋白条带强度明显增强。结合其他文献,在较高的氧化条件下,蛋白质可能发生交联,产生高分子量化合物,也可能是蛋白质聚集体的形成[14]。高分子质量聚集体的形成原因可能是由于半胱氨酸中巯基氧化形成分子间二硫键,也可能是因为蛋白质自由基之间发生聚集等原因[12]。由此可以推断出,蛋白质氧化使其空间结构发生了改变[18]。
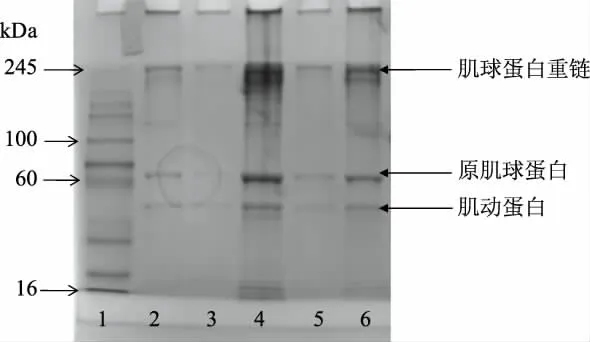
图5 3 h氧化养殖大黄鱼肌原纤维蛋白SDS-PAGE电泳图谱Fig.5 SDS-PAGE electrophoresis of MPI of cultured Pseudosciaena croceafter 3 h oxidation注:1:Marker;2:5 h 20 mmol/L H2 O2处理后的MPI;3:5 h 10 mmol/L H2 O2处理后的MPI;4:5 h 5 mmol/L H2 O2处理后的MPI;5:1 h 10 mmol/L H2 O2处理后的MPI;6:未经过氧化的处理后的MPI。
2.6 养殖大黄鱼肌原纤维蛋白持水性的变化
水分子可与蛋白质的一些基团结合,包括主肽链基团、带电基团、Asn和 Gln的酰胺基、Ser、Thr和Tyr残基的羟基和非极性残基。蛋白质的持水性和蛋白质的氨基酸组成时存在有关联的,水合能力与带电的氨基酸数目呈正比[21]。查阅相关文献[5]可知,随着氧化的延长,蛋白质的水合能力大幅度下降。从图6中可知,氧化时间为5 h时,随着H2O2浓度的增加,蛋白持水能力在下降。一方面,在氧化过程中,蛋白带电基团的减少会使得蛋白质等电点向中性靠近,与水结合能力下降;另一方面,蛋白质结合水的能力下降是因为蛋白质-蛋白质之间相互作用增强的关系,也就是蛋白质变性由于氧化的关系[22-23]。

图6 自由基氧化体系对养殖大黄鱼MPI持水性的影响Fig.6 Effects of free radical oxidation system on water holding capacity of MPI in cultured Pseudosciaena crocea
3 结论
利用羟自由基氧化体系对养殖大黄鱼肌原纤维蛋白进行氧化,发现肌原纤维蛋白在羟自由基氧化体系中发生了明显的交联和聚集现象。羟自由基氧化体系能造成肌原纤维蛋白羰基含量升高,且在相同的氧化时间下,随着自由基浓度升高,羰基含量呈升高趋势。SDS-PAGE凝胶电泳分析发现,氧化时间越久,氧化浓度越高,蛋白的电泳蛋白条越暗。经过自由基氧化发现,氧化时间不变(1 h)时,随着自由基浓度升高,肌原纤维蛋白的巯基含量总体呈下降趋势,而表面疏水性略有升高,故氧化能够导致蛋白的聚集或断裂。本文通过羟自由基氧化体系模拟强氧化环境,研究其对肌原纤维蛋白的影响,以便为养殖大黄鱼的贮藏和加工中发生氧化提供理论依据,进而更好的控制氧化的发生,减少鱼肉品质的劣变。
