产酸克雷伯菌中水解酶的表达及其在果蔬表面多菌灵去除中的应用
2019-01-26陈慧勤
陈慧勤,崔 婷
(1.苏州大学附属第一医院临床教学办,江苏苏州215006;2.北京联合大学图书馆,北京100101)
多菌灵(Carbendazim,MBC)是一种广谱苯并咪唑类抗真菌农药,对真菌引起的病害如灰霉病、白粉病等有着较好的防治效果,因此广泛应用于果蔬等植物病虫害的防控[1-3]。然而,多菌灵化学性质稳定,在环境中的半衰期较长,容易在果蔬表面造成严重的残留[4-6]。且农用多菌灵可湿性粉剂、悬浮剂等在果蔬表面附着力较强,难以实现较彻底的清洗[7]。多菌灵可引起人类多个器官的病变及细胞内DNA的突变,因此果蔬表面多菌灵残留对人体健康造成极大危害[8-9]。寻找多菌灵降解的有效方案成为解决该问题的关键。
可降解多菌灵的细菌已有较多报道。目前筛选到的多菌灵降解菌集中在红球菌、罗尔斯通氏菌、芽孢杆菌等几种[10-12],其中部分菌种可利用多菌灵为唯一碳源生长。然而微生物法降解多菌灵时间消耗较长且活体微生物制剂稳定性较差,难以实现果蔬表面多菌灵的快速降解。相比之下,从可降解多菌灵的微生物中筛选其水解酶成为较理想的选择。水解酶是一大类酶的总称,可用于多种化学键的催化断裂,如脂肪酸水解、蛋白水解等。多菌灵的第一步水解是其C-N单键的断裂,催化该化学键断裂的水解酶仅有部分报道,从诺卡氏菌、副球菌等中克隆出的水解酶均属于水解酶中降解非肽C-N键的亚类(EC3.5)[13-14]。该类酶属于酰胺水解酶,用于多种氨基酸的酶法合成,具有较高的催化活性和催化效率[15]。基于此种水解酶的专一性、有效性等指标,可将该酶使用于果蔬表面多菌灵残留的分解。
本研究拟从自然界中筛选高效多菌灵降解菌,并设计简并引物从降解菌中扩增其多菌灵水解酶基因。将水解酶基因在大肠杆菌BL21中过表达后进行蛋白纯化,并将纯化后的蛋白作为酶制剂对黄瓜、草莓等表面多菌灵残留的降解剂,用于日常生活中的果蔬农残清洗。
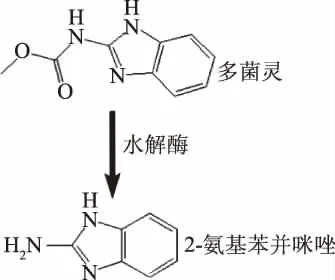
图1 多菌灵及其降解产物2-氨基苯并咪唑结构式Fig.1 Structure formula of carbendazim and its degradation product 2-aminobenzimidazole
1 材料与方法
1.1 材料与仪器
多菌灵可湿性粉剂 四川国光农化股份有限公司;多菌灵标准品 Sigma公司;实验所需各类试剂 北京化工厂;土壤样品 北京市平谷区桃树基地多菌灵使用区域采集;DNA合成及测序 北京华大基因;多菌灵筛选培养基成分为:多菌灵0.5 g/L,磷酸氢二钾0.3 g/L,磷酸二氢钾0.6 g/L,硫酸铵2 g/L,硫酸镁0.2 g/L,碳酸钙0.1 g/L,琼脂粉15 g/L;LB培养基成分为:氯化钠10 g/L,蛋白胨10 g/L,酵母粉5 g/L,固体培养基中加入琼脂粉15 g/L;His标签蛋白纯化试剂盒 碧云天生物科技有限公司;SDSPAGE所用上样缓冲液 北京全新拓达科技有限公司;用于实验的新鲜果蔬 均购自京东超市商城,购买当天即进行实验。
LC-20液相色谱仪、LCMS-8030液相色谱-质谱连用仪 日本岛津公司;754N紫外可见光分光光度计 上海奥普乐公司;DYCZ-24DN电泳仪 北京六一仪器厂;TGL-10B离心机 上海安亭公司;DHG-9070A培养箱及干燥箱 上海一恒仪器厂;Scienzt-IID超声细胞破碎仪 宁波新芝生物科技有限公司。
1.2 实验方法
1.2.1 菌种分离及鉴定
1.2.1.1 菌种的分离 取多菌灵污染的土壤样品0.5 g置于离心管中,使用无菌水吸打混匀后静置,取上清液涂布至多菌灵筛选培养基平板,倒置于37℃培养箱中恒温48 h后,将长出的菌落转移至新多菌灵筛选培养基传代,将连续3代在只含多菌灵的培养基上长出的单菌落挑出至LB液体培养基培养并保存。
1.2.1.2 菌种的鉴定 菌种的鉴定使用16S DNA比对法。参照参考文献[16],使用通用引物27F和1492R进行菌落PCR扩增,电泳确认后送至华大基因进行测序鉴定。系统发育树使用MEGA5.0软件绘制。
1.2.1.3 多菌灵降解实验 多菌灵降解实验所用培养基与筛选培养基所用无机盐相同,唯一碳源多菌灵的初始浓度设定为30 mg/L(前期实验结果)。将单菌落接种于4 mL的LB液体培养基中,并于37℃200 r/min条件下培养12 h,测定菌液OD600。调整其稀释倍数,使得0.1 g干重菌体细胞转接至装液量为100 mL的250 mL三角瓶中于37℃200 r/min条件下培养。每24 h取一定量的菌液进行后续生物量及多菌灵含量的测定。生物量参照文献采用比色法测定[17],将一定量的菌液经过12000 r/min离心10 min取上清液,对菌液中多菌灵含量通过HPLC测定。
1.2.2 基因克隆、蛋白表达及纯化
1.2.2.1 水解酶基因的克隆 将筛选出可降解多菌灵的菌种挑出至1 mL无菌水中混匀,进行基因组DNA提取。以提取后的基因组DNA为模板,设计简并引物 F:5'-CGCGGATCCATGGANCTCANTGAN CAGNATGC;3'- R:5'- CCCAAGCTTTCNTGCTGNCA GNCTGANCCTGT 3'-,使用梯度 PCR进行扩增。PCR程序为94℃、3 min,94 ℃、1 min,退火 40 s,72℃、1 min,30个循环;72℃、10 min,16℃保存。退火温度梯度为47、50、53、56、59、62、65 ℃。基因扩增后使用Bam HI和Hind III酶切位点切割基因和p ET-28a质粒,切胶回收后16℃连接过夜。将重组质粒与E.coli BL21感受态细胞混合后42℃热击90 s,加入1 mL的LB培养基,并涂布至含有30 mg/L的卡那霉素LB固体培养基中,37℃培养24 h后鉴定重组子。
1.2.2.2 蛋白的表达 将重组菌在含有卡那霉素(30 mg/L)及含0.05 mmol/L Isopropylβ-DThiogalactoside(IPTG)的 LB培养基中37℃200 r/min诱导表达 12 h后,取出 200 uL菌液12000 r/min离心10 min去上清,沉淀中加入蛋白电泳上样缓冲液后,沸水浴10 min,再次12000 r/min离心10 min后,使用上清液进行SDS-PAGE。SDSPAGE采用12%聚丙烯酰胺凝胶,上样量20 uL,恒压120 V。电泳结束后使用20 mmol/L的考马斯亮蓝G250常温染色2 h,换无菌去离子水脱色12 h。
1.2.2.3 蛋白的纯化 将重组菌接种在20 mL的LB液体培养基中,37℃下 200 r/min培养 12 h。12000 r/min离心10 min去上清后,使用 pH7.0的50 mmol/L磷酸钾缓冲液重悬细胞,进行细胞超声破碎(80 W,工作3 s,停2 s,100次)。蛋白纯化使用碧云天蛋白纯化试剂盒进行,将破碎液过镍柱后,使用试剂盒中W1洗涤液洗掉未吸附蛋白,再用试剂盒中D1洗脱液将目标蛋白洗脱。酶活测定时使用细胞破碎液10 uL或纯化后蛋白1 ug加入至含有1 mmol/L多菌灵溶液中,测定其在37℃培养箱中静置10 min后多菌灵残留,计算其消耗量。酶活定义为1 h内消耗1μmol/L多菌灵所需要的酶量。
1.2.3 果蔬表面农残降解 以土豆为例,将新鲜的土豆表面洗净,浸泡在含有10 mg/L的多菌灵溶液中5 min后取出。将土豆平均分组,其中实验组和对照组分别设置30个样品用于平行实验。自然晾干后分别取每组三个样品置于不同托盘中,将纯化后的水解酶KY-1配制为1 mg/L的水剂,以相等剂量喷洒于多菌灵浸泡后的土豆表面,对照组以相等体积的无菌水喷洒,喷洒后对照组和实验组分别置于30℃培养箱测定果蔬表面多菌灵降解。每隔24 h取出三个实验组和三个对照组的样品,分别浸泡在200 mL无菌水中10 min,取上清液过0.22 um微孔滤膜检测多菌灵含量。以初始晾干后果蔬表面多菌灵含量为100%,计算多菌灵降解率。
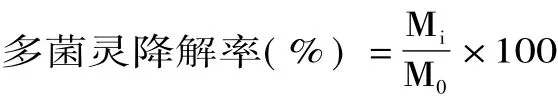
式中,M0为初始晾干后果蔬表面多菌灵峰面积;Mi为每次取样时测得该时间点果蔬表面多菌灵峰面积。
黄瓜、西红柿和草莓以相同的实验方法测定。
1.2.4 检测方法 多菌灵液相检测使用岛津LC-20液相色谱紫外检测器,C18色谱柱,柱温30℃,流动相为30%的甲醇水溶液,磷酸浓度0.05%,检测波长280 nm。质谱采用ESI电离源,毛细管电压3.0 k V,锥孔电压30 V,离子源温度100℃,脱溶剂温度400℃,锥孔气流量50 L/h,脱溶剂气流量700 L/h,液质检测扫描质量范围m/z:50~300。标准曲线为多菌灵标准溶液检测后以含量-峰面积绘制,标准溶液多菌灵浓度为 0.1、0.2、0.3、0.4、0.5 g/L,标准曲线为 y=103730x,x 为多菌灵浓度,y 为峰面积,R2=0.9991。
1.3 数据处理
实验中每个样品重复3次测定,实验结果采用Origin 8.0软件作图。
2 结果与分析
2.1 多菌灵降解菌的筛选与鉴定
经过连续筛选,最终得到一株可利用多菌灵为唯一碳源生长的细菌,经过16S rRNA序列鉴定及序列比对,确认该菌种为产酸克雷伯菌 Klebsiella oxytoca,命名为K.oxytoca KO-1。该菌种的16S rRNA扩增结果如图2中所示,在第1泳道中约1500 bp位置出现了清晰的条带。如图3中所示,发育树分析表明,K.oxytoca KO-1与产酸克雷伯菌亲缘关系较为接近,但仍与已知菌种存在一定差异,为目前尚未被筛选鉴定过的新菌种。

图2 K.oxytoca KO-1菌16SDNA的PCR电泳图Fig.2 PCR amplification of 16SDNA of K.oxytoca KO-1.注:M:DNA Marker DL5000;1:16SDNA of K.oxytoca KO-1。

图3 K.oxytoca KO-1的系统发育树Fig.3 Phylogenetic tree of K.oxytoca KO-1
2.2 多菌灵降解
将所筛选K.oxytoca KO-1接入液体多菌灵培养基,所测得多菌灵降解及生物量如图4中所示。由图4中可以看出,30 mg/L多菌灵在液体培养基中第7 d被完全消耗,平均降解速率为4.29 mg/L·d。与张桂山等[11,16]结果相比,K.oxytoca KO-1 在液体培养基中对多菌灵降解速度较快。K.oxytoca KO-1的生长在第3 d到达平稳期,细胞最高吸光度值为0.16。本实验中未加入除多菌灵外的有机物,因此K.oxytoca KO-1的生长受到了限制[18]。其次,多菌灵为杀菌剂,其对K.oxytoca KO-1的生长也产生了一定的抑制作用。该数据也说明,使用微生物法除去多菌灵,存在降解菌生长易受多菌灵影响等问题。
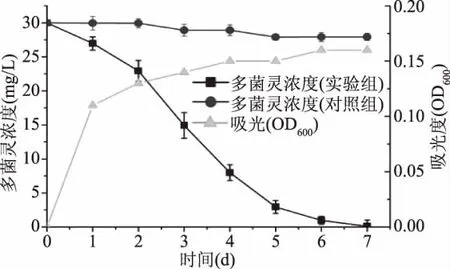
图4 多菌灵降解及K.oxytoca KO-1的OD600吸光度值Fig.4 Carbendazim degradation and OD600 of K.oxytoca KO-1
2.3 水解酶编码基因的克隆
根据K.oxytoca中的多个水解酶基因序列比对并设计简并引物,梯度PCR扩增其水解酶基因,扩增结果如图5中所示。由图5中可知,水解酶基因在退火温度为50~59℃区间内时被成功扩增出。经测序鉴定,该基因大小为837 bp,命名为ky1。序列比对后确认该基因与来自K.oxytoca M1中的水解酶基因HR38_01345有约99%的同源性,碱基存在7处差别,具体见表1。
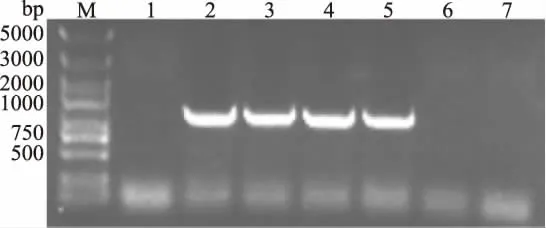
图5 ky1基因的PCR扩增Fig.5 PCR amplification of ky1注:M:DNA Marker DL5000;1~7:退火温度47、50、53、56、59、62、65 ℃时的 PCR 产物。
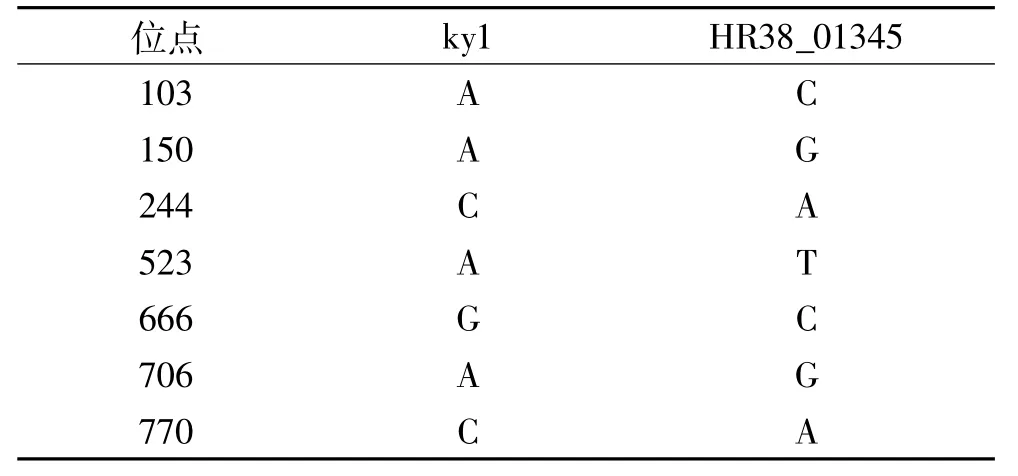
表1 ky1与HR38_01345的碱基差别Table 1 The DNA sequence differencesbetween ky1 and HR38_01345
2.4 ky-1的表达纯化及催化产物检测
将ky1基因使用Bam HI和Hind III酶切位点连接入表达载体p ET-28a后转入BL21中,IPTG诱导表达。实验SDS-PAGE结果如图6中所示。在1泳道,成功表达出大小为28 kDa的KY-1,而对照组相应位置没有条带出现,证明表达成功。使用镍柱纯化蛋白后,可见到3泳道中清晰的条带,成功得到了KY-1纯化蛋白。酶活实验显示,未纯化及纯化后的KY-1比活力达到0.16和36.8 U/mg。纯化后的KY-1比未纯化的大肠杆菌细胞破碎液催化多菌灵的能力有了大幅度的提高,证明纯化后的KY-1有着较强的清除多菌灵的潜力。对KY-1酶催化产物检测,检测结果如图7中所示。质谱图中m/z为192.10和134.20为多菌灵及其降解产物2-氨基苯并咪唑[13]。液质结果显示,KY-1成功将多菌灵分解。
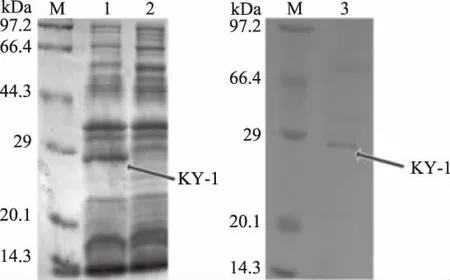
图6 KY-1的SDS-PAGE分析Fig.6 SDS-PAGE analysis of KY-1注:M:蛋白标尺;1:E.coli(pET-28a-ky1)粗蛋白;2:E.coli(pET-28a)粗蛋白;3:纯化后的 KY-1。

图7 液质分析多菌灵代谢产物Fig.7 HLPC-MSanalysis of carbendazim degradation product注:m/z192和134分别为多菌灵及其代谢产物2-氨基苯并咪唑。
Pandey等[13]从诺卡氏菌种克隆出可水解多菌灵的酯酶MheI,编码基因长度为729 bp,Km和Kcat值分别 为 6.1 μmol/L 和 170 min-1。 Hang 等[19]从Hansschlegelia zhihuaiae S113中克隆并表达出SulE,可用于多菌灵降解,但未对酶活进行测定。Lei等[20]从Microbacterium sp.djl-6F克隆出mehI基因,表达蛋白 Km和 Kcat值分别为6.69 μmol/L 和160.88 min-1,并对其进行了突变。相比之下,KY-1的Km和Kcat值分别为6.26μmol/L和168 min-1,催化效率与上述报道较为接近。本实验中的蛋白KY-1可通过E.coli表达系统大量获得,且酶催化活性较高,是工业级酶制剂生产的较好选择。
2.5 去除果蔬农残
将纯化后的KY-1制备为酶制剂后,分别喷洒于多菌灵污染的西红柿、黄瓜、土豆及草莓的表面,用于检测多菌灵的降解。由图8中可知,多菌灵在果蔬表面有自然降解的发生,其中西红柿表面降解较快,而草莓表面降解较慢,推测原因为西红柿表面褶皱越少,喷洒蒸馏水对其多菌灵洗脱较为有利。喷洒KY-1酶制剂后,各种果蔬表面多菌灵残留均有较为明显的下降,喷洒酶制剂6 d后,西红柿、黄瓜、土豆及草莓表面多菌灵剩余分别为70.2%、65.2%、62.1%和57.2%。同时,相比于各自对照组的多菌灵残留量,多菌灵降解最多的为草莓,减少量为37.3%;降解最少的为西红柿,减少量为10.5%。由以上数据可以看出,表面褶皱越多的果蔬,其多菌灵自然降解越慢。而加入KY-1后,表面褶皱多的果蔬,多菌灵得到了较快的降解。造成该现象可能的原因为,表面褶皱给酶催化多菌灵降解提供了更多的比表面积,促进了酶解反应的进行。
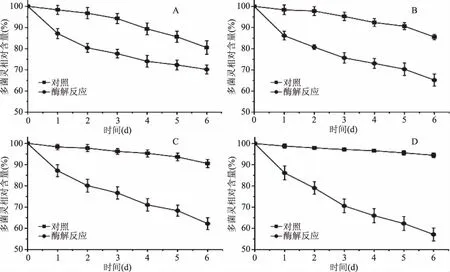
图8 KY-1酶制剂清除果蔬表面多菌灵Fig.8 Degradation of carbendazim residue on surface of fruits by KY-1注:A:西红柿;B:黄瓜;C:土豆;D:草莓。
3 结论
本实验从土壤中筛选出了一株高效降解多菌灵的产酸克雷伯菌 KY-1,并从其基因组中克隆出837 bp的水解酶基因ky1。将ky1在E.coli中表达纯化后,液质检测其表达产物KY-1成功将多菌灵降解为2-氨基苯并咪唑。使用KY-1酶制剂对果蔬表面多菌灵进行降解,成功减少了西红柿、黄瓜、土豆及草莓表面的多菌灵残留,最高减少了37.3%。本研究成功使用酶法对果蔬表面农残进行了降解去除。果蔬表面的农药残留是在其生长及储存阶段喷洒但未被降解及清洗掉的部分农药,其中部分农药残留因水溶性较小而难以清洗。使用微生物法可降解部分农药残留,但其降解速度较慢,难以满足市场化的应用需求。相比之下本研究中所制备的KY-1可快速有效实现果蔬表面多菌灵的降解,且其生产成本较低,是未来果蔬清洗添加剂的选择之一。
