四希夫碱-双曼尼希碱的合成及酸化缓蚀性能
2019-01-25李建波吕杰符罗坪曾波
李建波,吕杰,符罗坪,曾波
(西南石油大学化学化工学院,四川 成都 610500)
酸化压裂是油气田重要的增产措施,同时,酸化过程也会造成井筒管壁、采油管道等严重腐蚀,带来严峻的安全问题和经济损失[1-2]。防止酸化对管线的腐蚀,最经济有效的方法是在酸化压裂液中添加缓蚀剂,从而起到延缓腐蚀,增加设备使用周期等作用。
目前,常用的酸化缓蚀剂中曼尼希碱类和席夫碱类所占比例较大,并且多采用单曼尼希碱或席夫碱作主剂[6-7],为了进一步提升其缓蚀性能,笔者以席夫碱中间体,甲醛、丙酮为原料进行曼尼希反应,合成了一种双曼尼希碱,并对其缓蚀性能进行分析。
1 实 验
1.1 主要仪器及试剂
水杨醛、二乙烯三胺、甲醛、丙酮、氯化钙、无水硫酸钠,AR,成都科龙化工试剂厂。
Nicolet 6700型红外光谱仪,美国Thermo Scientific公司;CHI 650型电化学工作站,上海辰华仪器有限公司;AA-7020型原子吸收分光光度计,北京东西分析仪器有限公司。
1.2 合成原理及方法
四希夫碱-双曼尼希碱的合成路线见图1。
采用乙醇作溶剂,水杨醛和二乙烯三胺在无水硫酸钠的条件下脱水得到希夫碱中间体(SBI),再与甲醛和丙酮反应得到四希夫碱-双曼尼希碱缓蚀剂(FSDM)。

图1 四希夫碱-双曼尼希碱的合成路线
1.2.1席夫碱中间体(SBI)的合成
在装有磁力搅拌子、冷凝管、温度计的250 mL 三口烧瓶中,依次加入水杨醛6.3 mL(0.06 mol)和30 mL乙醇,再加入一定量的无水硫酸钠和少量氯化钙(催化剂),在搅拌并加热的条件下滴加二乙烯三胺3.3 mL(0.03 mol)和20 mL乙醇。在 85 ℃下,反应时间6h,得到黄色希夫碱中间体(SBI)。
1.2.2四希夫碱-双曼尼希碱(FSDM)的合成
称取SBI 9.4 g加入三口烧瓶,在室温下加入甲醛2.2 mL(0.03 mol)、丙酮1.1 mL(0.015 mol)和40 mL乙醇。控制温度为38 ℃,反应2 h。
待溶液变红后升温至80 ℃,回流5 h,得到四希夫碱-双曼尼希碱缓蚀剂(FSDM)。
1.3 FT-IR表征
将纯化、干燥后的产物磨细后,与溴化钾混合后研磨压片,用Nicolet 6700型红外光谱仪测定其吸收峰,表征产物结构。
1.4 缓蚀剂的评价
1.4.1原子吸收分光光度法分析
采用挂片法,腐蚀测试参考SY/T 5405—1996[8]。在60 ℃,将已测得表面积的试片放在恒温添加和未添加600 mg/L缓蚀剂的酸溶液中,浸泡到一定时间,取出钢片,将酸溶液摇匀,取出少量酸液,测定其铁离子浓度。重复上述实验过程,即继续浸泡、取液和测量,计算腐蚀速率及缓蚀率。测试时间间隔为30 min,腐蚀时间为200 min。
1.4.2电化学测试
采用CHI 650型电化学工作站,测试空白和SBI、FSDM在不同加量的条件下的极化曲线和交流阻抗谱。采用三电极系统,工作电极为N80碳钢,参比电极为饱和甘汞电极(SEC),辅助电极为铂电极,测试温度为室温。为了得到稳定的开路电位值,测量前将工作电极浸泡在腐蚀介质中30 min[9]。
在开路电位的-250 mV到+250 mV的范围内测定电流密度变化,其扫描速率为1 mV/s[10-12],得到电流密度随电压变化的塔菲尔曲线。
在外加电压为开路电压(OCP),扰动振幅为5 mV,扫描范围为0.01~105 Hz下得到电化学阻[13],得到的阻抗谱采用Zsimpwin软件进行拟合。
1.4.3量子化学计算
初始构型采用Material Studio 6.1软件的Visualizer模块构建,利用Dmol3模块优化分子构型,运用密度泛函理论(DFT)对缓蚀剂分子进行量子化学计算[14]。计算SBI和FSDM的最高占据轨道、最低空轨道、能隙、电负性和硬度等参数。值的大小可表明缓蚀剂分子的给电子能力,其缓蚀率随的值增大而增大。值的大小表明缓蚀剂分子接受电子的能力,其值越低,分子越易接受电子。为能隙其值越小,缓蚀效果越好[15-17]。
1.4.4与常用商品缓蚀剂对比
将合成的SBI和FSDM缓蚀剂与美国Pickling Guard 01缓蚀剂和山东艾克水处理公司的AK-700缓蚀剂作对比,采用酸化缓蚀剂性能试验方法及评价指标(SY/T 5405—1996)测定其缓蚀性能。
2 结果与讨论
2.1 产物的FT-IR表征
图2为SBI和FSDM的红外光谱。

图2 SBI和FSDM的红外光谱
由图2可知,SBI和FSDM的红外光谱图相似,在3 430 cm-1处为苯环C—H伸缩振动峰,2 925 cm-1为亚甲基伸缩振动峰,1 630 cm-1为CN伸缩振动峰,是SBI和FSDM的特征吸收峰,1 585~1 458 cm-1之间的吸收峰为苯环骨架的伸缩振动,1 279 cm-1为酚羟基吸收峰,756 cm-1为苯环二取代的吸收峰;对比二者容易发现,1 709 cm-1为CO伸缩振动峰,可见成功合成了FSDM,FSDM相比SBI发生红移,这是由于FSDM共轭体系更多。
2.2 原子吸收分光光度法分析
在60 ℃采用原子吸收分光光度法测定了不同时间下SBI和FSDM腐蚀体系中铁离子的浓度,结果如表1。

表1 腐蚀体系中铁离子质量浓度 mg/L
腐蚀速率和缓蚀率随时间变化曲线如图3。
从表1可知,添加缓蚀剂能显著降低腐蚀体系中铁离子浓度。这是由于N80钢片在腐蚀介质中发生如下反应:

这是由于一方面,酸中的H+与Fe反应产生Fe2+,随着Fe2+浓度增大,扩散作用减弱,腐蚀速率下降;另一方面,随着反应的不断进行,盐酸浓度逐渐减小也造成腐蚀速率下降。

图3 SBI和FSDM的腐蚀速率和缓蚀率与时间的关系
由图3可知,在未添加缓蚀剂条件下,N80钢片在1∶1的盐酸腐蚀介质中腐蚀速率随时间增长而减小至平衡。
对比添加SBI和FSDM缓蚀剂的腐蚀速率和缓蚀率曲线可知,SBI腐蚀速率在很短时间内保持不变,而FSDM的腐蚀速率曲线是一个逐渐减小的过程,达到平衡所需时间相对较长。这可能是由于SBI分子较小,可以在很短时间内达到较理想吸附效果,从而快速达到吸附平衡;FSDM分子较大,吸附较慢,从而导致腐蚀速率逐渐减小,逐步达到平衡。这与电化学测试结果一致。
2.3 电化学分析
2.3.1极化曲线
图4为室温条件下N80钢片在SBI和FSDM溶液中的极化曲线。
实验结果表明,随着SBI和FSDM浓度增加,腐蚀电流降低,缓蚀率增加。由图4可知,N80碳钢在盐酸溶液中阳极反应极化曲线可分为三个区,分别为抑制区(Ⅰ)、平坦区(Ⅱ)和非抑制区(Ⅲ),在Ⅰ区域内,阳极电位与腐蚀电流密度基本成线性关系;在Ⅱ区域内,电流密度随电位变化相对较缓,表明缓蚀剂分子在碳钢上吸附与解吸过程达到平衡;在Ⅲ区域内,电流密度随电位急剧增加,这是由于缓蚀剂分子的吸附层变形所致[18]。βa(阳极塔菲尔斜率)、βc(阴极塔菲尔斜率)和Ecorr(腐蚀电位)值的偏移无明确趋势,计算可知,SBI的ΔmaxEcorr=105 mV,FSDM的ΔmaxEcorr=70 mV,可以判断二者均为混合型缓蚀剂[19]。
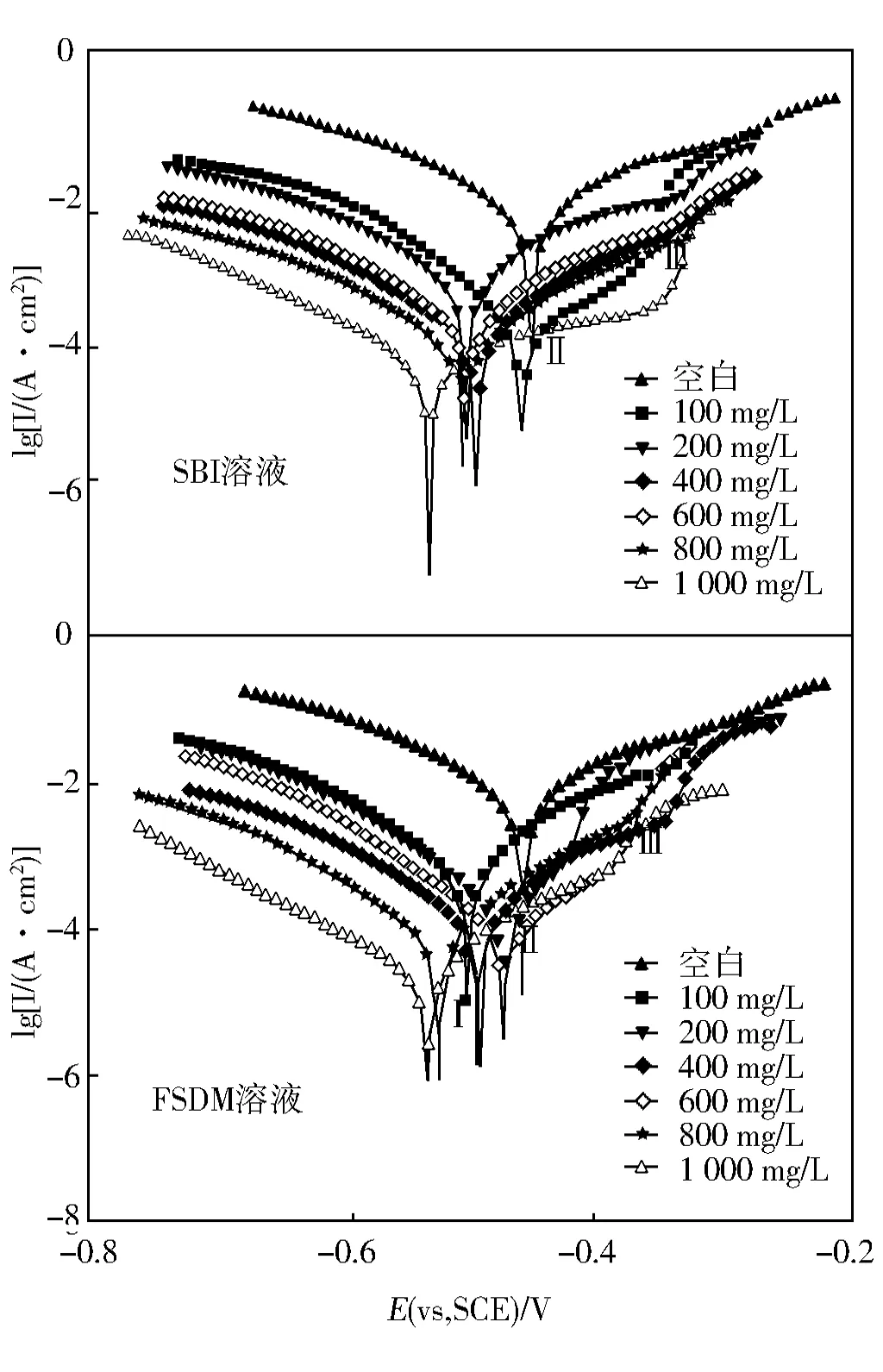
图4 N80钢片在SBI溶液和FSDM溶液中的极化曲线
2.3.2电化学阻抗
在室温条件下,对添加不同浓度SBI和FSDM的腐蚀体系进行了交流阻抗测试,结果如图5、图6所示。
由Nyquist图可知图形均为近似半圆的容抗弧,随着缓蚀剂浓度的增大,容抗弧也随之增大,缓蚀效果越明显。相位图只有一个极值,表明只有一个时间常数,N80碳钢在盐酸溶液中的腐蚀主要受电荷转移过程控制。
图7为SBI和FSDM溶液的等效电路模拟图。图中Rs为溶液的电阻,Q为常相位元件,Cdl为膜电容,R1为膜电阻,Rct为电荷转移电阻。表2列出了交流阻抗模拟的相关参数。

图5 N80碳钢在不同浓度SBI缓蚀剂溶液中的交流阻抗a—Nyquist图;b,c—Bode图

图6 N80碳钢在不同浓度FSDM缓蚀剂溶液中的交流阻抗a—Nyquist图; b,c—Bode图

缓蚀剂ρ/(mg·L-1)Rs/(Ω·cm2)Q/(105·F·cm-2)R1/(Ω·cm2)Cdl/(105·F·cm-2)Rct/(Ω·cm2)ξ,%—— 9.212423.741.6811230.848 4—SBI1001.6134.516185.713.141.49432000.800 33.381 9213.3111.72.01584001.741.109369.24.5172.829706000.733 64.933491.213.216.52878000.717 54.239664.114.888.48901 0000.585 82.103800.99.99921.31196FSDM1001.3094.779147.419.521.761522000.6655.597286.984.652.423654001.6043.159393.97.8935.3846000.647 14.023421.811.857.08888000.638 33.289566.110.827.71891 0000.985 62.864598.99.45212.13493

图7 SBI溶液和FSDM溶液的等效电路模拟图
从图5a、图6a可以看出,采用Zsimpwin软件等效电路模拟情况良好,拟合度较高。从表2可以看出,加入缓蚀剂后,溶液电阻Rs和膜电容Cdl均减小,而电荷转移电阻Rct增大,表明缓蚀剂分子在N80碳钢表面成膜,抑制电荷的转移。对比SBI和FSDM可知,低浓度下FSDM的缓蚀效果要优于SBI,而高浓度下无明显差异。这是由于FSDM分子中含有更多的苯环和杂原子,低浓度下可更好的与Fe配位,使其吸附更牢固。高浓度下由于FSDM分子基团较大,吸附在碳钢表面的分子间形成较大空隙,而SBI分子较小,在高浓度下吸附行为更致密,使碳钢与腐蚀介质接触面积更小,缓蚀效果较明显。
2.4 缓蚀剂分子在碳钢表面的吸附行为研究
缓蚀剂的缓蚀效率与缓蚀剂在金属表面的覆盖程度相关,覆盖程度越大,其缓蚀效果越好。通常缓蚀剂在碳钢表面的吸附行为可以通过Langmuir、Temkin和Frumkin等等温吸附方程描述[20]。将缓蚀率和缓蚀剂浓度带入上述三种公式进行拟合,其中Langmuir等温吸附式最好。Langmuir吸附式如下所示。
式中:c为缓蚀剂溶液浓度,mol/L;θ为表面覆盖率;Kads为吸附速率常数。将c/θ对c作图,进行线性拟合,拟合结果如图8所示。
从图8中可以看出,线性拟合度良好,由拟合结果知,SBI与FSDM线性相关系数分别为0.997和0.991,表明SBI与FSDM缓蚀剂分子在碳钢表面的吸附符合Langmuir吸附,根据Langmuir吸附模型,该吸附均为单分子层吸附。SBI吸附平衡常数Kads=2.65,FSDM吸附平衡常数Kads=8.27。根据下式可以计算出吉布斯自由能。
ΔG=-RTln(55.5Kads)
式中:55.5为水的摩尔数,g/mol;R为气体常数,J/(mol·K)。
计算得到SBI与FSDM的ΔG分别为-12.365 kJ/mol和-15.19 kJ/mol,SBI和FSDM的ΔG<0,表明SBI和FSDM的吸附过程均能自发进行[21]。

图8 SBI与FSDM的Langmuir等温吸附拟合
2.5 腐蚀形貌分析
将新打磨、空白腐蚀和添加缓蚀剂的N80钢片用原子力显微镜进行分析,结果如图9所示。

图9 N80钢片表面形貌a—新钢片; b—空白腐蚀; c—添加TMSI缓蚀剂; d—添加SBI缓蚀剂
图9a是新打磨光滑的N80钢片,从二维和三维图可以看出钢片表面平整。图9b是未添加缓蚀剂的钢片被腐蚀的外貌,与图9a对比,可以看出表面凹凸不平,出现了比较严重的腐蚀情况。图9d是钢片在缓蚀剂SBI加量为600 mg/L时的腐蚀外貌情况,与图9b对比,腐蚀程度比较轻微。图9c为FSDM加量为600 mg/L时的钢片腐蚀外貌情况,可以看出,其腐蚀情况较图9d轻微,有比较明显的缓蚀效果。
2.6 量子化学计算
计算结果的量子化参数如表3所示。

表3 SBI和FSDM的量子化学参数
注:χ为分子的电负性。
从表3可知,ΔEgap(FSDM)<ΔEgap(SBI),说明FSDM的缓蚀效果优于SBI。χ表示分子的电负性,其值越小,分子的可极化性越强,容易吸附在金属的表面,从而达到缓蚀效果。从表4知HASB理,FSDM的χ值更小,说明分子的可极化性更强,容易吸附在金属的表面,从而达到缓蚀效果。根据理论,硬酸与硬碱结合,软酸与软碱结合。Fe被认为是软酸,将与软度大(即硬度小)的缓蚀剂分子结合,γFSDM<γSBI。所以认为FSDM与Fe的结合程度更高。综上所述均能说明在一定浓度范围内FSDM缓蚀效果更好。
2.7 常用商品缓蚀剂缓蚀效果
反应体系均为15%盐酸,温度为70 ℃,缓蚀剂加量为1 g/L,时间为72 h,其缓蚀效果如图10所示。由图10可见,合成的SBI与FSDM缓蚀效果明显优于市售缓蚀剂。

图10 常用缓蚀剂的缓蚀率
3 结 论
a.以水杨醛和二乙烯三胺合成了SBI,再经过曼尼希反应合成了FSDM。添加质量浓度为1 000 mg/L时,对N80碳钢在15%盐酸溶液中介于70 ℃有良好的缓蚀效果;电化学和吸附模型表明,加入缓蚀剂能自发吸附在金属表面成膜,有效效屏蔽液相腐蚀介质,明显减小腐蚀电流密度,增大电荷转移电阻,降低腐蚀速率,且是一种以抑制阴极为主的混合型缓蚀剂。
b.SBI和FSDM缓蚀剂具有良好的缓蚀效果,与常用商品缓蚀剂相比,有更明显的缓蚀效果,且对环境更友好,在油田应用具有广阔的前景。
