我国公立医院干细胞临床研究伦理审查分析
——基于上海市、天津市、贵州省10所公立医院的调查*
2019-01-25马晨光王剑萍白莉华
张 勘,马晨光,王剑萍,白莉华,雷 颖,薛 迪**
(1 上海市卫生健康委员会,上海 200125,yxkyc@sina.com;2 复旦大学公共卫生学院,国家卫生健康委卫生技术评估重点实验室,上海 200032;3 上海交通大学医学院附属同仁医院,上海 200336;4 上海市东方医院,上海 200120)
近年来干细胞研究快速发展,人们对干细胞临床治疗前景充满期待。但是,目前干细胞临床研究的风险较大,有效性也存在较大的不确定性,干细胞临床研究的伦理审查备受关注。2015年我国国家卫计委(现国家卫健委)和食品药品监管总局发布了《干细胞临床研究管理办法(试行)》,要求干细胞临床研究必须遵循科学、规范、公开、符合伦理、充分保护受试者权益的原则,要求机构伦理委员会对干细胞临床研究项目进行独立的伦理审查[1]。本文试图通过分析我国公立医院干细胞临床研究伦理审查的状况,探讨如何完善我国公立医院干细胞临床研究的伦理审查工作。
1 研究内容与方法
本次研究选取了社会经济发展水平分别处于高、中、低的上海市、天津市和贵州省作为调查的省级行政区域,选择此3个区域10所首批和第二批通过国家干细胞临床研究备案的公立医院进行了伦理委员会的问卷调查。调查中,收集了这些公立医院相关伦理委员会干细胞临床研究伦理审核要素、干细胞临床研究收益与风险的权衡选择、干细胞临床研究伦理审核最主要的伦理问题(前3位)的相关信息以及干细胞临床研究的伦理审核项目数和通过审核项目数。
2 研究结果
2.1 伦理审核要素分析
分析显示,被调查的10所公立医院伦理委员会对干细胞临床研究伦理审核关注要素最全面的是研究科学性、研究对象及其招募、受试者隐私保护和信息保密(平均9个及以上伦理委员会),对研究目的、知情同意、弱势群体保护等方面要素也有较全面的关注(平均8~8.5个伦理委员会),而对收益与风险评价和其他方面的要素关注全面性相对较低(平均不足8个伦理委员会)(见图1)。

图1 伦理委员会对干细胞临床研究伦理审核的要素
具体而言,被调查的伦理委员会主要考虑以下要素:
研究背景,包括国内外干细胞研究进展和发展预期(7个伦理委员会)、干细胞研究的主要方法和结果(7个伦理委员会)以及干细胞研究进展、研究方法和研究结果的比较(9个伦理委员会)。
研究目的,包括是否涉及临床疾病的发病机理或病因的研究(8个伦理委员会)、是否涉及人的干细胞治疗研究(8个伦理委员会)、是否涉及人的干细胞临床治疗(8个伦理委员会)、是否违反我国相关法规(8个伦理委员会)、是否违反国际公认的准则(9个伦理委员会)以及被审核项目的研究和/或应用价值(10个伦理委员会)。
研究科学性,包括研究方案的科学性(10个伦理委员会)、可行性(10个伦理委员会)、干细胞制剂的质量(9个伦理委员会)和研究过程的质量控制措施(10个伦理委员会)。
研究项目的主要成员状况,包括干细胞研究和/或应用的相关教育与培训状况(8个伦理委员会)、相关临床诊疗和/或研究的资质(10个伦理委员会)以及伦理教育与培训状况(9个伦理委员会)。
研究对象及其招募,包括研究对象的选择是否符合研究目的(10个伦理委员会)、是否符合伦理公平性原则(10个伦理委员会)、纳入和排除标准是否符合伦理公平性原则(9个伦理委员会)、样本量是否符合科学与伦理要求(9个伦理委员会)以及招募过程和招募宣传资料是否符合伦理要求(9个伦理委员会)。
收益与研究风险评价,在可能的潜在社会收益方面,包括疾病机制的发现(7个伦理委员会)、难治性疾病治疗的新方法(10个伦理委员会)以及基因治疗法的创新(7个伦理委员会);在研究对象的直接潜在收益方面,包括可能对难治性疾病患者的治疗有效(10个伦理委员会)和可能为患者提供更有效的治疗(8个伦理委员会);在可能的风险方面,包括致瘤/致癌的风险(1个伦理委员会)、致死风险(7个伦理委员会)、病毒/病原感染(8个伦理委员会)、遗传稳定性差(8个伦理委员会)、异体移植免疫排斥性(9个伦理委员会)、其他不良反应(7个伦理委员会)、干细胞的分离/纯化/扩增质量差产生的风险(9个伦理委员会)以及干细胞的功能有效性差(8个伦理委员会);在风险控制方面,包括对干细胞研究与应用的风险防控措施(10个伦理委员会)。
隐私保护和数据保密,包括是否对研究对象的隐私予以恰当保护(10个伦理委员会)、是否去除或及时去除个体标识(8个伦理委员会)以及原始资料和相关数据的规范保存(10个伦理委员会)。
弱势人群保护,包括对孕妇(9个伦理委员会)、儿童(9个伦理委员会)、智障和精神患者(8个伦理委员会)、经济条件差者或受教育程度低者(8个伦理委员会)、监狱服刑者、部队军人(6个伦理委员会)的特殊保护。
知情同意,在知情同意形式和过程方面,包括知情同意形式(口头或书面)和过程、知情同意书的签署者是否符合伦理要求(分别为10个、9个和10个伦理委员会);在知情同意书内容方面,包括研究目的(10个伦理委员会)、研究过程(10个伦理委员会)、对干细胞研究描述的正确性(治疗vs研究)(8个伦理委员会)、研究收益(社会收益VS直接收益)(9个伦理委员会)、研究风险(10个伦理委员会)、隐私和保密(10个伦理委员会)、研究的补偿和赔偿(10个伦理委员会)、自愿选择和无理由退出(8个伦理委员会)以及项目负责人以及伦理委员会的联系方式(9个伦理委员会);在风险告知方面,包括致瘤/致癌性(9个伦理委员会)、致死风险(6个伦理委员会)、干细胞遗传稳定性差(6个伦理委员会)、病毒/病源感染(7个伦理委员会)、异体移植的免疫排斥(7个伦理委员会)、其他不良反应(6个伦理委员会)、干细胞的分离/纯化/扩增质量差产生的风险(8个伦理委员会)以及干细胞的功能有效性差(5个伦理委员会);此外,知情同意的审查还考虑知情同意书的可理解性(9个伦理委员会)。
其他方面,包括给研究对象和/或监护人的宣传或资料是否符合伦理要求(10个伦理委员会)、研究结果的出版是否有限制(7个伦理委员会)以及研究产出的知识产权是否有说明(7个伦理委员会)。
2.2 收益与风险权衡的分析
分析显示,被调查10所公立医院伦理委员会在收益与风险的权衡中,当干细胞临床研究中有一定的致癌/致瘤性风险、功能有效性差、遗传稳定性差、有一定的致死性风险、干细胞制剂质量较难保证时,分别有9个、7个、7个、5个和3个伦理委员会认为视研究对象潜在收益而定是否通过审核,其余伦理委员会认为不予通过。(见图2)。
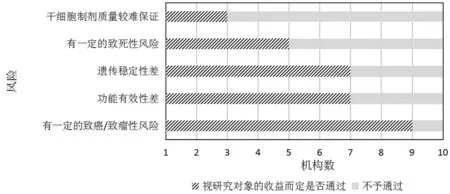
图2 伦理委员会收益与风险的权衡
2.3 干细胞临床研究伦理审查结果的分析
分析显示,2016-2017年被调查的10所公立医院中,有4所公立医院的21个干细胞临床研究项目进行了伦理审查,通过伦理审查的有14项,通过率为66.67%。此外,还有4所公立医院伦理委员会均认为:患者的权益无法保障、研究风险大于研究收益、未充分告知研究对象的风险是干细胞临床研究伦理审核中最主要的3个伦理问题。
3 讨论与建议
3.1 干细胞临床研究伦理审查基本执行了伦理审查的要素
本研究发现,被调查的上海市、天津市和贵州省首批和第二批通过国家干细胞临床研究备案的10所公立医院对干细胞临床研究伦理审查基本执行了伦理审查的要素;较全面地关注了研究科学性、研究对象及其招募、受试者隐私保护和信息保密(平均9个及以上伦理委员会),对研究目的、知情同意、弱势群体保护等方面要素也有较全面的关注(平均8~8.5个伦理委员会)。本研究还显示,2016年-2017年4所公立医院有21个干细胞临床研究项目进行了伦理审查,伦理审查通过率为66.67%。本研究结果显示了伦理委员会较好地发挥了保护研究受试者权益的作用,对促进我国干细胞临床研究稳健的发展起到了应有的作用。
3.2 干细胞临床研究的收益与风险评估是伦理审核的难点与重点
目前,我国干细胞临床研究还处于初步发展阶段,干细胞研究的安全性和有效性受到人们的关注[2-3],包括干细胞的致瘤/致癌性、致死性、病毒/病原感染、遗传稳定性、异体移植免疫排斥性、其他不良反应、干细胞的分离/纯化/扩增质量风险以及干细胞的功能有效性差的风险[2-4]。对这些风险的认知影响着干细胞临床研究收益与风险的评估,而干细胞临床研究收益与风险的评估也是干细胞临床研究伦理审核的重点与难点。本研究发现,负责干细胞临床研究审核的伦理委员会对研究收益与风险评价考虑的要素仍不够全面(平均不足8个伦理委员会),尤其是对干细胞的致瘤/致癌性风险,仅1个伦理委员会会作为伦理评价要素;在权衡收益与风险时,当干细胞制剂分离、纯化和扩增质量较难保证时,仍有3个伦理委员会认为会视研究对象潜在收益而定是否通过审核。这提示我国负责干细胞临床研究伦理审核的伦理委员会应进一步重视这类研究的收益与风险权衡,重视干细胞临床研究的特殊风险,以更好地保护受试者的权益。此外,本研究结果也提示,我国负责干细胞临床研究伦理审核的伦理委员会对干细胞临床研究致癌/致瘤性风险的接受度高于对致死性风险和干细胞制剂质量风险的接受度。这可能与干细胞临床研究致癌/致瘤性风险需要长期随访和排除其他因素的致癌/致瘤性影响才能确定有关。目前我国负责干细胞临床研究伦理审核的伦理委员会可能更关注于干细胞临床研究的近期风险,即致死性风险和干细胞制剂质量风险。未来,我国负责干细胞临床研究伦理审核的伦理委员会仍需要考虑干细胞临床研究的长期风险,尽可能促使干细胞临床研究项目开展长期随访。
3.3 知情同意是保护受试者权益的重要手段
干细胞临床研究的发展,给难治性疾病的治疗带来了新的希望。我们的研究也显示,10个公立医院相关伦理委员会均认为发现难治性疾病治疗的新方法是干细胞临床研究潜在的社会收益和受试者的直接收益。但是,本研究发现有干细胞临床研究伦理审核经历的4个伦理委员会均认为:患者权益无法保障、研究风险大于研究收益、未充分告知研究对象的风险是干细胞临床研究伦理审核中最主要的3个伦理问题。面对未来干细胞治疗的前景和目前受试者可能承受的较大风险,伦理委员会如何权衡干细胞研究的利弊、如何使参与临床试验的受试者能够在充分知情的情况下自愿选择是否参与临床研究,体现伦理委员会委员伦理审核的能力。我们的研究发现,10所公立医院相关伦理委员会在知情同意审核要素中,总体上较好地考虑了知情同意形式(口头或书面)、过程、内容和可理解性。但是,在知情同意风险告知的审核要素上,仍有缺陷。例如,知情同意书中关于干细胞的功能有效性差、干细胞遗传稳定性、病毒/病源感染、异体移植的免疫排斥、致死风险和其他不良反应的告知,仅有5~7个伦理委员会会作为审核要素;对干细胞的分离/纯化/扩增质量的风险只有8个伦理委员会会作为审核要素。未来,干细胞临床研究相关伦理委员会需完善知情同意内容的伦理审核要素,使干细胞临床研究的知情同意真正成为保护受试者权益的重要手段。
