两种盐酸阿考替胺相关杂质的合成和结构分析
2019-01-24,
,
(天津工业大学 环境与化学工程学院,天津 300387)
盐酸阿考替胺由日本Zeria公司和Astellas公司共同研发[1],是一种用于治疗功能性消化不良(FD)的新型上消化道(GI)运动调节剂和应激调节剂[2],国外临床应用广泛,对餐后饱胀、腹胀、早饱等症状具有改善作用[3]。现国内盐酸阿考替胺生产企业较少,主要以原料合成为主。本文作者以2,4,5-三甲氧基苯甲酸为原料,经酰氯化后与氨基噻唑烷基酯缩合,选择性脱甲基化,与二异丙基乙二胺胺解、酸化,得到目标产物[4-7]。在合成盐酸阿考替胺过程中发现,2-[N-(4,5-二甲氧基-2-羟基苯甲酰基)氨基]-4-(烷氧羰基)-1,3-噻唑(Int2)HPLC谱图中主峰后出现未知色谱峰,对盐酸阿考替胺成品检测,未知色谱峰仍可见,测试样品HPLC面积归一化显示,未知杂质表观含量可达0.1%,有必要进行单独控制。
本文针对两种未知杂质,分析了其可能来源,定向合成两种杂质单体,通过UV、IR、MS、NMR、元素分析等手段对其结构进行了表征确认。为下一步提高阿考替胺纯度、控制阿考替胺成品质量提供了有力支持。
1 仪器与试药
嘉鹏ZF-6三用紫外线分析仪;赛默飞Nicolet is50傅立叶红外光谱仪;沃特世E2695高效液相色谱仪;耐驰QMS403C型质谱仪;Bruker 400M型核磁共振仪;Vario EI cube元素分析仪。
甲醇(色谱纯,FISHER),乙腈(色谱纯,Kermel),盐酸(分析纯,天津风船),磷酸(分析纯,阿拉丁)。
2 杂质初步分析

图1 盐酸阿考替胺样品杂质检测HPLC图
Fig.1 HPLC chromatogram of impurity detection of Acotamine hydrochloride sample
目前盐酸阿考替胺合成路线较多,但相关杂质分析表征却鲜有报道。专利[8]介绍了七种杂质的HPLC检测方法,依照专利方法对样品溶液进行测定(图1),并比较专利附图相关杂质相对保留时间(RRT),未知杂质并非报道杂质。考虑到未知杂质色谱峰首次出现在Int2检测过程,并结合本文作者合成盐酸阿考替胺路线,2-[N-(2,4,5-三甲氧基苯甲酰基)氨基]-4-(乙氧基羰基)-1,3-噻唑(Int1)选择性脱甲基化制备2-[N-(2-羟基-4,5-二甲氧基苯甲酰基)氨基]-4-(乙氧基羰基)-1,3-噻唑(Int2)(图2)反应条件:在酸性环境中进行,反应温度超过100℃,回流时间6h,推测未知杂质是由Int1及Int2水解造成。对相同样品进行液相色谱-质谱联用(LC-MS)检测,同时扫描一级质谱。样品溶液谱图中出现3个主要色谱峰(图3),其中保留时间为3.09min色谱峰其准分子离子[M+H]+的m/z为451,则相对分子质量为450,与盐酸阿考替胺样品[9]相对分子质量一致;保留时间为3.38色谱峰其准分子离子[M+H]+的m/z为325,则相对分子质量为324,与Int2水解产物相对分子质量一致;保留时间为3.45色谱峰其准分子离子[M+H]+的m/z为339,则相对分子质量为338,与Int1水解产物相对分子质量一致。由此推测杂质产生路线如图4~5,并暂将Int1水解杂质命名为IMPA,Int1水解杂质命名为IMPB。LC-MS测试样品一级质谱图详见图6。

图2 Int1选择性脱甲基化制备Int2
Fig.2 The process of Int1 selective demethylation to prepare Int2

图3 盐酸阿考替胺LC-MS图

图4 IMPA产生过程
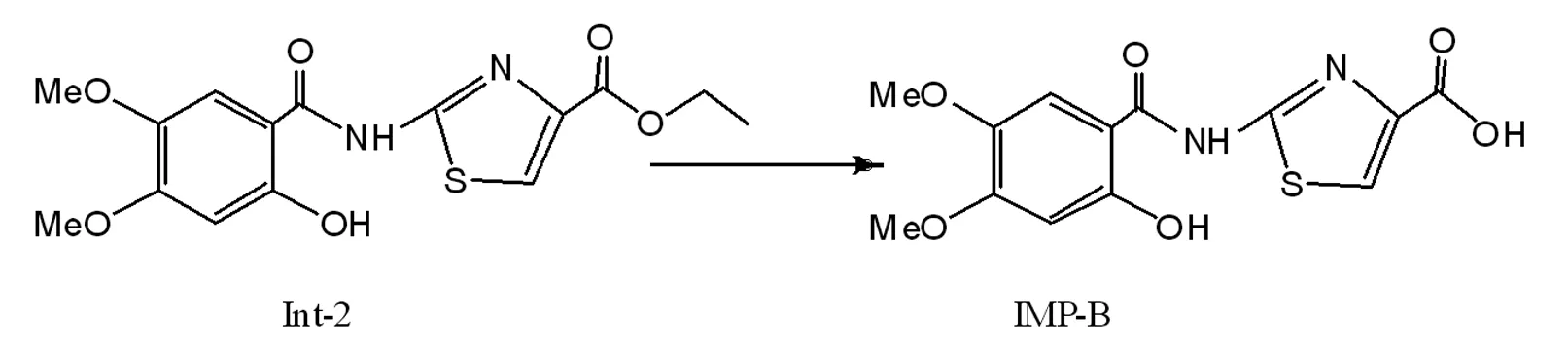
图5 IMPB产生过程

图6 盐酸阿考替胺不同保留时间质谱图
3 未知杂质定向合成
3.1 IMPA的合成
向带有搅拌装置的三口瓶中加入20g Int1,80 mL甲醇溶液,油浴搅拌,同时滴加80 mL氢氧化钠溶液(1 moL/L),滴毕,测试溶液pH值,待Int1全部溶解,搅拌30min,滴加80 mL盐酸溶液(1 mol/L),继续搅拌1h,静置,待晶体析出减压抽滤,收集晶体50℃鼓风干燥10 h即得IMPA。
3.2 IMPB的合成
将Int2 20g置于三口瓶中,甲醇溶液30mL,油浴搅拌,同时滴加30mL氢氧化钠溶液(1moL/L),滴毕,测试溶液pH值,搅拌30min,滴加1mol/L盐酸溶液60mL,继续搅拌30min,静置,待晶体析出减压抽滤,收集晶体,50℃鼓风干燥10h即得IMPB。
4 未知杂质结构确认
4.1 UV分析
将IMPA、IMPB配成20 μg/mL溶液,在200~400 nm波长范围内进行紫外分光光度扫描。IMPA及IMPB分别在322 nm、325 nm有较强吸收,为碳氧双键特征峰,在278 nm、279 nm处吸收峰可知分子中存在芳环类结构,224 nm、222 nm处吸收峰为碳氮双键特征峰。
4.2 IR分析(Kbr)
IMPA红外光谱(图7)数据分析:3024、2942、1606 cm-1为甲基吸收峰,2713cm-1为甲氧基的C-H的伸缩振动峰;3308、1661、1551、573、517 cm-1为仲酰胺的伸缩振动和弯曲振动峰;3133、1497、1194、801、728 cm-1为苯环以及取代苯环的伸缩振动峰。IMPB红外光谱(图8)数据分析:2945、1432、2624cm-1为甲基吸收峰,2840cm-1为甲氧基的C-H的伸缩振动峰;3220、1683、1625、609、523cm-1为仲酰胺的伸缩振动和弯曲振动峰;3040、1511、1189、899、735 cm-1为苯环以及取代苯环的伸缩振动峰。

图7 IMPA红外光谱图

图8 IMPB红外光谱图
4.3 元素分析
称取供试样品约2 mg,平行测定两次。IMPA测试数据见表1,IMPB测试数据见表2。
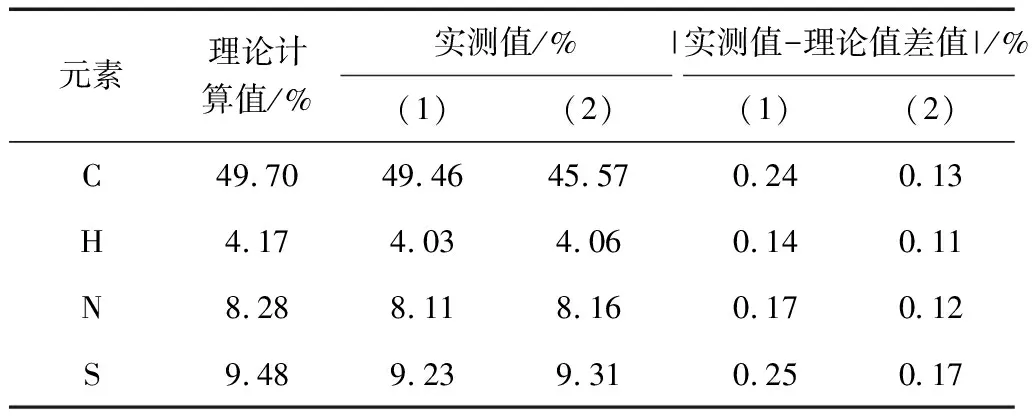
表1 IMPA元素分析测试结果与理论计算值比较
供试样品C、H、N、S实测值与理论计算值误差均小于0.3%,可知IMPA碳、氢、氮、硫元素与理论计算值一致。
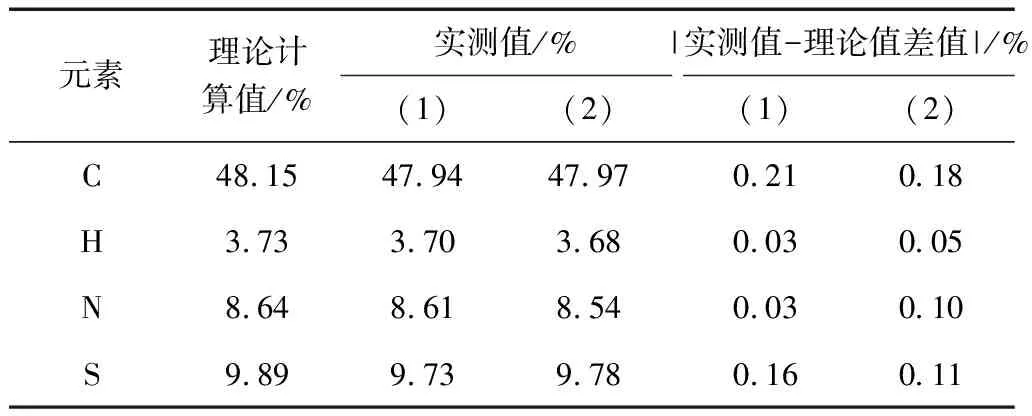
表2 IMPB元素分析测试结果与理论计算值比较
供试样品C、H、N、S实测值与计算值误差均小于0.3%,可知IMPB碳、氢、氮、硫元素与理论计算值一致。
4.4 MS分析
将已纯化的Int1、Int2、IMPA和IMPB进行质谱分析(图9),结果显示相应[M+H]+的m/z为367、339、353、325,则相对分子质量依次为366、338、352、324。表明IMPA及IMPB相对分子质量与推测路线相对分子质量均一致,Int1与IMPA相对分子质量差值及 Int2与IMPB相对分子质量差值均与推测路线差值一致。

图9 杂质和中间体质谱图
4.5 NMR分析
4.5.1 测试条件
取高纯度IMPA、IMPB适量,在DMSO-d6中溶解制成浓度约为40mg/mL溶液,以TMS为内标测试氢谱、碳谱。
4.5.2 IMP A核磁共振氢谱(1HNMR)
1HNMR图谱(图10)出现8组峰(溶剂峰除外),共14个质子,其积分比为3∶3∶3∶1∶1∶1∶1∶1,与推测分子质子一致。由谱图化学位移值可知:δ3.77ppm,3.89ppm和4.02ppm,单峰,苯环相连三个甲氧基质子(H1,H8,H15);δ6.84ppm,单峰,为苯环上靠近甲氧基连接碳相邻质子(H1);δ7.43ppm,单峰,为苯环上羰基连接碳邻位质子(H4);δ8.02ppm,单峰,噻唑环质子(H11);δ12.88ppm,单峰,羧基质子(H14);δ11.52ppm,单峰,酰胺质子(H16);上述数据表明:供试品结构中存在一个次甲基、三个甲氧基、芳香环、一个酰胺氢和一个羟基氢。

图10 IMPA氢谱
Fig.10 The1HNMR spectrum of IMPA
4.5.3 IMP B核磁共振氢谱(1HNMR)
1HNMR图谱出现8组峰(溶剂峰除外),共12个质子,其积分比为3∶3∶1∶1∶1∶1∶1∶1,与推测分子质子一致,质谱图见图11。由谱图化学位移值可知:δ3.78ppm和3.85ppm,单峰,苯环相连甲氧基质子(H7,H8);δ6.61ppm,单峰,为苯环靠近酚羟基连接碳邻位质子(H4);δ7.62ppm,单峰,为苯环靠近酰胺连接碳邻位质子(H1);δ8.04ppm,单峰,噻唑环上质子(H11);δ11.42ppm,单峰,羧基质子(H14);δ12.34ppm,单峰,酰胺质子(H16); δ13.34ppm为羟基质子(H15)。上述数据表明:供试品结构中存在一个次甲基、两个甲氧基、芳香环、一个酰胺氢,一个羟基氢、一个酚羟基氢。

图11 IMPB氢谱
4.5.4 IMPA核磁共振个碳谱(1CNMR)
样品图谱(图12)中有14个峰,对应本品分子中14个碳,分子无对称结构。由位移值数据综合分析可知:δ56.54ppm,55.70ppm,57.65ppm,苯环相连甲氧基碳信号(C7,C8,C15);δ98.28ppm,苯环甲氧基相连碳的邻位碳信号(C1);δ110.73 ppm,苯环上羰基相连碳信号(C4);δ113.65 ppm,苯环羰基相连碳邻位碳信号(C5);δ123.47ppm,噻唑环上S邻位碳信号(C11);δ142.74ppm噻唑环上N邻位碳信号(C6);δ143.52ppm,苯环羰基相连碳间位碳信号(C12);δ154.05ppm,苯环羰基相连碳及甲氧基相连碳共同邻位碳信号(C3);δ154.44ppm,苯环羰基相连碳对位碳信号(C2);δ158.21ppm,噻唑环相连羰基碳信号(C10);δ163.03ppm,噻唑环碳信号(C9);δ163.73ppm,苯环相连羰基碳信号(C13)。上述数据表明,碳谱中共出现14个碳信号,分别代表3个伯碳、3个叔碳和8个季碳。据此推测,其结构中含有14个碳原子。样品数据与推测分子一致。
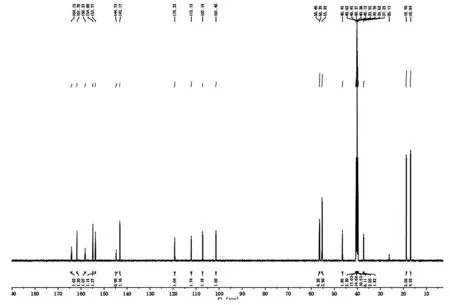
图12 IMPA碳谱
4.5.5 IMPB核磁共振个碳谱(1CNMR)
样品图谱(图13)中有14个峰,对应本品分子中14个碳,峰值与碳原子一一对应表明,分子无对称结构。由位移值数据综合分析可知:δ56.37ppm,56.55ppm,苯环相连甲氧基碳信号(C7,C8);δ101.28ppm,苯环上羟基相连碳的邻位碳信号(C1);δ105.96ppm,苯环上羰基相连碳信号(C4);δ111.15ppm,苯环上羰基相连碳邻位碳信号(C5);δ123.57ppm,噻唑环S邻位碳信号(C11);δ142.54ppm,噻唑环N邻位碳信号(C12);δ143.91ppm,苯环上羰基相连碳间位碳信号(C3);δ155.32ppm,苯环上羟基相连碳信号(C6);δ155.88ppm,苯环上羰基相连碳对位碳信号(C2);δ158.51ppm,噻唑环相连羰基碳信号(C10);δ162.97ppm,噻唑环碳信号(C9);δ166.47ppm,苯环相连的羰基碳信号(C13)。上述数据表明,碳谱中共出现13个碳信号,分别代表2个伯碳、3个叔碳和8个季碳。据此推测,其结构中含有13个碳原子。样品数据与推测分子一致。
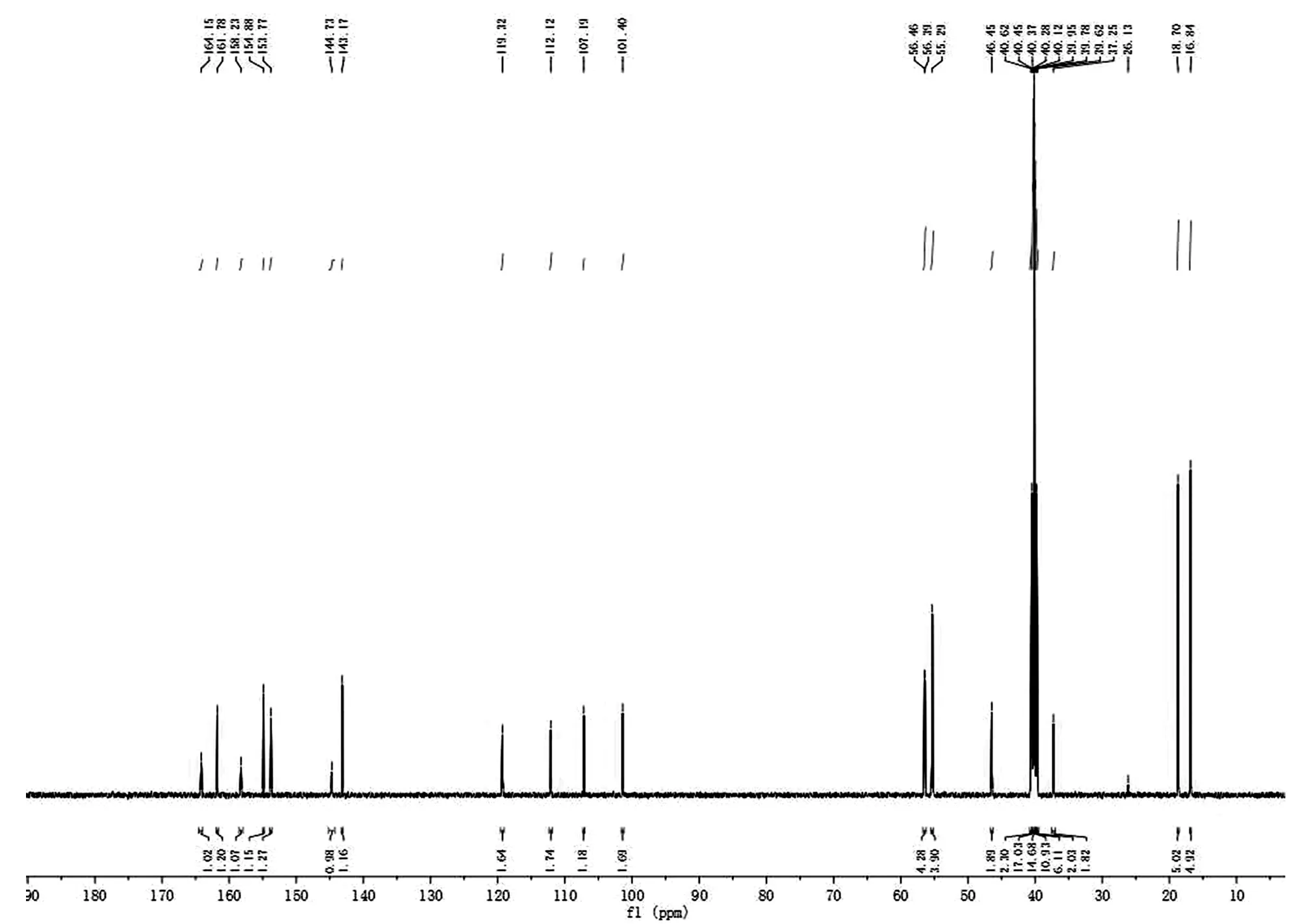
图13 IMPB碳谱
Fig.13 The1CNMR spectrum of IMPB
4.6 结构确认小结
由元素分析可知,IMPA及IMPB样品C、H、N、S测试值与理论值相符,质谱分析离子峰[M+H]+的m/z为353、325,推测IMPA样品分子式为C14H14N2O6S,IMPB样品分子式为C13H12N2O6S。结合UV、IR、NMR分析结果确定IMPA为2-[N-(2,4,5-三甲氧基苯甲酰基)氨基]-4-羧基-1,3-噻唑(IMPA)(图14);IMPB样品分子为2-[N-(4,5-二甲氧基-2-羟基苯甲酰基)氨基]-4-羧基-1,3-噻唑(IMPB)(图14)。其色谱保留行为与图1一致(图15)。
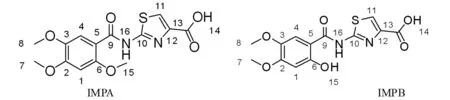
图14 IMPA及IMPB结构式
Fig.14 The chemical structures of the IMPA and IMPB
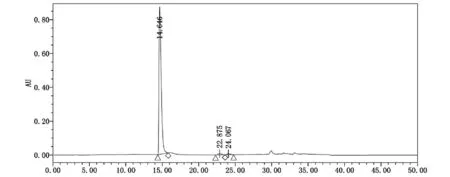
图15 盐酸阿考替胺杂质系统适应性HPLC色谱图
5 讨论
盐酸阿考替胺合成过程中会产生多种杂质,包括本文合成IMPA及IMPB。目前盐酸阿考替胺杂质研究报道较少,本文合成杂质为阿考替胺合成关键步骤Int1选择性脱甲基化制备Int2过程中产生,表征确认其结构有利于控制中间产品纯度,亦有助于盐酸阿考替胺成品质量控制,对合成工艺、产品质量提高将有所帮助。
