食管胃静脉曲张合并上消化道浅表黏膜病变的内镜下治疗
2019-01-24刘迎娣令狐恩强孙国辉柴宁莉何占娣付来琳
张 帅, 刘迎娣, 令狐恩强, 孙国辉, 王 娟, 柴宁莉, 何占娣, 付来琳
中国人民解放军总医院第一医学中心消化内科,北京 100853
随着消化内镜技术的发展,内镜的作用不仅局限于发现疾病,而且越来越多地应用于疾病治疗上。内镜下套扎、硬化、组织胶注射治疗已成为预防和治疗肝硬化食管胃静脉曲张破裂出血的主要手段,内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)已广泛应用于消化道早癌、癌前病变及其他浅表黏膜病变的治疗。当肝硬化食管胃静脉曲张患者合并有上消化道浅表黏膜病变时,基于内镜的治疗策略就要比单一疾病复杂很多。本研究通过回顾性分析肝硬化食管胃静脉曲张合并上消化道浅表黏膜病变患者的临床资料及内镜下治疗特点,探索此类患者最佳的治疗策略。
1 资料与方法
1.1研究对象收集2017年1月至2018年2月在我院消化内科行内镜治疗的肝硬化食管胃静脉曲张合并上消化道浅表黏膜病变的患者7例。纳入标准:(1)经病史、生化、腹部影像学检查(B超、CT或MRI)等诊断为肝硬化食管胃静脉曲张;(2)经胃镜证实存在食管胃静脉曲张合并上消化道黏膜病变;(3)上消化道黏膜病变经窄带成像放大内镜(ME+NBI)及病理诊断为高级别上皮内瘤变、食管中高分化鳞癌、胃中高分化腺癌、神经内分泌瘤或增生性息肉,其中胃癌、食管癌经超声内镜诊断病变局限于M1(局限于上皮内)、M2(浸润黏膜固有层)、M3(浸润黏膜肌层)或SM1(病变浸润黏膜下层上1/3),且淋巴结转移的证据。
1.2主要器材日本Olympus主机GIF-H260电子胃镜,日本Olympus一次性注射针23G/25G,硬化剂为聚桂醇注射(10 ml/支,陕西天宇制药),组织黏合剂为α-氰基丙烯酸正丁酯(0.5 ml/支,北京康派特公司),美国Wilson-COOK六连发套扎器,日本Olympus主机GIF-Q260J型胃镜,及其相关附件包括前端软式透明冒、注射针、针型切开刀、IT刀,高频电设备为Erbotom ICC200 或VIO200D(德国ERBE),黏膜下注射液为甘油果糖加适量美兰,按1∶100 000配肾上腺素。
1.3治疗方法术前完善常规检查,签署知情同意书,建立静脉通道或留置静脉套管针,禁食8 h。静脉曲张采用LDRf分型[1]进行评估,根据分型及出血风险对食管胃静脉曲张进行内镜下干预。充分衡量静脉曲张出血风险、黏膜病变择期处理风险、患者基础状况等因素后,适时对上消化道浅表黏膜病变行ESD治疗,术后标本常规病理确定边缘及深度。所有操作均由副高以上职称且经验丰富的高年资医师完成。
1.3.1 内镜下食管胃静脉曲张治疗:患者服用口咽部麻醉剂后于清醒状态下接受内镜检查。(1)对于合并食管黏膜病变的静脉曲张,食管静脉曲张采用套扎治疗,胃静脉曲张采用组织胶注射治疗。套扎术后2周复查胃镜,如有食管残留曲张静脉,继续套扎治疗。(2)对于合并胃黏膜病变的静脉曲张,食管静脉曲张直径≤2 cm者可采用套扎治疗,直径>2 cm或不适合套扎者,采用硬化治疗;胃静脉曲张采用组织胶注射治疗。治疗后1~2周复查胃镜,如有残留曲张静脉,继续治疗。
1.3.2 ESD治疗上消化道浅表黏膜病变:患者在全身麻醉下接受内镜治疗。内镜下确定病变部位,采用NBI放大观察或靛胭脂染色,明确其与正常黏膜的交界,用针式切开刀在距离病变边缘0.3~0.5 cm处点状环绕标记,在标记的外缘黏膜下注射至黏膜隆起,距标记点约0.5 cm处用针式切开刀环形切开,IT刀逐步剥离。病灶剥离完毕后对创面上显露的血管应用氩离子凝固术(APC)或电热止血钳做凝固处理,喷洒生物蛋白胶。术毕将病变黏膜回收并展开固定,测量大小,送检病理。术后前3 d禁食、补液、抑酸、抗生素预防感染,无并发症者术后第4天可进流食。术后1个月、3个月复查胃镜。
2 结果
2.1患者一般资料及临床特征入住我科后行内镜下治疗的肝硬化食管胃静脉曲张合并上消化道浅表黏膜病变的患者共7例。男6例、女1例,年龄(56.9±4.5)岁(49~63岁)。7例患者的肝功能Child-Pugh分级均为A级或B级,无C级患者。7例患者中血小板计数<50×109L-1有2例,其中1例国际标准化比值(INR)>1.5。7例患者中有2例黏膜病变位于曲张静脉之上。7例患者的一般情况、临床特征、病变的内镜下表现等见表1。
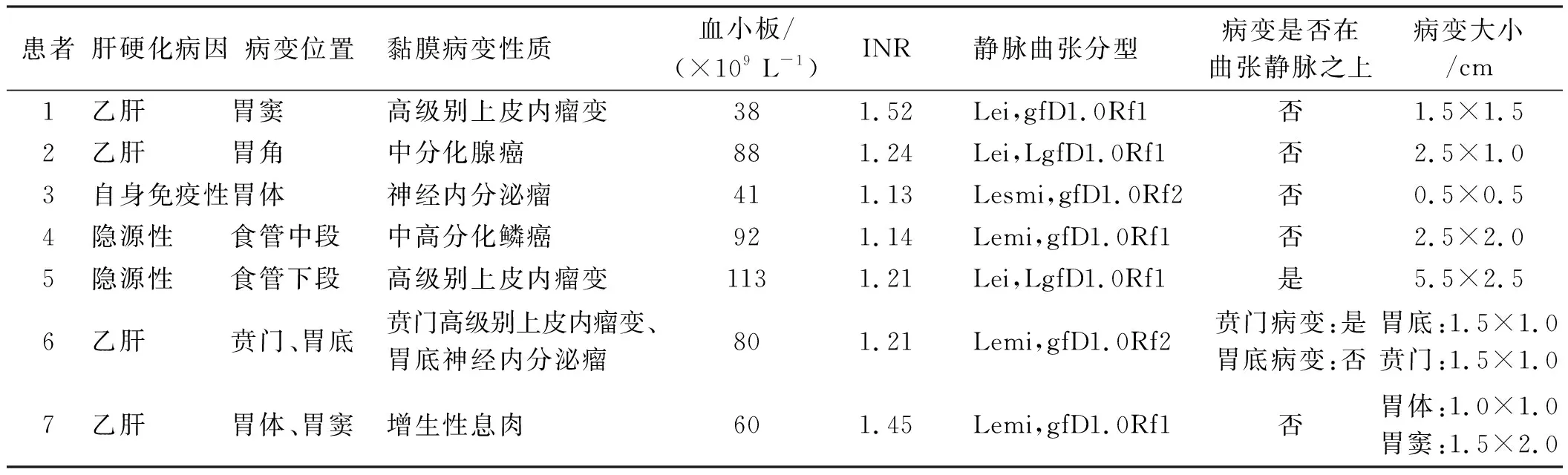
表1 患者的一般情况、临床特征、病变内镜下表现Tab 1 General situation, clinical features and endoscopic manifestations of patients
2.2治疗及随访7例患者中有6例均首先行内镜下食管胃静脉曲张治疗,在治疗后1周~4个月定期复查胃镜,待曲张静脉血栓化或基本消失以及全身状况能够耐受麻醉手术时,适时对上消化道浅表黏膜病变采用ESD治疗。有1例患者在静脉曲张治疗同时处理了合并的胃底黏膜病变,合并的贲门黏膜病变正在随访期间,择期行ESD治疗。内镜下食管胃静脉曲张治疗、ESD术中及术后均未发生静脉曲张或非静脉曲张出血、穿孔等严重并发症,病灶均完整切除,截至目前随访未发现静脉曲张复发以及上消化道黏膜病变复发。7例患者的治疗方法、并发症等见表2。
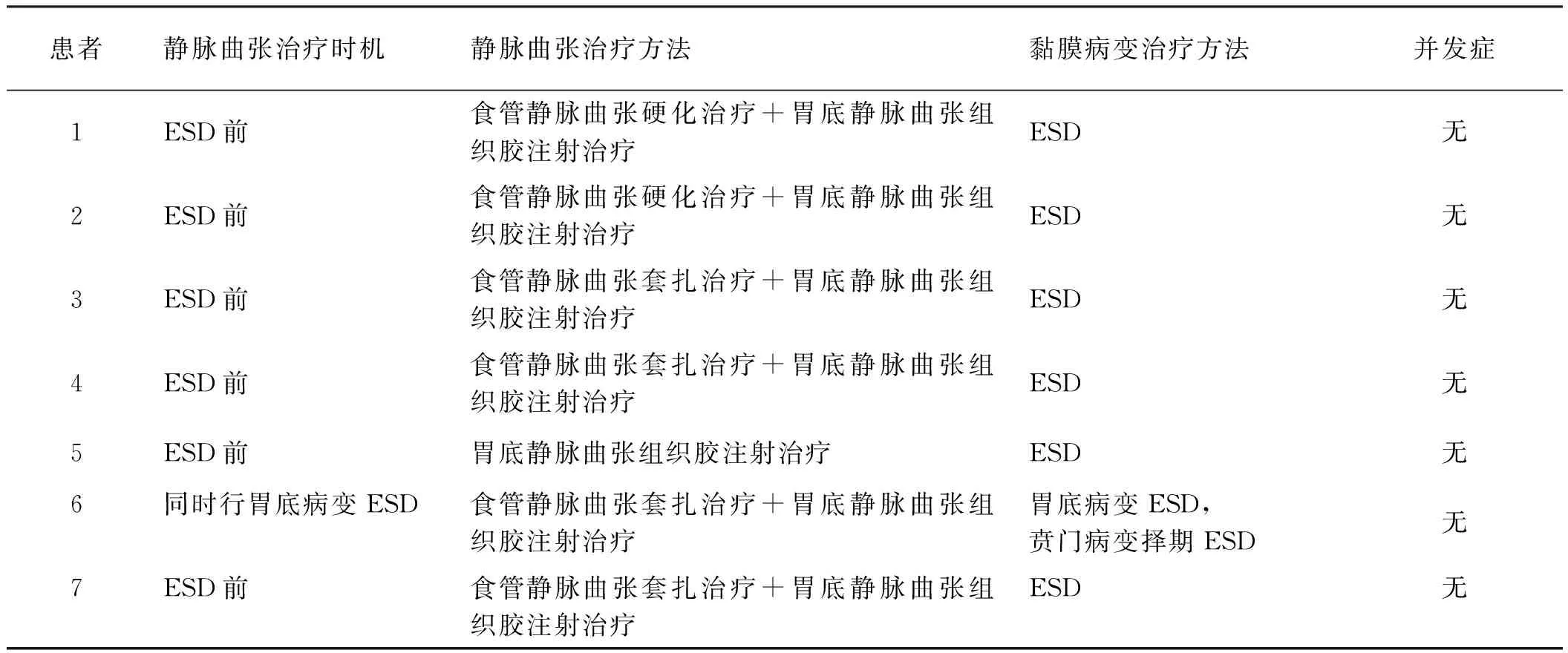
表2 患者的治疗方法、并发症Tab 2 Therapeutic methods and complications of patients
3 讨论
门脉高压症所致食管胃静脉曲张破裂出血是肝硬化失代偿期致命性的并发症,肝硬化患者可能同时存在血小板减少、凝血时间延长等问题,因此肝硬化被认为是外科手术中发生并发症的重要原因;但在内镜下治疗方面,与非肝硬化患者相比,肝硬化患者同样可耐受而且有效[2-4]。在内镜下可对食管胃静脉曲张进行一级预防、二级预防以及治疗静脉曲张急性破裂出血[1]。ESD已广泛用于消化道早癌、癌前病变及其他浅表黏膜病变的治疗,具有创伤小、完整切除率高、利于病理学精确诊断及分期、术后恢复快等优点[5-8]。但同时也要注意到肝硬化患者的内镜下手术具有出血倾向,甚至导致危及生命的大出血[4,9]。ESD的主要并发症为出血和穿孔,而肝硬化食管胃静脉曲张合并上消化道浅表黏膜病变的患者在接受ESD治疗时,其并发出血、穿孔的风险相对于非肝硬化患者更高[10]。因此,对此类患者治疗时机和治疗方法的选择上较单纯静脉曲张或是黏膜病变复杂很多。既往有文献报道[11-13],成功使用EMR或ESD治疗肝硬化食管静脉曲张患者的早期食管癌的病例。另有报道[14-17]证实了肝硬化合并胃早癌患者行ESD治疗的安全性和有效性。本研究回顾了7例内镜下治疗的肝硬化食管胃静脉曲张合并上消化道浅表黏膜病变的病例,7例患者均完成食管胃静脉曲张的治疗,其中6例患者完成黏膜病变ESD治疗,1例多发黏膜病变的患者完成胃底病变ESD治疗,贲门病变择期ESD治疗。所有患者的内镜下食管胃静脉曲张治疗、ESD术中及术后均未发生出血、穿孔等严重并发症,病变均完整切除。
对于肝硬化食管胃静脉曲张合并上消化道浅表黏膜病变患者的具体治疗策略上,我们主要考虑以下3个方面:一是凝血功能是否能耐受手术,二是静脉曲张与黏膜病变的处理时机,三是黏膜病变与曲张静脉的位置关系。
肝硬化失代偿期肝功能减退以及脾功能亢进所致的凝血时间延长、血小板减少等并发症,是患者能够耐受有创性检查、治疗的重要制约因素。有文献报道[10,18],将INR<1.5和血小板计数> 50×109L-1作为肝硬化患者能安全的耐受侵入性手术操作的临界值。而REPICI等[19]认为,INR>1.33和/或血小板计数<105×109L-1患者行ESD后出血的风险可能增加。因此,对于凝血功能较差的患者,可考虑内镜下治疗前输注成分血浆及血小板制品。本研究中7例患者中血小板计数<50×109L-1有2例,其中1例INR为1.52,但考虑到患者肝功能良好,凝血酶原活动度正常,一般情况好,在密切观察下行ESD术,术中严密止血,并应用生物蛋白胶喷洒创面,ESD术后无出血等并发症发生。
对于食管胃静脉曲张与上消化道浅表黏膜病变的内镜下治疗时机的选择,是减少两种治疗发生并发症的关键。国内有文献报道[20],对于伴发食管早癌或胃早癌的食管胃静脉曲张,既可先根除静脉曲张后再行病灶切除,也可先行内镜下病灶切除而后对静脉曲张进行治疗。笔者认为,对于食管胃静脉曲张与消化道黏膜病变的处理上要充分衡量静脉曲张的近期自发破裂风险、ESD术中破裂风险和黏膜病变的择期处理风险等因素后,选择最佳的治疗时机与方法。为了最大限度降低静脉曲张出血风险,同时考虑到黏膜病变的择期处理不影响患者的预后。本研究7例患者中6例均首先行内镜下食管胃静脉曲张治疗,待复查静脉曲张血栓化、基本消失或出血风险显著下降后,再进一步对黏膜病变行ESD治疗。6例患者中有1例食管黏膜病变位于食管曲张静脉上,而胃镜下评估此食管曲张静脉出血风险低,因此只对胃底的曲张静脉进行了组织胶注射治疗。当食管胃静脉曲张的治疗结束后,患者全身状况能耐受手术时,应尽早对黏膜病变行ESD等治疗。若上消化道黏膜病变尤其是早癌需要限期处理,择期处理可能出现肿瘤转移或其他风险,且食管胃静脉曲张出血风险低时,则可优先处理黏膜病变。
黏膜病变与曲张静脉的位置关系对选择治疗方法也至关重要。对于伴发食管黏膜病变的食管静脉曲张,在处理食管静脉曲张时,我们采用了套扎治疗。ESD之前对食管静脉曲张的处理上通常不采用内镜下硬化治疗,特别是病灶位于曲张静脉上时,因为有可能导致黏膜下纤维化甚至瘢痕形成,增加了病灶完整切除的难度[21-22]。FUNAKOSHI等[23]曾报道治疗位于食管静脉曲张上的食管癌时,采用先硬化治疗,待食管曲张静脉消失1周后行EMR,最终因为黏膜下粘连导致了病灶的不完整切除,肿瘤切缘阳性。黏膜病变位于曲张静脉上,相对于黏膜病变与曲张静脉互为孤立,此类患者行ESD的操作难度及风险大为增加,因此术中操作要更为精细、止血要更为准确、术后观察要更为密切。本研究中有1例患者在静脉曲张治疗同时处理了合并的胃底黏膜病变,也是充分考虑到胃底黏膜病变并不在曲张静脉上进行的,而合并的贲门黏膜病变则位于曲张静脉上,所以目前正在密切随访,择期ESD治疗。还有1例患者食管黏膜病变位于食管曲张静脉上,而此曲张静脉出血风险低,对胃底静脉曲张进行彻底治疗后,在食管曲张静脉上对黏膜病变行ESD治疗,术中可见病变黏膜下层存在大量迂曲扩张的静脉。
对于食管胃静脉曲张合并上消化道浅表黏膜病变的治疗,文献也报道了另外的方法。KUNZLI等[13]报道了超声内镜提示食管早癌位于曲张静脉上时,采用直接套扎后观察的方法,最终静脉曲张消失,肿瘤病变坏死脱落。GUGLIELMI等[24]报道了1例食管胃静脉曲张合并严重门脉高压胃病患者,TIPS术后行EMR切除早期胃癌的病例。WANG等[25]报道了8例食管浅表黏膜病变合并食管静脉曲张的病例,其中1例采用套扎治疗后对食管黏膜病变内镜下射频消融治疗,其余7例直接采用内镜下射频消融治疗食管黏膜病变。
总之,对于肝硬化食管胃静脉曲张合并上消化道浅表黏膜病变的内镜下处理,要从患者的凝血功能、静脉曲张与黏膜病变的处理时机以及相对位置关系上综合衡量得出最优治疗策略。
