超声引导下经皮射频消融治疗小肝癌患者疗效及预后分析*
2019-01-23马履翔张雪松
马履翔,张雪松
原发性肝癌(primary liver cancer,PLC)为我国癌症相关死亡的主要原因之一[1,2]。手术切除是治疗PLC的主要手段之一,且效果较好[3]。但由于多种原因,可能导致大多数患者无法接受肝切除手术[4]。对于不适合肝切除手术治疗的PLC患者进行射频消融治疗,可有效消融肿瘤组织,改善患者生命质量。近年来,随着微创手术技术的发展,多数肿瘤患者接受微创手术治疗后恢复较快,效果显著[5]。我们采用超声引导下经皮射频消融治疗了小肝癌患者,观察了疗效,并分析了影响预后的因素,现将结果报道如下。
1 资料与方法
1.1 一般资料 2011年1月~2015年4月在我院接受治疗的PLC患者107例,男性70例,女性37例,平均年龄为(56.3±6.8)岁。经术后组织病理学检查证实为肝细胞癌(HCC),纳入患者肿瘤直径范围为1~3 cm之间,首次诊断,肝功能Child-Pugh为A级或B级。排除标准:①术前接受过放、化疗、靶向治疗或免疫治疗者;②合并其他恶性肿瘤或远处转移者;③存在心、肺等重要脏器功能障碍者;④存在手术禁忌证患者。将患者分成两组,射频消融患者接受超声引导下经皮射频消融术治疗,另组患者接受肝切除术治疗,两组患者在年龄、性别、合并HBV感染、肝内肿瘤数目、肿瘤直径、肿瘤分化程度、肝功能Child-Pugh分级、血清AFP水平方面比较,差异不具有统计学意义(P>0.05),具有可比性。患者及其家属签署知情同意书,本研究经我院医学伦理委员会批准。
1.2 超声引导下经皮射频消融术 在超声引导下将射频消融针穿刺至肿瘤部位,选择适宜的射频电压,开始射频消融治疗,治疗温度为95℃~110℃,治疗时间在5 min左右。治疗后,在B超下观察肿瘤完全消融后,调节机器为凝固模式,烧灼针道。
1.3 肝切除术 根据肿瘤位置,充分游离肝脏,用超声刀切除肝段或肝叶,使用双极电凝对肝断面渗血进行止血,缝合切口。在49例行肝切除术患者中,19例为解剖型肝叶切除术,23例为精准肝段切除术,7例为精准肝段切除术联合胆囊切除术。
1.4 统计学方法 应用SPSS 19.0软件包进行数据分析。对服从正态分布的计量资料以(±s)表示,两组间比较采用独立样本的t检验;对不服从正态分布的计量资料以[M(Q1,Q3)]表示,两组间比较采用秩和检验。计数资料以%表示,组间比较采用x2检验。采用Cox单因素和多因素回归分析影响HCC患者生存的独立危险因素。当P<0.05时,表示差异有统计学意义。
2 结果
2.1 两组基线资料比较 两组患者在年龄、性别、合并HBV感染、肝功能Child-Pugh分级、肿瘤数目、肿瘤直径、肿瘤分化程度和血清AFP水平方面比较,差异不具有统计学意义(P>0.05,表1),具有可比性。
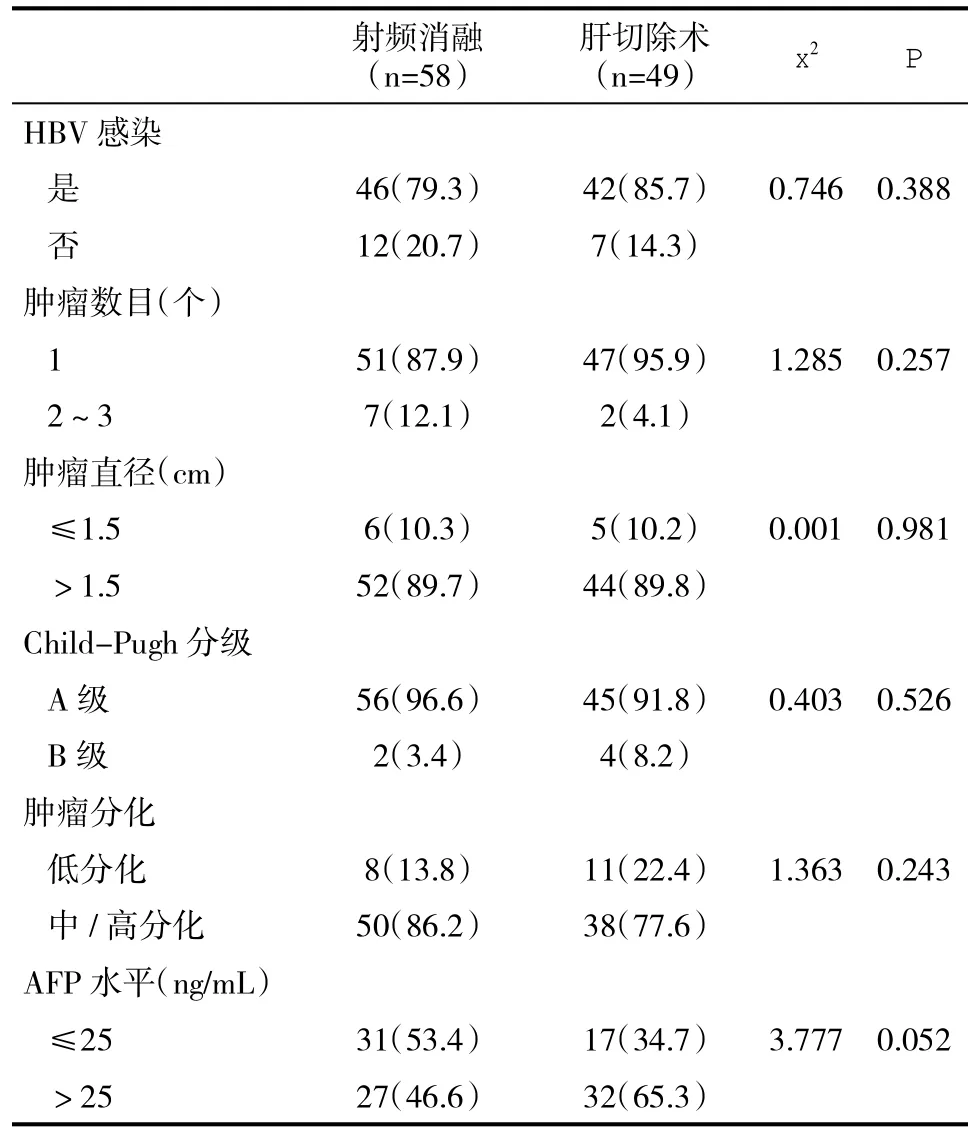
表1 两组基线资料[n(%)]比较
2.2 超声引导下经皮射频消融治疗小肝癌患者影像学变化 直径小于3 cm的HCC患者经超声引导下射频消融治疗后,肿瘤液化(图1)。
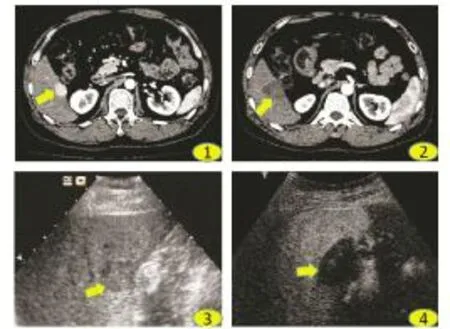
图1 HCC患者治疗前后腹部CT和超声图像变化
2.3 两组手术相关并发症发生情况比较 6例(10.3%)射频消融治疗患者术后发生并发症,其中发热4例,胸腔积液2例;8例(16.3%)肝切除手术治疗患者术后发生并发症,其中肺部感染1例,胸腔积液3例,发热4例。两组患者并发症发生率比较,差异不具有统计学意义(x2=0.836,P=0.361)。
2.4 两组3 a生存率比较 经门诊或电话随访,射频消融治疗患者1 a、2 a和3 a无瘤生存率分别为74.1%(43/58)、62.1%(36/58)和 36.2%(21/58),而肝切除术组则分别为 75.5%(37/49)、67.3%(33/49)和40.8%(20/49),两组无瘤生存率比较,差异不具有统计 学 意 义(x2=0.027,P=0.871;x2=0.323,P=0.570;x2=0.239,P=0.625);射频消融治疗患者 1 a、2 a 和 3 a总生存率分别为 84.5%(49/58)、65.5%(38/58)和44.8%(26/58),而肝切除术组则分别为 85.7%(42/49)、67.3%(33/49)和 46.9%(23/49),两组患者总生存率比较,差异不具有统计学意义(x2=0.032,P=0.859;x2=0.040,P=0.842;x2=0.048,P=0.827,图2)。
2.5 影响HCC患者3年预后的因素分析 将与HCC患者预后相关的年龄、性别、肝功能Child-Pugh分级、肿瘤数目、肿瘤直径、肿瘤分化程度、血清AFP水平和手术方法等因素纳入单因素分析,结果显示肿瘤数目(HR=0.372,95%CI:0.105~0.876,P=0.033)和肿瘤分化(HR=1.745,95%CI:1.202~2.973,P=0.042)与HCC患者术后无瘤生存时间有关,而血清 AFP 水平 (HR=3.043,95%CI:1.007~5.248,P=0.035)、肿瘤数目(HR=0.871,95%CI:0.344~0.902,P=0.401)和肿瘤分化(HR=1.631,95%CI:1.273~3.045,P=0.005)与HCC患者总生存时间有关。进一步纳入Cox多因素回归分析,结果显示肿瘤数目2~3个(HR=0.087,95%CI:0.045~0.498,P=0.009) 是影响HCC患者无瘤生存时间的独立危险因素,而肿瘤分化低(HR=2.974,95%CI:1.865~4.097,P=0.046)、肿瘤数目多(HR=0.062,95%CI:0.033~0.378,P=0.002)和肿瘤直径大 (HR=2.216,95%CI:1.778~5.026,P=0.007)是影响HCC患者总生存时间的独立危险因素。

图2 两组生存曲线比较
3 讨论
随着微创手术的不断完善,超声引导下射频消融治疗PLC患者的疗效得到认可[6-8]。超声引导下射频消融术对患者创伤小,术中出血少,且患者术后恢复快,能获得相近的无瘤生存率和总生存率[9,10]。作为PLC局部治疗方法之一,超声引导下射频消融术具有操作方便、对患者肝功能损伤小等特点,其效果与根治性切除术相当[11,12]。
本研究发现,射频消融治疗患者血清ALT水平低于肝切除术组,血清ALB水平高于肝切除术组,差异均有统计学意义,该结果与有关研究[13]结果一致,表明超声引导下经皮射频消融治疗对患者肝脏损伤小,值得临床应用。超声引导下经皮射频消融治疗不仅可以缩短手术时间,节省医疗资源,而且还能减轻患者的经济负担。但若肿瘤位于肝脏表面或接近血管处,采用经皮射频消融治疗,就容易引发血管损伤,且可能导致肿瘤消融不完全等[14-17]。因此,对于肿瘤位于肝脏表面或接近血管处的PLC患者,建议采用肝切除术进行治疗。对肿瘤位于肝实质中,则不建议采用肝切除术,因为肝切除术将加重患者肝脏功能损伤[18,19]。本研究两组患者并发症发生率比较,差异不具有统计学意义,表明两种手术均较为安全。此外,两组患者1 a、2 a和3 a无瘤生存率和总生存率比较,差异也均不具有统计学意义,可见两种手术效果相当。
通过对107例HCC患者进行为期3年的生存调查,并经分析得知肿瘤数目多是影响肝癌患者无瘤生存时间的独立危险因素,而血清AFP水平高、肿瘤数目多和肿瘤直径大是影响肝癌患者总生存时间的独立危险因素。然而,本研究属于单中心研究,样本量偏少,仍需多中心、大样本研究以证实本研究的结论是否准确,因为样本量偏少可能导致研究结果出现选择偏倚。