一种新生大鼠肝细胞分离改良方法的建立*
2019-01-23郭丽平张成宏宁宝烁徐贝贝李异玲
郭丽平,张成宏,宁宝烁,许 敏,徐贝贝,王 雪,李异玲
肝脏是人体内最大的内脏器官,肝实质细胞是肝脏主要的构成细胞,其中肝细胞(hepatocyte,HC)约占肝脏总质量的60%~80%,发挥胚胎造血、蛋白质合成、胆汁酸生成、糖原储存、解毒、新陈代谢等重要的生理功能。部分肝叶切除术或细胞毒性损伤后体内的HC可再生补充受损的肝细胞[1,2],而体外HC生长活性较差,对于肝脏病理生理、药物代谢、基因治疗等研究造成了一定的阻碍。1969年,由Berry和Friend[3]首先采用两步胶原酶灌注法分离完整的HC,经研究者不断改良,近50年来国内外公认获取大鼠原代HC的方法为Segalen经典两步原位灌流法[4],但这种方法适用于体型相对较大的动物,如成年大鼠、成年小鼠,乳猪等动物,便于进行动静脉穿刺灌流并能够获得可观的细胞数量。成熟大鼠原代HC在体外几乎很难增殖,同时这种方法要求特殊的仪器、大量胶原酶和穿刺技术等多种条件,增加了实验的难度。我们参考Charlotte et al[5,6]的实验方法,建立了一种改良后大鼠原代HC分离技术,即在出生1~3天的大鼠,采用多步酶消化法及组织块贴壁法分离大鼠原代HC,单层细胞培养原代HC。此法简单、易操作,可保持一定的肝细胞数量和活力,也便于普通实验室应用。
1 材料与方法
1.1 动物、试剂和仪器 出生1~3天SPF级SD大鼠,体质量60±10 g,雌雄不限(购于辽宁省长生生物技术公司)。Ⅳ型胶原酶(Sigma公司),0.25%Trypsin-EDTA(Gibico公司),DMEM高糖培养基(BI公司),胎牛血清(BI公司),抗CK-18抗体(PTG公司),鼠/兔二抗(迈新公司),DAB显色试剂盒(迈新公司),台盼蓝(Sigma公司),糖原染色试剂盒(Solarbio公司),PBS缓冲液,0.9%氯化钠溶液。倒置显微镜(Olympus公司),离心机(赫西仪器公司),水浴锅(瑞华仪器公司),孵箱(ESCO公司),血细胞计数板、盖玻片、200目一次性筛网、烧杯、15 ml离心管和50 ml离心管等。
1.2 肝细胞分离与培养 将出生1~3 d大鼠酒精浸泡1 min消毒,断头处死,小心取出肝脏,注意尽量不要剪到肝脏结缔组织,用PBS缓冲液冲洗1遍,剪碎至1~3 mm3大小,PBS缓冲液反复冲洗,至组织上清几乎为透亮溶液。弃上清,加入0.25%Trypsin-EDTA 37℃水浴消化5 min,加入完全培养基终止消化,弃上清,用PBS缓冲液洗涤剩余培养基,弃上清。继续加入0.03%Ⅳ型胶原酶37℃水浴消化10 min,用PBS缓冲液立即稀释胶原酶浓度,收集上清液于离心管,置于4℃。再用PBS缓冲液冲洗、吹打组织块,收集剩余细胞,重复胶原酶消化步骤2次,将收集的所有上清液与组织经200目细胞筛网过滤,50 g离心3 min,重悬细胞悬液。将收集好的细胞沉淀加入含15%血清的DMEM高糖培养液于A培养瓶中培养,在48 h首次换液时,保留四分之一原液,再加入新完全培养液继续培养,每2 d换液1次。将剩余组织块于B培养瓶中共同培养,48 h首次换液,轻轻吹打瓶底,弃掉未贴壁组织块,方法同A瓶加入培养液,继续培养。取细胞悬液,以0.4%台盼蓝1:9染色,在显微镜下用血细胞计数板计数细胞,一只新生大鼠每次可获得约1~2×106单个细胞,接种细胞瞬时活率为78.5±6.5%之间。A培养瓶:48 h换液,可见大约20%~30%左右的细胞贴壁,分布呈单个或3~5个细胞连成片状,细胞较大、透亮、伸展良好、呈多边形,可见为单核或多核,胞质内可见较多的分泌物。在实验中发现,呈片生长的细胞增殖较快,而单个细胞生长相对缓慢,约3~5 d长满瓶底的70%~80%,细胞呈集落生长,逐渐相互靠拢挤压,形成规则大片状分布;B培养瓶:48 h换液后,可见部分组织块贴壁较紧,部分细胞贴壁伸展如A瓶,3 d左右组织块附近开始出现生长晕,细胞爬出较多,细胞之间紧密连接,约3~5 d可长满瓶底的70%~80%。B瓶中细胞形态相对A瓶中较多样,有典型的肝细胞形态、亦混杂少量星状细胞、枯否细胞等非实质细胞,再采用选择性贴壁法纯化肝细胞。经过传代后,细胞形态开始发生变化,逐渐成“纤维样”形态细胞。
2 结果
HC爬片:将长满瓶底70%~80%细胞经0.25%Trypsin-EDTA消化90 s,制成细胞悬液,传于爬片之上,待24 h后,细胞几乎全部贴壁,进行染色鉴定。
2.1 糖原染色 将HC爬片置于Canoy固定液,4℃冰箱内固定1 h。用0.9%氯化钠溶液清洗3次后,用滤纸吸干,将细胞爬片置于PAS试剂盒,加过碘酸氧化水溶液,避光反应10 min,用0.9%氯化钠溶液洗涤3次,将细胞爬片置于Schiff液中,于37℃水浴锅内避光反应20 min后,用0.9%氯化钠溶液洗3次,最后经苏木素复染10 s左右,用流水冲洗爬片,直到背景色被去除,晾干后在镜下观察。在低倍镜下,可见HC多为双核或多核,胞质呈粉色,胞核呈深蓝色;在高倍镜下,在HC胞质中可见密集粉红色的糖原颗粒(图1、图2)。
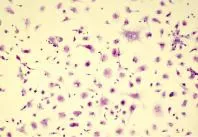
图1 HC爬片 培养第5 d,HC多为双核或多核,胞质呈粉色,胞核呈深蓝色(PAS,100×)

图2 HC爬片 培养第5 d,可见HC胞质中密集呈粉红色的糖原颗粒,糖原染色阳性比率>95%(PAS,400×)
2.2 免疫组化染色 将HC爬片于冷丙酮(提前1 h置于4℃冰箱)中固定20 min,用0.9%氯化钠溶液浸洗3次,将30 ml/L过氧化氢与纯甲醇按l:50混合后,室温浸泡肝细胞爬片30 min,用0.9%氯化钠溶液洗3次,滴加封闭液5%BSA,室温下封闭10 min,吸去多余液体,加1:200稀释的兔抗大鼠CK-18多克隆抗体,37℃孵育30 min,用0.9%氯化钠溶液清洗3次,再滴加聚合辣根过氧化物酶标记的抗兔 IgG,37℃孵育 30 min,PBS冲洗3次,DAB显色,反应10 min,用0.9%氯化钠溶液冲洗3次,滤纸吸干,苏木素复染10 s左右,流水冲洗爬片,直到背景色被去除,晾干后在镜下观察。在低倍镜下,可见胞质呈均质棕黄色,胞核呈蓝色;在高倍镜下,可见细胞内清晰棕色颗粒和蓝色胞核(图3、图4)。
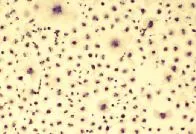
图3 HC内CK-18表达 第5d,可见胞质呈均质棕黄色,胞核呈蓝色(SP,100×)
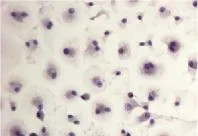
图4 HC内CK-18表达 第5 d,可见细胞内清晰的棕色颗粒和蓝色胞核,棕色部分染色>95%(SP,400×)
3 讨论
肝脏是人体的代谢中心,体外培养的HC是用于研究肝病的常用方法。目前,国内外应用最多的是两步原位胶原酶灌注大鼠肝脏,获得的肝细胞数量可观[7],但成熟肝细胞在体外几乎不增殖,细胞活性也很快下降[8],对于后续研究及实验观察造成了一定的阻碍。据Crawford[9]和Wu et al[10]报道,新生大鼠HC是一种中度分化的细胞,兼具肝祖细胞和成熟HC的特性及功能,且新生大鼠HC增殖能力相对较强,是研究HC功能及肝脏病理生理等变化的最佳选择之一。
实验发现,HC是一种极其脆弱的细胞。我们首先尝试了单用0.25%Trypsin-EDTA消化肝组织,但胰酶作用过于剧烈,作用时间不易把握,导致细胞活率及产量很不稳定。胶原酶只消化细胞间质部分,对细胞损害相对较弱。实验发现,胶原酶处理组织块10~15 min不会影响后期细胞存活率,且其浓度以0.03%为宜,既可以保证细胞产量,也不至于对细胞造成不可修复的损伤。经过反复实验,我们探索一种改良的方法,即先用胰酶+EDTA预处理肝组织块5 min,弃上清(可能包含肝包膜成纤维细胞),经过PBS洗涤,继续使用Ⅳ型胶原酶消化剩余消化组织块2次,每次10 min,分离HC。因组织体积较大,密度较高,运用低速梯度离心可基本去除死亡的肝细胞、细胞碎片及非实质细胞。结合单层细胞培养及组织块贴壁培养法,可以获得足够数量的肝细胞,与既往报道一致[11]。因酶消化呈中心性消化,每次消化后的组织块需要进行充分的洗涤,防止已脱离纤维连接的细胞二次受损。HC悬液于4℃冰箱暂保存,防止细胞活性下降。实验发现,细胞活率和体外操作时间呈反比关系。对于体外操作时间,我们建议不超过2 h,可确保后期细胞贴壁。若体外操作时间大于3 h,培养细胞24 h甚至48 h,基本无肝细胞贴壁。
实验中还发现,48 h首次换液较24 h首次换液,贴壁的细胞更多,与以往的研究略有差异[12],考虑可能受损的HC恢复其细胞膜的完整性较慢,相对需要较长时间适应新的环境。经观察,48 h换液细胞组增殖能力明显强于24 h首次换液组。在首代培养的HC,待长至培养瓶底70%~80%时传代,目的是通过选择性贴壁去除组织块及枯否细胞、成纤维细胞等贴壁力较强的间质细胞[13],传代时注意控制消化时间,吹打力度适中。HC基本可稳定传3~4代,之后细胞生长速度明显减缓。1个月左右,细胞基本不再生长,出现凋亡现象,逐渐变为空泡纤维网状或细胞裂解、凋亡。
肝细胞培养的方式有多种,最常见的有单层细胞培养、与肝非实质细胞共培养[14]、球状模型培养[15]、“三明治”模型培养[16]等多种方法。在本实验中,我们采用单层细胞培养,也取得了较好的效果。
据文献报道[17,18],HC在体外培养时逐渐失去上皮表型,开始退化或向成纤维化表型转变。在本实验中也观察到相似的情况,在普通条件培养下,经过传代后HC逐渐呈“纤维样”形态,但糖原和CK-18表达仍呈阳性。Payushina et al[17]提出小鼠胎鼠HC是一种多功能的间充质干细胞。胎鼠HC经过标准的原代培养及传代后,上皮细胞逐渐消失[17,18],猜测一方面可能是在标准培养条件下,成纤维细胞较上皮细胞竞争力更强;另一方面,可能是上皮-间质转化导致初始表型丧失。Mansuroglu et al[19]在研究大鼠胎鼠特异性表达基因时观察到,传代后的大鼠胎HC不是功能性成熟肝细胞,不仅HC标志物(Prox1)的表达消失了,而且丧失了HC的白蛋白合成和AFP分泌功能。与此同时,剩余大部分细胞为Desmin阳性/α-平滑肌肌动蛋白(alpha-smooth muscle actin,SMA)阳性的成肌纤维细胞,少量Desmin阳性/SMA阴性HC。成肌纤维细胞最有可能来自于胎鼠肝血管壁的间充质细胞群,而不是上皮-间充质转变的结果。然而,上述情况尚未得到充分的证实,需进一步完善相关研究,为肝脏病理生理、毒药物检测以及生物人工肝的研究提供更多的细胞保障。有报道,成熟的HC具有可塑性,可去分化形成肝祖细胞,可能为将来肝脏疾病的治疗产生重大影响[20]。
