血清高病毒载量和乙型肝炎发作孕妇的抗病毒治疗*
2019-01-23朱月永
林 苏,朱月永
乙型肝炎病毒(hepatitis B virus,HBV)感染是中国重大公共卫生问题。2014年全国流行病学调查结果显示,0~4岁、4~15岁、15~29岁人群 HBV感染率分别为0.32%、0.94%和4.38%,较2006年的调查结果明显下降,但育龄女性HBV感染率仍然在6%~8%[1]。另一方面,随着国家二胎生育政策的放开,如何正确处理HBV感染的育龄女性以及如何进一步减少HBV母婴垂直传播的问题仍是我们必须面对的重大课题。除了慢性乙型肝炎患者在抗病毒治疗期间怀孕需要处理外,HBV感染女性在妊娠期间需进行抗病毒治疗也有两个情况:①因孕期慢性乙型肝炎(CHB)病情发作需及时进行抗病毒治疗;②为减少HBV的母婴垂直传播需要进行的抗病毒治疗。
1 乙型肝炎发作的抗病毒治疗
女性在妊娠期出现特殊的生理改变,使得HBV感染的孕妇较同龄人在孕期及产后更容易出现HBV的激活,从而导致肝炎的发作[2]。一项多中心的回顾性研究发现,6%孕妇在妊娠期间出现血清转氨酶升高,而在分娩后3个月内转氨酶升高的比例可达到10%[3]。一方面,肝炎活动对胎儿的发育可能产生不利的影响,如容易出现低体质量儿、早产儿、胎儿宫内窘迫、死胎、新生儿窒息等[4,5];另一方面,乙型肝炎活动会增加孕妇产褥期感染的风险,妊娠期间的乙型肝炎活动严重时可导致肝功能衰竭,危及孕妇生命。因此,为降低孕产妇及胎儿发生疾病的风险,一旦孕期出现乙型肝炎活动,对具有抗HBV治疗指征时应及时进行抗病毒治疗,同时通过积极抗病毒治疗后,降低血清HBV DNA水平也能减少母婴传播的机会,总体利大于弊,因此可适当放宽抗病毒治疗的指征,在征求患者同意后选择妊娠B级的核苷(酸)类似物治疗[6]。关于妊娠期抗病毒药物的选择,多数指南推荐替诺福韦(TDF),部分指南也推荐替比夫定(LDT),少数指南提出拉米夫定(LAM)也可用于妊娠期女性(表1)。抗病毒治疗的疗程可参考普通人群慢性乙型肝炎的治疗疗程。
2 以母婴阻断为目的的抗病毒治疗
母婴传播是新生儿感染HBV的最主要的传播方式,血清HBeAg阳性母亲新生儿HBV感染率为90%,而HBeAg阴性的母亲新生儿感染率为30%。根据WHO的建议,所有新生儿均应在出生后第24 h内接受乙肝疫苗接种。中国专家共识也推荐HBsAg阳性母亲分娩的婴儿,应在出生后12 h内尽早接种乙肝免疫球蛋白100 IU和重组酵母乙肝疫苗10μg/0.5ml[6]。然而,在这种情况下,仍有5%~10%母婴传播发生率,高病毒载量和HBeAg阳性是HBV母婴传播的主要危险因素[6]。最新数据显示,尽管在单因素分析中HBeAg状态和HBsAg水平均影响母婴传播率,但高病毒载量才是造成母婴传播的独立危险因素[7]。因此,降低母体病毒载量可能是在规范免疫接种前提下进一步减少母婴传播的最重要的手段。
2.1 高病毒载量的定义 针对阻断母婴HBV传播的抗病毒治疗,需根据孕妇的HBV感染状态进行评估,孕妇的高病毒载量是重要的决定因素。但至今为止,对于高病毒载量的定义暂未统一。大部分研究认为,新生儿在规范接受乙肝疫苗和免疫球蛋白条件下,母体血清HBV DNA<5.3 lg IU/ml(相当于6 lg copies/ml)时,很少引起HBV传播。随着病毒载量的增高,母婴传播的风险逐步增加。当HBV DNA水平分别为6、7、8和9 log10 IU/ml时,婴儿感染率分别为2.5%、5.7%、12.4%、24.7%[8],相当于每增加1个log10的HBV DNA,母婴传播的风险大约增加一倍。因此,尽管在不同的指南中对于母婴阻断的病毒载量的上限定义稍有不同(表1),但一般认为HBV DNA大于5.3 log10 IU/ml(6 log10 copies/mL)时,就可考虑采用抗病毒治疗进行母婴阻断。
2.2 母婴阻断的效果 近期一项Meta分析结果显示,病毒载量>5.3 log10 IU/ml的孕妇进行抗病毒治疗能够有效阻断母婴传播的风险[9]。可选择的抗病毒药物包括TDF、LDT和LAM(表1),应用抗病毒药物的时机为妊娠24~32 w。国内也有研究认为在妊娠12 w时开始抗病毒治疗进行母婴阻断也安全有效[10]。大多数的随机对照试验(randomized controlled trial,RCT)研究支持应用LDT和LAM在母婴阻断方面的疗效[11-14]。然而,近期两项大型的有关TDF母婴阻断的研究则得出不同的结论。在Calvin Pan[11]的研究中,研究者招募200名HBV DNA>200 000 IU/ml的HBeAg阳性的母亲,以1:1的比例随机分配在TDF组或非抗病毒治疗的对照组,抗病毒治疗时间从妊娠30~32 w直到产后第4 w;产后第28 w检测婴儿血清HBsAg。意向性分析(5% 对18%,P=0.007)和完成性分析(0%对 7%,P=0.01)的结果均显示,TDF组母婴传播率明显低于对照组。泰国学者的类似研究却得到了阴性的结果[15]。在泰国进行的这项多中心、随机双盲的临床试验中,研究者纳入331名HBeAg阳性的孕妇,其中168名接受TDF治疗,另163名接受安慰剂治疗,治疗时间从孕28 w至产后2 m。婴儿出生时,除注射乙肝免疫球蛋白外,还分别在1、2、4、6个月注射乙肝疫苗。所有婴儿在第6个月检测HBsAg。TDF组中婴儿(0%,95%CI:0~2)均未被感染,而安慰剂组中有3名(2%,95%CI:0~6)婴儿感染,两组间无统计学差异(P=0.12)。此项研究的阴性结果与大多数研究结论相反,而有些学者认为,样本量太小、HBV基因型主要为C型、对照组羊膜腔穿刺和剖宫产比例低、出生后免疫接种比较及时、过早进行婴儿HBsAg的检测等原因可能影响了研究结果[16-18]。2016年的Meta分析显示,抗病毒治疗总体来说能够降低母婴传播风险[9],而泰国学者最新的研究结果是否改变Meta分析的结果,还需要更新的Meta分析研究来验证。另外,在更新Meta分析结果时,应当加入试验序贯分析(trial sequential analysis,TSA)估算样本量,以评估Meta分析结果的可靠性。
另外,尽管泰国的这项研究否定了抗病毒治疗对于阻断HBV母婴传播的疗效,然而近期一项回顾性研究却认为,即便病毒载量较低(≥3~6 log10 copies/ml)的孕妇也需要给予抗病毒治疗以进行母婴传播的阻断[19]。这项研究纳入了211例HBV感染的孕妇,其中43例为高病毒血症者(>6 log10 copies/ml),接受LDT治疗,以89例高病毒血症(>6 log10 copies/ml)和79例低病毒血症(≥3~6 log10 copies/ml)患者为对照组,所有婴儿规范接受免疫球蛋白和乙肝疫苗接种,在产后7 m对婴儿进行检测。结果提示,高病毒载量组接受LDT治疗后,母婴HBV传播阻断失败率显著降低(2.4%对16.9%),而未接受抗病毒治疗的低病毒载量组的失败率也高达10.1%。然而,这项研究为回顾性分析,因此病毒载量对母婴传播的影响可能需要更多的前瞻性研究或真实世界的研究确认。
3 产后哺乳与停药
孕妇接受抗病毒治疗进行母婴HBV传播阻断后,分娩后停药和哺乳也是大多数患者关心的问题。有研究显示,产妇服用抗病毒药物进行哺乳时,婴儿血浆TDF水平比治疗剂量低12500倍,并且94%婴儿血浆测不出TDF水平[20],而婴儿血液LAM水平仅为婴儿推荐治疗剂量的2%[21],但由于婴儿接触低水平药物的风险还不清楚,并且药物说明书建议在产妇服用抗病毒药物期间避免母乳喂养,因此亚太和中国的专家共识不建议在抗病毒治疗期间进行母乳喂养[6,22]。对于以母婴传播阻断为目的的抗病毒治疗的停药时机,大多数应用核苷类药物进行的母婴传播阻断的RCT研究认为,停用抗病毒药物后并不增加肝炎发作的机会[15];2018年亚太肝病学会(APSAL)收录的国内学者的一项初步报告也提出,尽管抗病毒药物在停药后有50%患者出现转氨酶水平高于正常上限,但未接受抗病毒治疗者的这一比例更高(68%),故指南推荐在分娩后即刻或产后3个月可安全停用抗病毒药物(表1)。但目前的大部分关于产后停药的研究样本量均不大,前瞻性研究更少,需要大规模的研究对其进行证实。
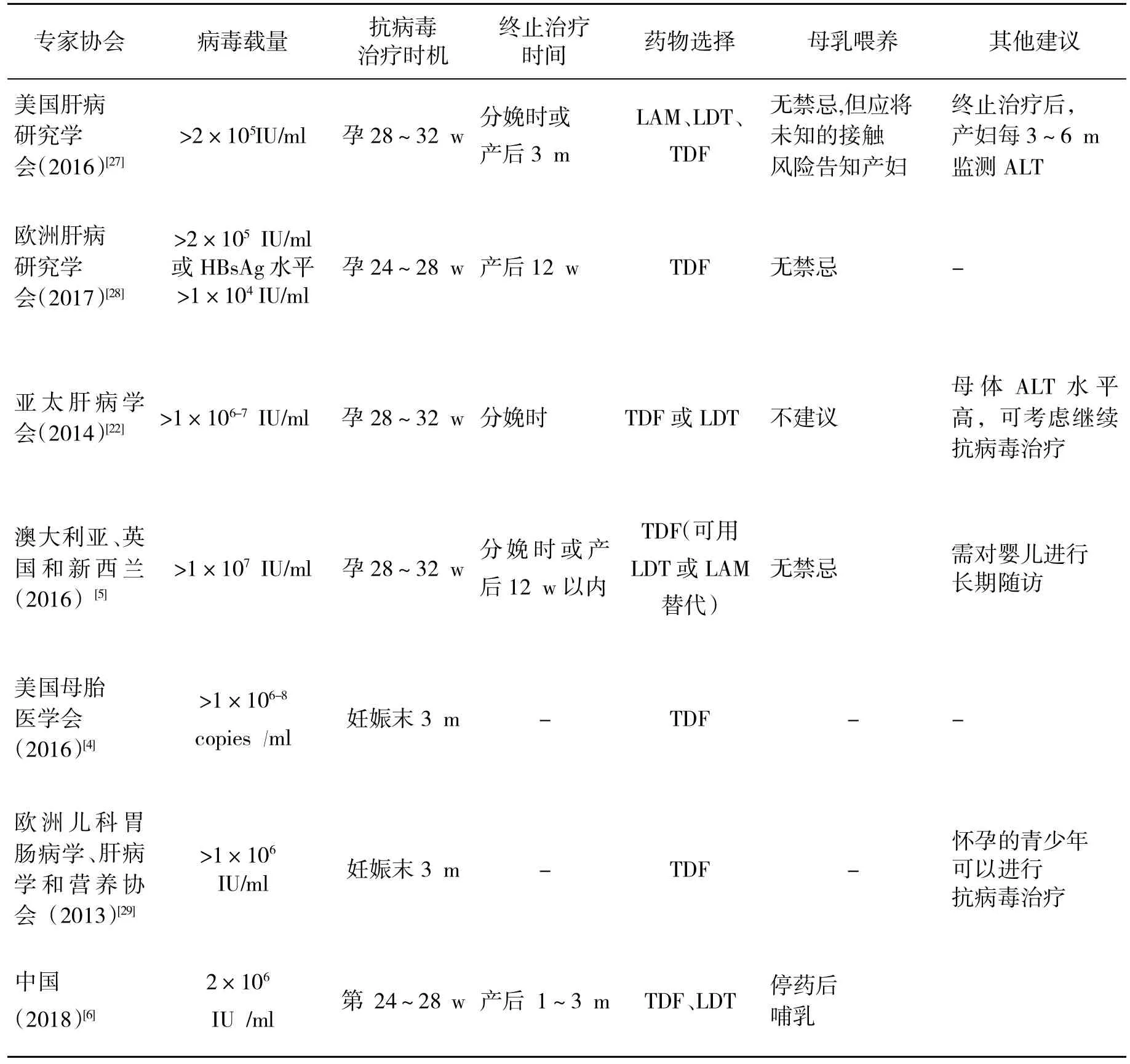
表1 国际专家协会对孕妇抗病毒治疗预防乙肝母婴传播的建议
4 婴儿安全性
大部分数据认为孕期使用LDT抗病毒对婴儿是安全的。来自中国的两项研究对服用LDT的孕妇分娩的婴儿进行长达5年的随访,均未观察到婴儿的出生缺陷或严重不良事件,并且在随访至5岁时也未发现对生长发育有不良影响[23,24]。TDF对婴儿的安全性似乎主要集中在骨磷代谢方面。在HIV感染的母亲接受TDF治疗的前瞻性研究中,449例婴儿在1岁时的身高和头围数值稍低于未暴露于TDF的婴儿,同时发现婴儿的骨密度明显降低[25]。另一项研究发现,母亲怀孕期间服用TDF抗病毒药物时,接受母乳喂养与未接受母乳喂养婴儿的3年生存率无显著性差异,也未发现先天性畸形、肾脏或生长发育异常,产后2岁婴儿生长也不受TDF暴露的影响,但研究发现孕期服用TDF可引起婴儿暂时性的血磷和肌酐清除率下降[26-29]。关于母亲使用TDF治疗对婴儿的安全性目前尚缺乏长期随访的数据,需要进一步的研究证实。
5 结语
目前大多数指南的推荐意见认为,高病毒载量的孕妇接受抗病毒治疗对减少母婴HBV传播具有重要的意义。然而,对于分娩后的处理以及长期的婴儿安全性方面的问题则需要大规模的临床试验或真实世界的研究来进一步确认。