miR-144脂质体复合物体外抑制肝癌细胞增殖和侵袭能力及对裸鼠种植肿瘤的抑制作用初步研究*
2019-01-23许达峰周开伦李灼日武金才陈鑫苹张震生郑进方刘向梅
许达峰,周开伦,李灼日,武金才,陈鑫苹,张震生,郑进方,王 雨,刘向梅
细胞周期蛋白 B1(cyclin B1,CCNB1)在机体生长发育、细胞凋亡、分化和肿瘤形成等病理生理过程中有重要的意义[1-5],研究也发现肝癌组织CCNB1水平较正常肝组织高[6],并与肝癌分级、细胞分化、侵袭性和肝内转移等相关[7,8]。有研究表明,CCNB1高表达与非小细胞肺癌、食管鳞癌等肿瘤患者临床预后密切相关[9,10]。本研究探讨了mi-RNA-144脂质体复合物对HepG2和SMMC-7721细胞在体外的增殖、迁移和侵袭作用,并研究了其在裸鼠体内对种植瘤的抑制作用。
1 材料与方法
1.1 细胞、动物、试剂与仪器 人肝癌SMMC-7721细胞株(ATCC公司);HepG2细胞株(ATCC公司);BALB/c裸鼠(成都达硕实验动物有限公司,鼠龄6~8周)。miR-144质粒(上海华大基因有限公司);DOTMA(Avanti Polar Lipids,Alabaster,AL,USA);大豆卵磷脂(Lipid S100,批号:790589-81903,德国Lipoid公司);胆固醇(上海伯奥生物科技有限公司);氯仿(天津市进丰化工有限公司);DMEM培养基、胎牛血清和胰蛋白酶购自Gibico公司;青链霉素混合液(北京索莱宝科技有限公司);Transwell(Millipore公司,美国);胰蛋白酶-EDTA消化液(中国碧云天生物技术有限公司);EGFP质粒(本实验室抽提)。旋转蒸发器(型号为R-501,上海申顺生物科技有限公司);低温冷却液循环泵(上海豫康科教仪器设备有限公司);超声细胞破碎仪(Sonics&Materials Inc.,Newtown,USA;Model:VCX130;Power:130 w;Frequency:20 kHz);纳米粒度及电位分析仪(Malvern Instruments Limited,Worcestershire,UK.Model:2EN3600);超净工作台(苏净安泰AIRTECH);BB15细胞培养箱(美国Thermo Scientific公司);酶标分析仪(南京德铁实验设备有限公司,BS-1101);BD 流式细胞仪 (Flow Cytometry,美国BD Bioscience公司)。
1.2 miR-144脂质体复合物的制备及表征 取DOTMA、胆固醇和大豆卵磷脂的摩尔比为50:30:20,得到的脂质体溶液总摩尔浓度为10 mM。用薄膜分散法制备DOTMA阳离子脂质体,旋转蒸发1 h,50 r/m,37℃;用 PBS水化 30 min,75 r/m,60℃;将所得脂质混悬液60℃探超3 min(85%,超声3 s、停3 s);将所得的脂质体溶液过0.22 μm 水系滤膜,除去粒径较大的脂质体。按体积/质量比(μl/μg)为 1:1、2:1、3:1、4:1 和 5:1,将制备好的 DOTMA阳离子脂质体与miR-144质粒在室温下孵育30 min,得到miR-144脂质体复合物,用纳米粒度及电位分析仪测所得脂质体的粒径大小、分散度和Zeta电位。
1.3 miR-144脂质体复合物摄取实验 制备载香豆素miR-144脂质体复合物,香豆素的浓度为25μg/ml。将培养的SMMC-7721和HepG2细胞铺在24孔板中,10万个/孔,培养24 h过夜。将体积/质量比为 1:1、2:1、3:1、4:1 和 5:1 的 miR-144 脂质体复合物加入培养过夜的SMMC-7721和HepG2细胞24孔板中,香豆素的终浓度为10 ng/ml,继续培养2 h,收集细胞,用流式细胞仪检测摄取结果。
1.4 EGFP脂质体复合物转染实验 制备DOTMA阳离子脂质体,将DOTMA阳离子脂质体与EGFP质粒按体积/质量比为 1:1、2:1、3:1、4:1 和 5:1 共孵育,制备得到不同体积/质量比的EGFP脂质体复合物。将培养的SMMC-7721和HepG2细胞铺在24孔板中,10万个/孔,培养24 h过夜。将制备得到的EGFP脂质体复合物加入到培养过夜的SMMC-7721和HepG2细胞24孔板中,EGFP质粒为1 μg/孔,继续培养24 h,收集细胞,用流式细胞仪检测摄取结果。
1.5 细胞毒性实验 采用MTT法,取SMMC-7721细胞和HepG2细胞,接种于96孔板,5×103个/孔,培养24 h过夜。实验分为PBS组、游离miR-144组和miR-144脂质体复合物组,分别加PBS、游离miR-144和miR-144脂质体复合物到培养过夜的SMMC-7721细胞和HepG2细胞96孔板中,分别孵育12 h、24 h和48 h,每孔加入MTT溶液20 μL(5 mg/mL),4 h后移去培养液,每孔再加入150μL二甲基亚砜,振摇均匀,用酶标仪测定570 nm处的吸光度,计算细胞生存率,每组细胞设5个重复孔。
1.6 细胞迁移能力检测 采用细胞划痕实验(wound healing assay)法,取SMMC-7721细胞和HepG2细胞,待细胞汇合度达到80%~90%时,分别加入游离miR-144和miR-144脂质体复合物,而空白对照组不作任何处理,每组设5个复孔。12 h后划线,48 h后,应用Image plus软件测量细胞划痕间的迁移距离,重复3次。
1.7 细胞侵袭能力检测 取出-20℃保存的Matrigel胶(BD),置于4℃冰箱过夜,冻融备用。将Matrigel胶和培养液按1:7进行混合,均匀铺满在Transwell小室膜上(50贝/孔),放置于细胞培养箱中;将对照和用miR-144脂质体复合物处理好的SMMC-7721细胞和HepG2细胞进行常规消化、离心后,用无血清培养液重悬细胞,调整为合适的细胞数;将细胞悬液接种到Transwell小室的上室,在24孔板中加入含有血清的培养基,将Transwell小室的上室置于24孔板孔内,共同培养,再置于培养箱中常规培养36 h;3 h后取出Transwell小室,用湿润的棉签小心擦掉微孔膜上层的细胞,用95%乙醇固定5 min,再转移至含有结晶紫的容器中染色5 min,用PBS反复洗3次。在显微镜下计数,每组设3个小室,实验重复3次,取其平均值。
1.8 肿瘤模型的建立及其处理 取对数生长的SMMC-7721细胞和HepG2细胞,用胰酶消化,PBS洗涤3次,用无血清的DMEM培养基重悬细胞,计数,调整SMMC-7721细胞密度为2.5×107个/mL,调整HepG2细胞密度为5×107个/mL。取36只BALB/c裸鼠,随机分成6组,每组6只,分别为SMMC-7721细胞接种组、游离miR-144组和miR-144脂质体复合物组,以及HepG2细胞接种组、游离miR-144组和miR-144脂质体复合物组。在右腋部皮下接种SMMC-7721细胞悬液200 μL(5×106个细胞)或 HepG2细胞悬液 200 μL(1×107个细胞)。在接种细胞 4 d后,用游标卡尺测量肿瘤体积,用天平测量裸鼠体质量,每3 d测量1次。用公式:V=πab2/6(V:体积,a:肿瘤长径,b:肿瘤短径)计算肿瘤体积。肿瘤体积均大于 0.1 cm3为造模成功。在接种细胞成瘤后,分别给予游离miR-144和miR-144脂质体复合物腹腔注射,1次/d;在对照组,则注射等体积的生理盐水,1次/d。连续注射15 d,在注射当天和第 3 d、7 d、9 d、11 d 和 13 d,测量裸鼠体质量和瘤块体积。在第13 d,采用颈椎脱臼法处死小鼠,剥离出完整的瘤块,称量其质量,分别计算游离miR-144和miR-144脂质体复合物抑瘤率,计算公式为:抑瘤率=(对照组平均瘤质量-实验组平均瘤质量)/对照组平均瘤质量×100%。
1.9 统计学方法 采用Epidata 3.1录入数据,应用SPSS 21.0统计软件行统计学分析。计量资料以(±s)表示,采用t检验;计数资料的比较采用x2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 miR-144脂质体复合物的基本特征 随着体积/质量比的增加,miR-144脂质体复合物粒径逐渐减小,Zeta电位逐渐增加(P<0.05);当体积 /质量比为 1:1 和 2:1 时,其多分散性指数(PDI)大于 0.3;当体积 /质量比为 3:1、4:1 和 5:1 时,其 PDI均小于0.3(表1)。

表1 miR-144脂质体复合物基本特征
2.2 细胞摄取miR-144脂质体复合物情况 在摄取2 h,随着阳离子脂质体积/miR-144质量的比例增大,SMMC-7721和HepG2细胞均对miR-144脂质体复合物的摄取增加(P<0.05)。
2.3 细胞转染EGFP脂质体复合物情况 在脂质体体积/EGFP质量(μl/μg)为 3:1时,EGFP脂质体复合物在SMMC-7721细胞和HepG2细胞转染效率最高(P<0.05)。
2.4 各组细胞成活情况 DOTMA脂质体对SMMC-7721细胞和HepG2细胞的毒性较游离miR-144质粒增高。随着孵育时间的延长,miR-144脂质体复合物对SMMC-7721细胞和HepG2细胞的杀伤作用均增加(P<0.05,图1、图2)。

图1 不同孵育时间下miR-144脂质体复合物对HepG2细胞的杀伤作用

图2 不同孵育时间下miR-144脂质体复合物对SMMC-7721细胞的杀伤作用
2.5 各组细胞迁移能力比较 经miR-144脂质体复合物处理过的HepG2细胞和SMMC-7721细胞迁移距离显著短于游离miR-144组和空白对照细胞,差异有统计学意义(P<0.01)。
2.6 各组细胞侵袭能力比较 经miR-144脂质体复合物处理的HepG2细胞侵袭距离为(22.3±4.76)μm,SMMC-7721细胞侵袭距离为(22.3±4.76)μm,均显著低于空白对照组的【(62.6±6.83)μm,P<0.01)】。
2.7 各组荷瘤裸鼠肿瘤体积变化的比较 各处理组和对照组荷瘤裸鼠肿瘤体积均不断增大(P<0.01);与对照组比,接种经过miR-14-LPX处理的SMMC-7721细胞形成的肿瘤体积显著小于对照组和miR-14处理组(P<0.01);接种HepG2细胞形成的肿瘤与接种SMMC-7721细胞相似(表2)。
表2 各组荷瘤裸鼠肿瘤体积(cm3,±s)比较
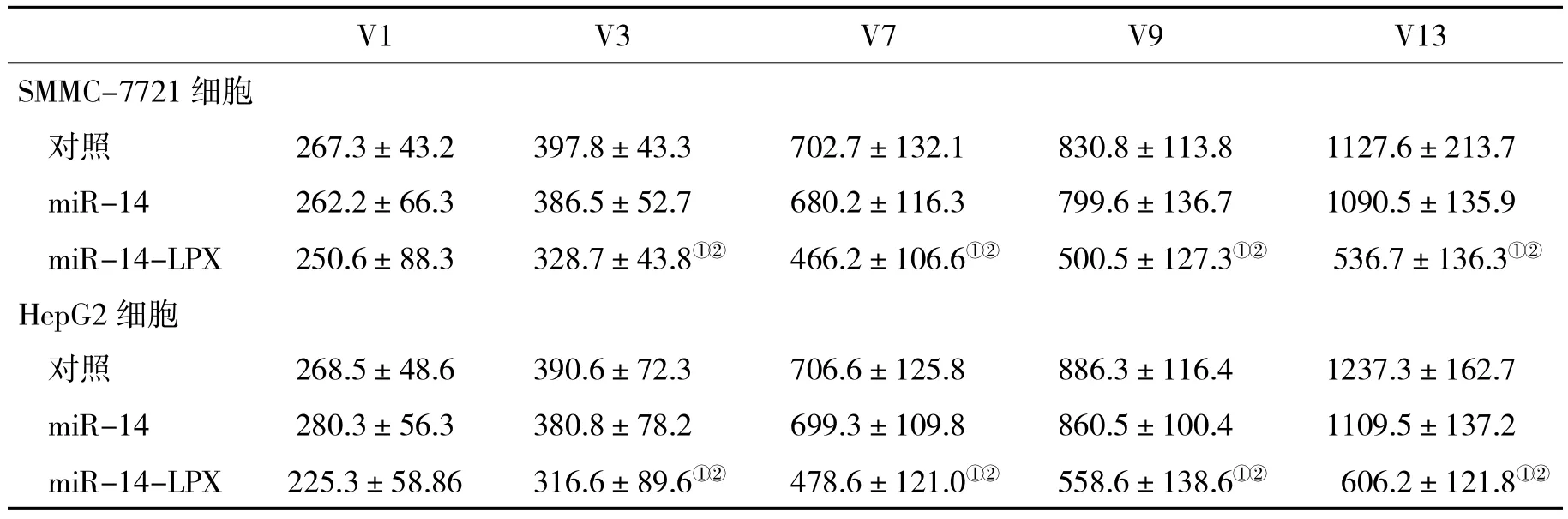
表2 各组荷瘤裸鼠肿瘤体积(cm3,±s)比较
与对照组比,①P<0.01;与 miR-14 组比,②P<0.01
V1 V3 V7 V9 V13 SMMC-7721细胞对照 267.3±43.2 397.8±43.3 702.7±132.1 830.8±113.8 1127.6±213.7 miR-14 262.2±66.3 386.5±52.7 680.2±116.3 799.6±136.7 1090.5±135.9 miR-14-LPX 250.6±88.3 328.7±43.8①② 466.2±106.6①② 500.5±127.3①② 536.7±136.3①②HepG2细胞对照 268.5±48.6 390.6±72.3 706.6±125.8 886.3±116.4 1237.3±162.7 miR-14 280.3±56.3 380.8±78.2 699.3±109.8 860.5±100.4 1109.5±137.2 miR-14-LPX 225.3±58.86 316.6±89.6①② 478.6±121.0①② 558.6±138.6①② 606.2±121.8①②
3 讨论
miR-144能够靶向抑制CCNB1的表达,从而抑制肝癌细胞增殖、迁移和侵袭[11]。本研究发现,当脂质体体积/EGFP质量为3:1时,EGFP脂质体复合物在SMMC-7721细胞和HepG2细胞的转染效率最高。miR-144脂质体复合物对SMMC-7721细胞和HepG2细胞具有杀伤作用。经miR-144脂质体复合物处理的HepG2细胞和SMMC-7721细胞侵袭能力都显著下降[12]。miR-144脂质体复合物能够抑制裸鼠种植瘤的生长。有研究表明,miR-144的可能靶基因包括Apaf-1、Caspase-3和LGR4等,凋亡蛋白酶激活性因子-1与细胞色素形成多聚复合体,并募集Caspase-9前体,从而使其自我剪切并启动Caspase级联反应,引发细胞凋亡。