慢性乙型肝炎患者HBV基因型分布及其耐药基因突变分析*
2019-01-23张欢欢沈思兰陈佳婕宣彬彬
张欢欢 ,杨 欢,沈思兰,陈佳婕,宣彬彬
乙型肝炎病毒(hepatitis B virus,HBV)感染仍是一个世界性的公共卫生问题。全球慢性HBV感染人数约有4.3亿,其中会演变成肝硬化和肝癌者为12%~35%[1]。如今,能够抑制HBV感染患者病情发展的主要方法是应用核苷(酸)类似物【nucleos(t)ide analogues,NAs】和 α- 干扰素治疗[2]。拉米夫定(LAM)、阿德福韦(adefovir,ADV)、替比夫定(telbivudine,LdT)、恩替卡韦(entecavir,ETV)和替诺福韦(tenofovir disoproxil fumarate,TDF)先后上市被应用于临床[3-7]。长期使用NAs会造成HBV变异,造成病毒耐药。如何及时发现潜在的病毒耐药特性而合理地应用NAs治疗有非常重要的临床意义。本文主要探讨了慢性乙型肝炎(CHB)患者HBV基因型分布及其病毒耐药突变情况,现将结果报道如下。
1 资料与方法
1.1 一般资料 2013年8月~2017年8月我院诊治的CHB患者240例,男166例,女74例;年龄为21~65岁,平均年龄为(42.7±12.5)岁。诊断符合《慢性乙型肝炎防治指南》的标准[8]。
1.2 抗病毒治疗方案 本组240例CHB患者接受了NAs治疗,为单药治疗、联合治疗和序贯治疗。联合治疗指两种不同作用机制或互补作用机制的NAs联合使用;序贯治疗或称为转换治疗,即当初始治疗药物出现疗效差或耐药突变时,换用另一种NAs治疗。各种药物治疗均超过3个月。
1.3 检测方法 患者知情同意,采集静脉血。使用日本Wako公司生产的生化分析仪检测血生化指标;采用罗氏电化学发光仪及其试剂检测血清HBV标志物;使用罗氏Cobas-Taqman 48全自动核酸提取检测系统和实时荧光定量PCR法检测血清HBV DNA(检出下限为 20 IU/ml);HBV 逆转录(RT)区的PCR扩增以及序列测定:采用巢式PCR法扩增RT 区,引物为 RTl:5,-AGTCAGGAAGACAGCCTAC TCC-3,RT2:5,-AGGTGAAGCGAAGTGCACAC-3。进行第一轮PCR反应,扩增条件:94℃2 min;94℃45 s,59℃ 1 min,72℃ 70 s,共 35 个循环。引物RT3:5,-TTCCTGCTGGTGGCTCCAGTTC-3,和RT4:5,-TTCCGCAGTATGGATCGGCAG-3。进行第二轮 PCR 扩增,PCR 条件:94℃35 s,56℃ 1 min,72℃ 50 s,共35个循环。将PCR产物纯化后,由广州华大基因公司完成测序;HBV基因型测定:将HBV S基因序列分别与HBV A~H各基因型的标准序列进行比对,差异性<4%者,归为同一基因型;耐药位点分析:应用Blast生物信息学软件对测序结果进行分析。
1.4 统计学分析 应用SPSS 20.0统计学软件,计数资料的比较采用x2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 CHB患者血清ALT和HBV载量情况 240例CHB患者血清ALT水平为(80.3±24.6)U/L,血清HBV DNA 水平为(3.2±1.4)lg IU/ml。
2.2 不同NAs抗病毒治疗患者耐药突变发生率比较 联合或序贯治疗患者耐药突变位点为rtA194T,其耐药突变发生率显著高于恩替卡韦治疗患者(P<0.05,表1)。
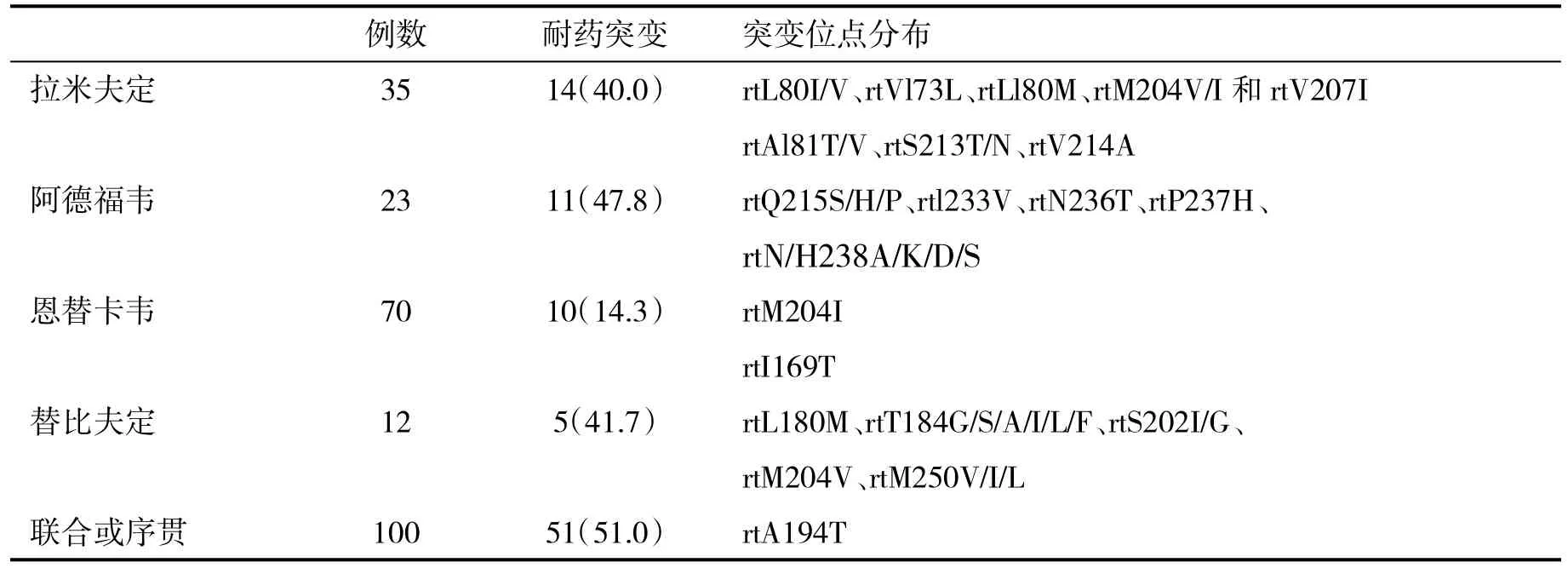
表1 不同药物治疗患者耐药突变率(%)比较
2.3 HBV基因型和耐药突变情况 在240例CHB患者中,B型21例(8.8%)、C型 216例(90.0)、D型3例(1.2%)。在发生耐药突变的91例患者中,B型6例(6.6%)、C型83例(91.2%)、D 型 2例(2.2%)。三种HBV基因型感染患者耐药突变率差异无统计学意义(x2=1.22,P>0.05)。在发生耐药突变的6例B型患者中,有2例(33.3%)发生了多重耐药突变;在发生耐药突变的83例C型患者中,有15例(18.1%)发生了多重耐药突变;D型感染者未发生多重耐药突变病例。
3 讨论
急性乙型肝炎患者康复之后体内仍会存在强烈的针对HBV的特异性应答,尽管如此,由于体内存在的失去转录活性的共价闭合环状HBV DNA(covalently closed circular DNA,cccDNA),而使病毒处于潜伏状态,可能在应激状态下非常容易再次激活HBV感染。治愈CHB患者,理论上要包括两个层面,既要消除肝细胞表面的HBsAg,又要消除肝细胞核内的cccDNA[9]。但是,到目前为止,还没有能够直接将cccDNA清除的抗HBV药物,也还没有被公认为能够稳定检测cccDNA的方法[10]。所以,比较现实的目标是先实现“免疫学治愈”,类似于急性肝炎患者缓解后的免疫功能状态,也就是通过治疗后持续性的病毒学应答将病毒水平压得很低,让肝损伤保持持续的缓解状态,降低肝细胞癌化的风险,这种疗效也叫做“临床治愈”和“功能性治愈”[11]。
功能性治愈的核心是消灭HBsAg甚至是使其发生血清转换,表明在停药之后疾病缓解是持续性的。乙型肝炎病毒感染是导致肝硬化和肝细胞癌的重要原因。32%HBV感染者会发生肝损伤而导致CHB,全球由CHB发展为肝细胞癌者占到85%,清除HBsAg会降低肝细胞癌发生的风险,血清HBV DNA转阴患者发生肝细胞癌的风险大约降低4倍[12]。研究发现,血清HBeAg阴性患者在HBV DNA水平从2000 IU/ml降到1000 IU/ml时,会明显降低癌变的风险[13]。反之,当血清HBV DNA上升超过1000IU/ml时,一般预示着可能会出现肝炎以及疾病的进展。如果在接受治疗之后患者血清HBsAg水平不超过100 IU/ml,通常情况下可以看作为不会导致疾病的复发。另外,血清HBsAg水平也会影响体内共价闭合环状DNA载量[14]。血清HBsAg水平可以作为宿主抵抗乙型肝炎病毒感染能力的评估指标,可能具有潜在的评估CHB患者远期预后的能力。所以,当前治疗CHB患者获得理想效果是血清HBsAg转阴或者是伴HBsAg血清转换[15]。
早期全球的多项临床试验发现Peg IFN-α联合LAM连续治疗CHB患者46~50周,能很快抑制病毒复制,并且具有更低的耐药风险,但是其缺点在于停止给药之后22~24周发现与不联合LAM的单独药治疗者,血清HBsAg阴转和血清转换效果更差些[16]。在另外的前瞻性开放性试验中使用ADV联合Peg IFN-α治疗46周,对患者进行跟踪观察发现2年后CHB患者血清HBsAg阴转率为15%,该研究没有设置单独给药组,所以没有证据能够证明联合使用的效果更好[17]。随着治疗技术的不断发展,结合使用耐药屏障更高的NAs与IFN-α联合,能否获得更好的协同作用受到越来越多的关注。当前,有报道关于联合TDF或单独使用IFN-α的对比治疗发现,联合治疗70周要比单独治疗46周患者在血清HBsAg阴转率方面高出4倍,而单独使用TDF者无阴转。研究发现在参与联合治疗的患者,大部分获得应答者都是A基因型感染者,其他型感染者则少有应答。所以,这种治疗是否适合亚裔人群,还需要不断的探索和评价[18]。
临床上,比较常见的耐药是应用LAM治疗,因为该药开始使用的时间比较早,连续4年单独使用该药物进行治疗会有接近55%~65%患者发生耐药,LAM和Ldt耐药是交叉的,还会促进ETV和ADV使用者的耐药。当前,ETV初始治疗者5年内发生耐药率只有1.3%,但是随着治疗时间持续,特别是经过LAM治疗无效转为ETV治疗的患者会有非常明显的耐药率提高[19]。发生耐药性与病毒基因突变的区域有关。rtM 204V、rtl 180M、rtM2041发生突变并且任意在rtT184、rtS202,rtM250中一个点上被替换掉氨基酸就可以判断为患者对ETV发生耐药。如果出现同时超过两个点被替换,那么病毒株将会成倍地降低对药物的敏感性。
研究发现,rtT 184A/L/F/M/C突变、rtM 250V/L突变和rtS 202G突变都会表现出最高倍数的耐药显型(>90倍)基因表达,基本上都会合并出现rtM 204V耐药基因突变,而一般不会以rtM 204I基因突变为基础框架[20]。在rtT 184I突变出现的时候,一般rtM 204I突变也会存在,这种情况对ETV的敏感度下降18倍,而带有rtM 204I的突变株应该仍对ETV存在敏感性。同时,含有rtT 184S的耐药株对ETV的敏感性也下降了11~14倍。虽然临床上使用核苷酸类似物抗乙型肝炎病毒治疗能够起到抑制病毒复制和控制肝功能的效果,但是仍存在一个较为严重的问题就是使用药物一段时间后会产生耐药问题。
本研究结果显示,240例CHB患者血清ALT水平为(80.3±24.6)U/L,血清 HBV DNA 水平为(3.2±1.4)lg IU/ml。单用应拉米夫定治疗者发生耐药突变率为40.0%,突变位点常见的为rtL80I/V、rtVl73L、rtLl80M、rtM204V/I和rtV207I,单用阿德福韦治疗者发生耐药突变率为47.8%,突变位点为rtAl81T/V、rtS213T/N、rtV214A、rtQ215S/H/P、rtl233V、rtN236T、rtP237H、rtN/H238A/K/D/S,单用恩替卡韦治疗者发生耐药突变率为14.3%,为最低,突变位点为rtM204I,单用替比夫定治疗者发生耐药突变率为41.7%,突变位点为rtI169T、rtL180M、rtT184G/S/A/I/L/F、rtS202I/G、rtM204V、rtM250V/I/L,联合或序贯治疗者发生耐药突变率51.0%,突变位点为rtA194T;在240例CHB患者中,HVB基因型感染者21例(8.8%)、C型216例(90.0)、D型3例(1.2%)。在发生耐药突变的91例患者中,B型6例(6.6%)、C型83例(91.2%)、D型2例(2.2%),三种 HBV 基因型耐药突变率的差异无统计学意义(x2=1.22,P>0.05)。在发生耐药突变的6例B型感染者中,有2例(33.3%)发生了多重耐药突变,在发生耐药突变的83例C型感染者中有15例(18.1%)发生了多重耐药突变,而D型感染者没有发生多重耐药突变的病例。结果表明病毒产生耐药性之后,出现了耐药基因变异,这些变化可能增加了导致慢性肝炎逐步向肝硬化或肝癌发展的可能性。所以,临床上,加强检测和分析这些基因的突变变化,及时发现耐药基因并采取相应的措施调整治疗方案,对于治疗效果的提高有很大的临床意义。