不同HBV感染转归人群外周血PD-1拷贝数分布研究*
2019-01-23邹桂舟郜玉峰
李 芳,邹桂舟,叶 珺,郜玉峰
宿主遗传变异的多样性涉及基因单核苷酸多态性(single nucleotide polymorphism,SNP)和拷贝数变异(copy number variations,CNVs)等[1~3]。CNVs是指在个体基因组中,一段DNA片段的拷贝数在亚微观范畴内发生了变异,导致相对于参考基因组有着不同的拷贝数,这里的DNA片段均大于1kb,这些突变可能是删除或复制或插入的结果,它们通常覆盖了大约15%人类基因组。除了影响DNA序列的拷贝数(copy number,CN)外,CNVs还可以通过数量或位置的改变影响基因表达,并进一步影响到个体疾病的易感性和疾病进展[4-6]。程序性死亡受体-1(programmed cell death-l,PD-1)分子是近年来新发现的一个具有负性调节作用的共刺激信号分子,是一种I型跨膜糖蛋白,属于B7/CD28家族中的一员,含有N-端和C-端两个酪氨酸残基[7~10]。活化的B 细胞、自然杀伤细胞(nature killer cell,NK)细胞和CD4+T细胞等表面可表达PD-1。既往有研究表明PD-1/PD-L1介导的信号通路对于HBV感染慢性化及疾病转归有重要的作用[11]。PD-1一共有50多个SNP基因位点,其中多个基因位点多态性与HBV感染后不同转归密切相关[12]。本研究采用Accu Copy检测技术分析了HBV感染不同临床型人群外周血PD-1基因拷贝数分布频率的差异,以了解机体免疫遗传学背景对HBV感染转归的影响。
1 资料与方法
1.1 研究对象 2014年6月~2017年6月我院诊治的汉族HBV感染者1109例,其中809例为血清HBsAg阳性超过6个月的慢性感染者,另300例为既往有急性或CHB病史,但血清HBsAg阴性,HBsAb阳性或阴性,HBcAb阳性,HBV DNA低于最低检测限,血清ALT水平正常,被定义为HBV感染恢复。在809例慢性HBV感染者中,437例为CHB患者,249例为LC患者,123例为HCC患者。排除药物、自身免疫、酒精、合并其他嗜肝病毒感染造成的肝损伤,排除妊娠妇女。所有研究对象签署知情同意书,本课题已通过我院医学伦理委员会审批。
1.2 外周血PD-1基因拷贝数检测 采集受试者外周血2 ml,置于EDTA-K2管,使用QIAGEN基因组DNA提取试剂盒提取基因组DNA,纯化,置于-20℃冻存。采用多重AccuCopy技术检测PD-1基因2个目的DNA片段CNVs。采用文献报道[13]的方法,合成PD-1特异性引物和竞争模板(表1)。根据Genesky生物技术要求,设计并合成了12个目标段的竞争DNA,进行多重PCR扩增,将PCR产物稀释20倍后,上样至ABI3 730XL测序仪(Applied Biosysterns公司,美国),经PCR扩增,采用毛细管电泳法分离DNA片段,采用GeneMapper4.0软件分析。通过目的基因与内参基因S/C值比较,进行均一化处理,得到绝对定量的PD-1基因拷贝数。
1.3 统计分析 应用SPSS 16.0软件分析,采用卡方检验比较各组之间PD-1拷贝数分布频率;选择5个可能影响慢性HBV感染结局的指标(HBeAg滴度、年龄、性别、病毒载量、PD-1拷贝数),行Logistic回归分析,运用逻辑回归模型分析变量与疾病结局的关系,P<0.05提示具有统计学差异。

表1 PD-1特异性引物和竞争模板
2 结果
2.1 各组人群基线资料 见表2。
表2 各组人群基线资料(n,±s)
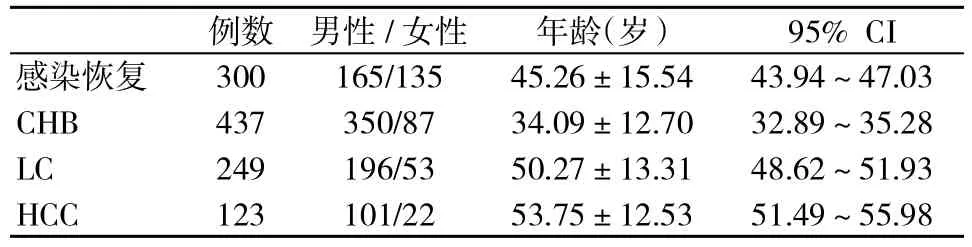
表2 各组人群基线资料(n,±s)
例数 男性/女性 年龄(岁) 95%CI感染恢复 300 165/135 45.26±15.54 43.94~47.03 CHB 437 350/87 34.09±12.70 32.89~35.28 LC 249 196/53 50.27±13.31 48.62~51.93 HCC 123 101/22 53.75±12.53 51.49~55.98
2.2 各组PD-1基因拷贝数分布频率比较 将2个拷贝和3个拷贝合并为多倍体,1拷贝被认为是单倍体。与HBV感染恢复组比,LC组多倍体显著升高(x2=4.473,P=0.034);CHB、LC 和 HCC 患者外周血PD-1基因拷贝数分布差异无统计学意义(x2=3.256,P=0.196,表3)。
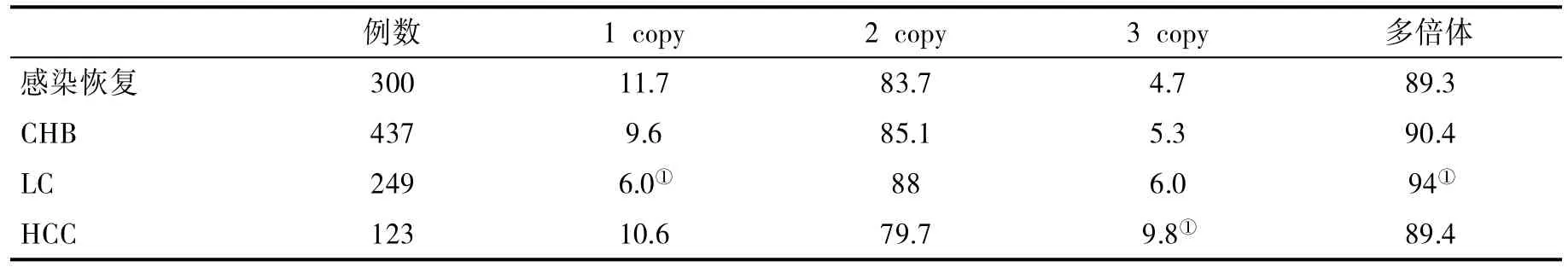
表3 各组PD-1基因拷贝数分布频率(%)比较
2.3 影响HBV感染结局的因素分析 将年龄、性别、PD-1的CN、HBV DNA和HBeAg滴度赋值,建立多元回归方程,以CHB作为估计参数,结果影响疾病预后的因素是年龄(x2=126.717,P=0.000)和 HBV DNA(x2=44.155,P=0.000,表4)。其中年龄≥40岁是由CHB进展至LC或HCC的危险因素,而HBeAg阴性患者更有可能由CHB进展至HCC。

表4 多元Logistic回归分析
3 讨论
近些年来的研究发现,PD-1是一种负性调节作用的共刺激信号分子,它以单体的形式表达于CD4+和CD8+T细胞、B细胞、自然杀伤细胞、骨髓细胞和树突状细胞等细胞表面[14,15]。通常,PD-1与其两个配体PD-L1和PD-L2共同组成信号通路以发挥负性调节作用。研究表明,在慢性HBV感染患者肝组织肝细胞表面可以出现PD-L1的过度表达,通过PD-1/PD-L1的信号通路进一步导致CD8+T细胞的功能受到抑制,从而发生T细胞功能的耗竭,淋巴细胞分泌的一些抗病毒细胞因子如IFN-γ和TNF-α的表达减少,从而导致了病毒感染呈现持续存在的状态[16]。同时,PD-1的上调则有利于Th2细胞因子产生IL-10,而降低Th1细胞分泌IFN-γ,从而也可导致病毒感染的慢性化[17]。除此之外,不同宿主之间的免疫反应程度存在不同,因此研究者们认为HBV感染的结果受到病毒和宿主遗传多样性的影响,其中包括SNP和基因的CNVs。本研究通过对HBV感染不同临床型人群外周血PD-1的CNVs的检测和统计分析,发现HBV感染恢复人群与LC组之间在PD-1基因拷贝数分布频率上存在着差异,即与HBV感染恢复者比,LC组PD-1多倍体所占比例更高,而其他各组间PD-1拷贝数差异无统计学意义。研究发现,17.7%基因多态性与拷贝数变异有直接相关性,并且这些拷贝数变异大部分与基因的表达呈正相关关系,其中仅仅大约有15%表现出负相关关系[18]。针对PD-1基因拷贝数与HBV mRNA水平进行的比较分析发现两者基因表达水平之间并不是简单的正相关或负相关关系,而是存在着十分复杂的调控关系[19]。根据上述理论,结合本研究结果提示慢性HBV感染可能与PD-1的高表达有关,发生这种改变考虑与机体的自我保护性调节作用有关。一方面机体长期受HBV感染,导致病毒特异性T淋巴细胞PD-1表达增加,从而产生一种保护性的调节作用,导致机体免疫应答下调,避免持续活化的免疫应答导致机体组织产生免疫病理性损伤,但同时另一方面,PD-1信号通路的持续活化又抑制了CD8+T淋巴细胞功能,使其发生功能衰竭,从而使乙型肝炎病毒难以完全清除,导致了感染的持续化[20]。这种调节机制与本研究结果相符合,经过统计学分析发现PD-l基因拷贝数高的人群主要集中在肝硬化组,因此我们认为很有必要对PD-1基因呈多拷贝数的慢性HBV感染者进行长期的追踪及随访,以及时观察疾病的进展,防止其进展至终末期肝病阶段。同时,我们希望可以通过阻断PD-l/PD-L1这条信号通路来提高机体特异性T淋巴细胞的功能,从而有利于清除的病毒,这也为进一步进行慢性HBV感染的防治研究开辟了新的方向。虽然我们研究发现HBV感染恢复者与LC组外周血PD-1基因分布频率存在拷贝数差异,但将慢性HBV感染组再根据疾病进展分为CHB、LC和HCC三组,并进行统计学分析后发现这三组之间PD-1基因拷贝数分布频率无明显差异,我们综合分析其原因可能有以下几种:1,CNVs并不是控制HBV感染预后的唯一遗传易感因素,CNVs与基因表达之间存在着十分复杂的调控关系。在未来进行研究时可将多种遗传易感因素联合起来进行关联研究;2,影响慢性乙型肝炎感染后转归的因素除了考虑其HBV DNA水平外,同时还要考虑HBV RNA及其蛋白水平,因此将三者联合起来进行研究可更明确基因的调节是如何进一步影响疾病转归的;3,本研究为单中心选择样本,影响结果的因素较多,比如诊断的标准化、人口学配比、诊断和检测试剂的统一、不同临床疾病诊断的统一及其临床分度或分期、并发症或合并症、受教育程度、经济状况、治疗药物选择、不同治疗方法等等,都可能会出现选择偏倚或影响结果分析。所以,在今后的研究中需要进一步扩大样本量,从而可以更有效地统计分析研究结果。
既往研究发现PD-1表达水平与肝脏发生炎症损伤的程度存在相关。所以,我们认为宿主PD-1基因多态性在不同HBV感染转归人群是不同的,从而可以在某种程度上影响个体的疾病表现形式,值得我们展开进一步研究。在今后的研究中,不仅需要观察外周血T淋巴细胞PD-1 mRNA水平,更需要进一步研究在肝组织内T淋巴细胞PD-1表达情况以及PD-1表达与肝组织炎症程度的相关性,并且进一步准确地分析PD-1 CNVs对于PD-1基因表达的影响,从而进一步开展基因拷贝数的功能性研究,以阐明PD-1在乙型肝炎病毒感染过程中的具体作用机制,为慢性乙型肝炎的防治提供一个新的思路和研究方向。